
- •3. Вычислить массу соли, образовавшейся при взаимодействии 20г. Гидроксида натрия с азотной кислотой.
- •3. Определите с помощью характерных реакций каждое из трёх неорганических веществ: CuCi2, FeCi3, ZnCi2.
- •Пробирка:
- •Пробирка:
- •Пробирка:
- •3. Рассчитать массу гидроксида меди (II), образующегося при взаимодействии 0,5моль гидроксида калия с хлоридом меди(II).
- •3. Определите с помощью характерных реакций каждое из веществ: глицерин, уксусная кислота, крахмал.
- •1 Пробирка:
- •2 Пробирка:
- •3 Пробирка:
- •3. Получите гидроксид магния и вычислите массы исходных веществ, необходимых для получения 29г. Гидроксида.
- •3. Какая масса нитрата цинка образуется при взаимодействии 16,2г. Оксида цинка с азотной кислотой, масса которой равна 30г.?
- •3. Проведите реакции, подтверждающие химические свойства карбоновых кислот на примере уксусной кислоты.
- •Найти молекулярную формулу углеводорода, массовая доля углерода в котором составляет 80%, водорода – 20%. Относительная плотность углеводорода по водороду равна 15.
- •3. При сгорании углеводорода получится 55г. Углекислого газа и 27г. Воды. Плотность углеводорода по воздуху равна 2,48. Определить формулу углеводорода.
- •3. Проведите реакции, подтверждающие качественный состав сульфата меди (II).
- •Реакция на ионы so4 2-.
- •3. Какую массу оксида кальция можно получить при разложении 600г. Известняка, содержащего 10% примесей?
- •3. Испытать индикаторами растворы карбоната натрия и сульфата цинка. Объяснить результаты наблюдений.
- •3. Какова масса осадка, образующегося при взаимодействии 200г. 20% раствора гидроксида натрия с раствором сульфата меди (II)?
- •3. Получите гидроксид цинка и проведите химические реакции, характеризующие его амфотерные свойства.
- •3. Рассчитать объём выделившегося газа, образованного при взаимодействии карбоната кальция с 4,9г. Серной кислоты.
- •3. Докажите, что глицерин относится к классу многоатомных спиртов.
- •3. Вычислить тепловой эффект реакции взаимодействия натрия с хлором, если при расходовании 5,6л. Хлора выделяется 205 кДж теплоты.
- •3. Определите с помощью характерных реакций каждое из веществ:
- •1 Пробирка:
- •2 Пробирка:
- •3 Пробирка:
- •3. Проверьте реакции, подтверждающие качественный состав хлорида железа (III).
- •3. Осуществите превращение: CuCl2 → Cu(oh)2→ CuO
- •3. После полного растворения магния в соляной кислоте образовалось 2,3г. Хлорида магния. Найти массу хлорида магния, если массовая доля выхода соли от теоретически возможного составляет 95%.
- •3. Получите этилен и проведите реакции, характеризующие его свойства
Ответы
на дополнительное (третье) задание
к билетам по химии
(2 курс)
Билет№1.
3. Вычислить массу соли, образовавшейся при взаимодействии 20г. Гидроксида натрия с азотной кислотой.
Дано:
m (NaOH) = 20 г __________________ Найти: m (NaNО3) - ?
|
Решение:
NaOH + HNO3 = NaNO3 + H2O m = M ∙ n ( 1 ) M(NaOH) = 23 г/моль + 16 г/моль + 1 г/моль = 40 г/моль
n =
n =
(NaOH) =
n (NaNO3) = n (NaOH) = 0,5 моль M (NaNO3) = 23 г/моль + 14 г/моль + 16 ∙3 г/моль = 85 г/моль m (NaNO3) = M ∙ n = 85 г/моль ∙ 0,5 моль = 42,5 г. Ответ: m(NaNO3) = 42,5 г.
|
Билет№2.
3. Определите с помощью характерных реакций каждое из трёх неорганических веществ: CuCi2, FeCi3, ZnCi2.
Выполнение опыта:
Пробирка:
Чтобы определить
хлорид меди CuCl2
надо добавить гидроксид натрия NaOH,
образуется осадок синего цвета –
гидроксид меди Cu(OH)2![]() .
.
CuCl2 + 2NaOH = 2NaCl + Cu(OH)2 .
Пробирка:
Чтобы определить хлорид железа FeCl3, надо добавить гидроксид натрия NaOH, образуется осадок бурого цвета (ржавчина) – гидроксид железа Fe (OH)3
FeCl3 + 3NaOH = Fe (OH)3 + 3NaCl
Пробирка:
Чтобы определить хлорид цинка ZnCl2, надо добавить гидроксид натрия NaOH, образуется осадок белого цвета – гидроксид цинка Zn (OH)2
ZnCl2 + 2NaOH = Zn (OH)2 +NaCl.
Билет№3.
3. Рассчитать массу гидроксида меди (II), образующегося при взаимодействии 0,5моль гидроксида калия с хлоридом меди(II).
Дано:
n(KOH) = 0,5 моль __________________ Найти: m (Cu(OH)2) - ?
|
Решение: CuCl2 + 2KOH = Cu (OH)2 + 2KCl n
(Cu (OH)
2)
= M(Cu(OH)2) = 64 г/моль + 2 ∙ (16 г/моль + 1 г/моль) = 98 г/моль
m (Cu(OH)2)= M ∙ n = 98 г/моль ∙ 0,25 моль = 24,5г. Ответ: m (Cu(OH)2) = 24,5г. |
Билет№4.
3. Определите с помощью характерных реакций каждое из веществ: глицерин, уксусная кислота, крахмал.
Выполнение опыта:
1 Пробирка:
Чтобы определить глицерин, надо добавить гидроксид натрия NaOH и по каплям добавить сульфат меди CuSO4, образуется осадок синего цвета – гидроксид меди Cu(OH)2, смесь встряхнуть, осадок растворяется, появляется раствор ярко-синего (василькового) цвета – глицерат меди.
CuSO4 + 2NaOH = Na2SO4 + Cu (OH)2 .
C H2
—
OH CH2
—
O
H2
—
OH CH2
—
O

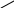 Cu
Cu
CH — OH + Cu(OH)2 = CH — O + 2H2O
CH2 — OH CH2 — OH
2 Пробирка:
Чтобы определить уксусную кислоту CH3 COOH, надо добавить карбонат натрия Na2CO3, происходит бурное выделение углекислого газа CO2.
2CH3
COOH + Na2CO3
= 2CH3
COONa + CO2![]() + H2O
+ H2O
3 Пробирка:
Чтобы определить крахмал, надо добавить по каплям йод I2, появляется синее окрашивание.
Билет№5.
3. Рассчитать, какой объём кислорода потребуется для сжигания 5л. метана CH4.
Дано:
V (CH4) = 5л __________________ Найти: V (O2) - ?
|
Решение: CH4 + 2O2 = CO2 +2H20 V = Vm ∙ n (1) n
=
n
(CH4)
=
=
n (O2) = 2 ∙ n (CH4) = 2 ∙ 0,22 моль = 0,44 моль V (O2) = Vm ∙ n = 22,4 л/моль ∙ 0,44 моль = 9,9 л.
Ответ: V(O2) = 9,9 л. |
Билет№6.
3. Провести реакции, подтверждающие химические свойства кислот на примере азотной кислоты.
Выполнение опыта:
Все кислоты в водных растворах в результате электролитической диссоциации содержат ионы Н+, наличие которых определяет их характерные свойства.
В пробирку поместить несколько капель раствора азотной кислоты HNO3 и опустить лакмусовую бумагу (лакмус). Появление красной окраски свидетельствует о присутствии в нем кислоты.
Взаимодействие с металлами. В пробирку поместить одну гранулу цинка Zn и добавить раствор азотной кислоты HNO3. Протекает заметная реакция с образованием газа водорода H2 .
Zn + 2 HNO3 = Zn (NO3)2 + H2
Взаимодействие с оксидами металлов. В пробирку поместить небольшое кол-во оксида железа (III) Fe2O3 и добавить азотной кислоты HNO3. Постепенно происходит образование прозрачного раствора.
Fe2O3 + 6HNO3 = 2Fe (NO3)3 + 3H2O
Взаимодействие с основаниями. В пробирку налить гидроксид кальция Ca(OH)2 – раствор белого цвета и добавить азотную кислоту HNO3. Раствор обесцветился.
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O
Взаимодействие с солями более слабых кислот. В пробирку насыпать карбонат натрия Na2CO3 и по каплям вводить раствор азотной кислоты HNO3. Наблюдается образование углекислого газа CO2 в результате разложения образующейся нестойкой угольной кислоты H2CO3.
Na2CO3 + 2HNO3 = 2NaNO3 + H2CO3
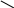
H2O CO2
Билет№7.
3. Какую массу этилена необходимо потратить для получения 1,5моль этанола?
Дано:
n(C2H5OH)=1,5 моль __________________ Найти: m (С2H4) - ?
|
Решение:
C2H4 + H2O = C2H5OH m = M ∙ n (1) n (C2H4) = n (C2H5OH) = 1,5 моль M (C2H4) = 2 ∙ 12 г/моль + 4 ∙ 1 г/моль = 28 г/моль m (C2H4) = M ∙ n = 28 г/моль ∙ 1,5 моль = 42 г.
Ответ: m (C2H4) = 42 г. |
Билет№8.
