
- •58. Теорема Нернста. Формулювання третього начала термодинаміки. Наслідки із третього начала термодинаміки.
- •59.Метод термодинамічних потенціалів. Внутрішня енергія як термодинамічний потенціал. Співвідношення Максвела.
- •60.Метод термодинамічних потенціалів. Вільна енергія як термодинамічний потенціал. Співвідношення Максвела і рівняння Гіббса-Гельмгольца.
- •61.Метод термодинамічних потенціалів. Ентальпія як термодинамічний потенціал. Співвідношення Максвела і рівняння Гіббса-Гельмгольца.
- •62. Метод термодинамічних потенціалів. Термодинамічний потенціал Гібса. Співвідношення Максвелла і рівняння Гібса-Гельмгольца.
- •63. Рівняння Ван-дер-Вальса. Їзотерми Ван-дер-Вальса. Взаємні перетворення пари та рідини.
- •64.Критичний стан. Критичні параметри. Методи визначення критичних параметрів. Зведене рівняння Ван-дер-Вальса.
- •65. Внутрішня енергія газу Ван – дер – Ваальса.
- •66. Ефект Джоуля-Томсона.
- •67.Зрідження газів і методи одержання низьких температур(Джоуля-Томпсона, адіабатного розширення, адіабатного розмагнічення). Машини Клода і Лінде.
- •68. Рідини, дифузія, в’язкість.
- •69.Явище поверхневого натягу
- •70. Крайові кути.Змочування.Умови рівноваги на межі трьох рідин та на межі рідини з іншим середовищем.
- •71.Кривизна поверхні і додатковий тиск . Формула Лапласа . Капілярні явища
- •72.Капілярно-гравітаційні хвилі. (Доведення)
- •73.Кристалічний та аморфний стан речовини.
- •74. Просторові кристалічні гратки. Сингонії. Гратки Браве.
- •75. Атомні площини. Індекси Міллера.
- •76 . Поверхнева енергія і зовнішня форма кристала . Закон Кюрі та Вульфа .
- •77. Класифікація кристалів за типами зв’язку в кристалічній гратці.
- •78. Дефекти кристалічної гратки. Дефекти за Шотткі і за Френкелем. Температурна залежність концентрації.
- •79.Теплоємність твердих тіл. Закони Дюлонга і Пті та Джоуля і Каппа. Недоліки класичної теорії теплоємності твердих тіл.
- •80. Квантова теорія теплоємності твердих тіл Планка-Енштейна.
- •81. Квантова теорія теплоємності твердих тіл Дебая-Борна . Температура Дебая.
- •83. Кипіння та конденсація на ядрах.. Камера Вільсона, бульбашкова камера.
- •84. Фазові переходи II роду. Співвідношення Ернста
- •85. Рідкі розчини. Закон Генрі. Закон Рауля. Наслідки з них.
- •86. Осмос. Осмотичний тиск. Закон Вант-Гоффа. Вплив дисоціації під час розчинення на осмотичний тиск.
83. Кипіння та конденсація на ядрах.. Камера Вільсона, бульбашкова камера.
Для виникнення конденсації необхідна наявність центрів конденсації, які захоплюють підлітаючі до них молекули. Центрами конденсації можуть бути порошинки, краплі рідини, заряджені частинки (іони). Є два режими конденсації: поверхнева, капельна. Конденсація може відбуватися всередині об’єму пари. Для початку такої конденсації пара повинна бути пересичена.
На цьому принципі побудована камера Вільсона. Вона представляє собою ємність, розділену на дві об’єднані між собою поршнем. Об’єм поршнем наповнений газом, що містить насичені пари довільної рідини. Якщо швидко опустити поршень, то суміш адіабатично розшириться і охолодиться. Пара при цьому стане пересиченою, але конденсуватися не буде, тому що забезпечується відсутність центрів конденсації в камері. Але якщо в момент розширення камери крізь неї пролетить швидка частинка, що здатна іонізувати атоми, то на її шляху з’явиться намисто іонів. На цих іонах, як на центрах, почнеться конденсація парів і утворення крапель туману. Таким чином досліджуються частинки космічних променів і ядерні частинки. Бульбашкова камера така ж, тільки суміш – перегріта рідина, спостерігається кипіння.
84. Фазові переходи II роду. Співвідношення Ернста
Ф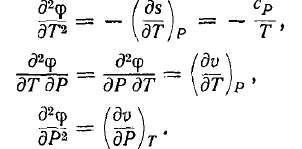 азовими
перетвореннями II
роду назваються такі перетворення,
при яких перші похідні від функції
термодинамічного потенціалу залишаються
неперервними, а другі похідні змінюються
скачкоподібно. Це значить що ФП II
роду не супроводжуються виділенням
або поглинанням тепла а також зміною
питомого об’єму речовини. З розривності
других слідує, що при ФП II
роду скачко подібно змінюється одна
з величин (див. формули):
азовими
перетвореннями II
роду назваються такі перетворення,
при яких перші похідні від функції
термодинамічного потенціалу залишаються
неперервними, а другі похідні змінюються
скачкоподібно. Це значить що ФП II
роду не супроводжуються виділенням
або поглинанням тепла а також зміною
питомого об’єму речовини. З розривності
других слідує, що при ФП II
роду скачко подібно змінюється одна
з величин (див. формули):
- питома теплоємність ср;
- коефіцієнт теплового
розширення
 ;
;
- ізотермічний
коефіцієнт стиснення
 ;
;
Співвідношення Ернста - наслідок неперервності питомої ентропії S і питомого об’єму V.
Воно має вид:
 ,
тут
,
тут
 означають
стрибки при фазових перетвореннях.
означають
стрибки при фазових перетвореннях.
85. Рідкі розчини. Закон Генрі. Закон Рауля. Наслідки з них.
Розчином називають фізично однорідні (гомогенні) суміші двох або більше речовин. Однорідність досягається рівномірним перемішуванням молекул. Якщо однієї з речовин у суміші більше, вона називається розчинником, а інші речовини суміші-розчиненими речовинами.
З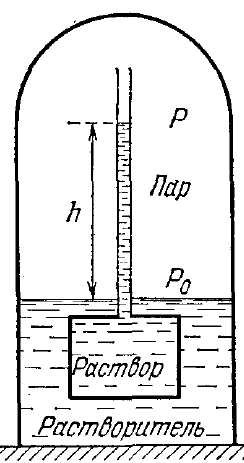 акон
Рауля
акон
Рауля
Нехай розчин поміщено в осмометр і вся система знаходиться під ковпаком.
Р0, Р-тиск насиченої пари над поверхнею рідини в ковпаку і в трубці.
Очевидно що
Р0-Р= .
.
Таким чином маємо:
 ,
де
,
де
 -
кількість молекул пари, n-розчинника
в одиниці об’єму. Врахувавши,
що
-
кількість молекул пари, n-розчинника
в одиниці об’єму. Врахувавши,
що
 n′kT
(закон Вант-Гоффа, n′-
кількість молекул розчиненої речовини
в одиниці обєму),
n′kT
(закон Вант-Гоффа, n′-
кількість молекул розчиненої речовини
в одиниці обєму),
 маємо:
маємо:
В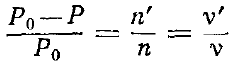 ідносне
пониження тиску насиченої пари розчинника
над поверхнею слабкого розчину нелеткої
речовини рівне віднощенню числа молей
розчиненої речовини до числа молей
розчинника.
ідносне
пониження тиску насиченої пари розчинника
над поверхнею слабкого розчину нелеткої
речовини рівне віднощенню числа молей
розчиненої речовини до числа молей
розчинника.
Закон Генрі
Був виведений експериментально. Формулювання: при незмінній температурі розчинність газу прямопропорційна його парціальному тиску над поверхнею розчину.
86. Осмос. Осмотичний тиск. Закон Вант-Гоффа. Вплив дисоціації під час розчинення на осмотичний тиск.
Нехай розчин знаходиться у деякій посудині, відділений від чистого розчинника полупроникною перегородкою, крізь яку можуть проходити молекули розчинника, але не проходять молекули розчиненої речовини. Крізь таку перегородку молекули чистого розчинника переходитимуть в область зайняту розчином. Це явище називається осмосом. В результаті осмосу виникає різниця тисків між розчином і чистим розчинником. Коли вона досягає певного значення, осмос припиняється. Різниця тисків, при якій осмос припиняється називається осмотичним тиском.
Закон Вант-Гоффа: якщо розчин слабий, то кількість ударів молекул розчиненої речовини об стінку буде такою ж, як і для ідеального газу. Таким чином для осмотичного тиску
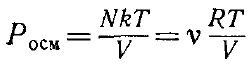 Тут
N, v
– числа молекул і молей розчиненї
речовини в об’ємі V.
Тут
N, v
– числа молекул і молей розчиненї
речовини в об’ємі V.
В розчинах електролітів може відбуватись дисоціація (розпад на йони) молекул, через що осмотичний тиск стає більшим, ніж розрахований по формулі. Проте, якщо під N розуміти загальну кількість часток в розчині, формула знову стає вірною.
..
…
…
…
