
- •58. Теорема Нернста. Формулювання третього начала термодинаміки. Наслідки із третього начала термодинаміки.
- •59.Метод термодинамічних потенціалів. Внутрішня енергія як термодинамічний потенціал. Співвідношення Максвела.
- •60.Метод термодинамічних потенціалів. Вільна енергія як термодинамічний потенціал. Співвідношення Максвела і рівняння Гіббса-Гельмгольца.
- •61.Метод термодинамічних потенціалів. Ентальпія як термодинамічний потенціал. Співвідношення Максвела і рівняння Гіббса-Гельмгольца.
- •62. Метод термодинамічних потенціалів. Термодинамічний потенціал Гібса. Співвідношення Максвелла і рівняння Гібса-Гельмгольца.
- •63. Рівняння Ван-дер-Вальса. Їзотерми Ван-дер-Вальса. Взаємні перетворення пари та рідини.
- •64.Критичний стан. Критичні параметри. Методи визначення критичних параметрів. Зведене рівняння Ван-дер-Вальса.
- •65. Внутрішня енергія газу Ван – дер – Ваальса.
- •66. Ефект Джоуля-Томсона.
- •67.Зрідження газів і методи одержання низьких температур(Джоуля-Томпсона, адіабатного розширення, адіабатного розмагнічення). Машини Клода і Лінде.
- •68. Рідини, дифузія, в’язкість.
- •69.Явище поверхневого натягу
- •70. Крайові кути.Змочування.Умови рівноваги на межі трьох рідин та на межі рідини з іншим середовищем.
- •71.Кривизна поверхні і додатковий тиск . Формула Лапласа . Капілярні явища
- •72.Капілярно-гравітаційні хвилі. (Доведення)
- •73.Кристалічний та аморфний стан речовини.
- •74. Просторові кристалічні гратки. Сингонії. Гратки Браве.
- •75. Атомні площини. Індекси Міллера.
- •76 . Поверхнева енергія і зовнішня форма кристала . Закон Кюрі та Вульфа .
- •77. Класифікація кристалів за типами зв’язку в кристалічній гратці.
- •78. Дефекти кристалічної гратки. Дефекти за Шотткі і за Френкелем. Температурна залежність концентрації.
- •79.Теплоємність твердих тіл. Закони Дюлонга і Пті та Джоуля і Каппа. Недоліки класичної теорії теплоємності твердих тіл.
- •80. Квантова теорія теплоємності твердих тіл Планка-Енштейна.
- •81. Квантова теорія теплоємності твердих тіл Дебая-Борна . Температура Дебая.
- •83. Кипіння та конденсація на ядрах.. Камера Вільсона, бульбашкова камера.
- •84. Фазові переходи II роду. Співвідношення Ернста
- •85. Рідкі розчини. Закон Генрі. Закон Рауля. Наслідки з них.
- •86. Осмос. Осмотичний тиск. Закон Вант-Гоффа. Вплив дисоціації під час розчинення на осмотичний тиск.
74. Просторові кристалічні гратки. Сингонії. Гратки Браве.
Напрямок, що не повторюється у кристалі, називається особливим. В залежності від кількості таких напрямків кристали поділяються на 3 категорії, які складаються з систем з однаковою точковою групою симетрії просторових граток - сингоній:
Вища категорія, напрямки відсутні. Відноситься лише одна сингонія-кубічна.
Середня категорія, єдиний особливий напрямок.Тетрагональна, тригональна і гексагональна сингонії.
Нижча категорія, декілька напрямків. Відносяться ромбічна, моноклінна,триклинна сингонії.
Трансляційна симетрія – властивість гратки суміщатися з собою після переміщення на основні вектори трансляції. Лише 14 точкових трьохвимірних структур можуть мати трансляційну симетрію. Ці просторові гратки називають гратками Браве.
75. Атомні площини. Індекси Міллера.
Атомною площиною кристалу називається площина, що проходить принаймні через три його атоми. Атомна площина ідеального кристалу містить нескінченне число атомів.
Д еяка
площина проходить через 3 атоми кристали
на осях системи координат, відтинає
відрізки
еяка
площина проходить через 3 атоми кристали
на осях системи координат, відтинає
відрізки
 - цілі числа.
Рівняння площини:
- цілі числа.
Рівняння площини:

Складемо величини обернених відношень відтятих відрізків і виразимо його через найменші цілі числа:

Величини ( називають кристалографічними
або індексами Міллера.
називають кристалографічними
або індексами Міллера.
76 . Поверхнева енергія і зовнішня форма кристала . Закон Кюрі та Вульфа .
Кристали можуть мати
рівноважну і нерівноважну форму . Кристал
рівноважної форми – той , що не змінює
свою форму у власному розплаві , при
температурі плавлення що відповідає
сталому тискові , або при заданих
температурі і тискові у насиченому
розчині . Згідно з принципом Кюрі та
Вульфа , кристал рівноважної форми
повинен при заданому об’ємі
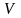 мати мінімальну поверхневу енергію.
мати мінімальну поверхневу енергію.
Поверхнева енергія – це надлишок енергії поверхневого шару на межі розділу фаз, зумовлений різницею між молекулярної взаємодії в обох фазах. Робота, що витрачається на створення одиниці площі поверхні розділу фаз у оборотному езотермічному процесі визначає питому вільну поверхневу енергію, яка визначається рівнянням Гіббса-Гельмгольца.

 -
коефіцієнт поверхневого натягу
-
коефіцієнт поверхневого натягу
Закон Кюрі-Вульфа

Якщо поверхневий натяг на одній із граней набагато більший, ніж на іншій, то вона буде швидше рости , отже відстані до грані зростуть з принципом Кюрі-Вульфа, . Кінець- кінцем гран із більшим натягом заросте.
77. Класифікація кристалів за типами зв’язку в кристалічній гратці.
Іонний зв'язок досить сильний. Він становить величину порядку 105 Дж/моль. Міцність іонного зв'язку проявляється в тому, що іонні кристали мають малий коефіцієнт теплового розширення і високу температуру плавлення. Електропровідність іонних кристалів при кімнатних температурах дуже незначна. Вона на 20 порядків нижча, ніж металів, і зростає з підвищенням температури. Для іонних кристалів характерним є сильне поглинання в інфрачервоній області спектра. Типовими кристалами з ковалентним зв'язком є алмаз, графіт, карборунд, сульфід цинку, йод, сірка. До них належать і напівпровідники. У вузлах кристалічної решітки таких кристалів розміщені нейтральні атоми.
Основу ковалентного зв'язку становить обмінний ефект, зумовлений обміном електронами між атомами. Ковалентний зв'язок між двома атомами може здійснюватись однією парою електронів (одинарний зв'язок); двома парами (подвійний зв'язок); трьома парами електронів (потрійний зв'язок). Ковалентний зв'язок досить сильний. Тому ковалентні кристали мають велику енергію зв'язку порядку 3—5 еВ на один атом. Завдяки цьому кристали з ковалентними зв'язками мають високу механічну міцність і твердість, високу температуру плавлення, винятково малу леткість, погану електропровідність в широкому інтервалі температур.
Металічний зв'язок в основному характерний для речовин, побудованих з атомів одного елемента (наприклад, мідь, золото). Металічні кристали містять у вузлах кристалічної решітки позитивні іони. Металічний зв'язок здійснюється не через електронні пари, які сумісно належать двом частинкам, а за допомогою вільних валентних електронів, що належать всьому кристалу в цілому. Енергія металічного зв'язку значно менша, ніж у ковалентних і іонних кристалів. Підтвердженням цього є більш низька температура плавлення металів, ніж іонних і ковалентних кристалів. Висока концентрація вільних електронів у металів зумовлює їхню добру електро - та теплопровідність. Метали оптично непрозорі, мають велику відбивну здатність, тому для них характерний специфічний металічний блиск.
У вузлах кристалічних решіток молекулярних кристалів розміщаються певним способом орієнтовані молекули. Характерною для молекулярних кристалів є геометрична відокремленість молекул кристала і сильні внутрішньомолекулярні зв'язки. Це означає, що енергія внут-рішньомолекулярних зв'язків значно перевищує енергію міжмолекулярних зв'язків. Силами зв'язку в цьому разі є сили Ван-дер-Ваальса та водневі зв'язки, коли молекули мають гідроксильні ОН та амінні NH2 групи. Переважна більшість молекулярних кристалів — це органічні кристали. Молекулярні неорганічні кристали трапляються рідко. До них належать речовини, молекули яких складаються з азоту, фосфору, сірки та ін. Молекулярні кристали за фізичними властивостями є ізоляторами, мають низьку температуру плавлення, прозорі для широкого інтервалу електромагнітних хвиль.
Зауважимо, що практично немає речовин, які б характеризувались тільки одним типом зв'язків. Здебільшого кристалічним решіткам речовин властива одночасна дія різних типів зв'язку.
