
- •58. Теорема Нернста. Формулювання третього начала термодинаміки. Наслідки із третього начала термодинаміки.
- •59.Метод термодинамічних потенціалів. Внутрішня енергія як термодинамічний потенціал. Співвідношення Максвела.
- •60.Метод термодинамічних потенціалів. Вільна енергія як термодинамічний потенціал. Співвідношення Максвела і рівняння Гіббса-Гельмгольца.
- •61.Метод термодинамічних потенціалів. Ентальпія як термодинамічний потенціал. Співвідношення Максвела і рівняння Гіббса-Гельмгольца.
- •62. Метод термодинамічних потенціалів. Термодинамічний потенціал Гібса. Співвідношення Максвелла і рівняння Гібса-Гельмгольца.
- •63. Рівняння Ван-дер-Вальса. Їзотерми Ван-дер-Вальса. Взаємні перетворення пари та рідини.
- •64.Критичний стан. Критичні параметри. Методи визначення критичних параметрів. Зведене рівняння Ван-дер-Вальса.
- •65. Внутрішня енергія газу Ван – дер – Ваальса.
- •66. Ефект Джоуля-Томсона.
- •67.Зрідження газів і методи одержання низьких температур(Джоуля-Томпсона, адіабатного розширення, адіабатного розмагнічення). Машини Клода і Лінде.
- •68. Рідини, дифузія, в’язкість.
- •69.Явище поверхневого натягу
- •70. Крайові кути.Змочування.Умови рівноваги на межі трьох рідин та на межі рідини з іншим середовищем.
- •71.Кривизна поверхні і додатковий тиск . Формула Лапласа . Капілярні явища
- •72.Капілярно-гравітаційні хвилі. (Доведення)
- •73.Кристалічний та аморфний стан речовини.
- •74. Просторові кристалічні гратки. Сингонії. Гратки Браве.
- •75. Атомні площини. Індекси Міллера.
- •76 . Поверхнева енергія і зовнішня форма кристала . Закон Кюрі та Вульфа .
- •77. Класифікація кристалів за типами зв’язку в кристалічній гратці.
- •78. Дефекти кристалічної гратки. Дефекти за Шотткі і за Френкелем. Температурна залежність концентрації.
- •79.Теплоємність твердих тіл. Закони Дюлонга і Пті та Джоуля і Каппа. Недоліки класичної теорії теплоємності твердих тіл.
- •80. Квантова теорія теплоємності твердих тіл Планка-Енштейна.
- •81. Квантова теорія теплоємності твердих тіл Дебая-Борна . Температура Дебая.
- •83. Кипіння та конденсація на ядрах.. Камера Вільсона, бульбашкова камера.
- •84. Фазові переходи II роду. Співвідношення Ернста
- •85. Рідкі розчини. Закон Генрі. Закон Рауля. Наслідки з них.
- •86. Осмос. Осмотичний тиск. Закон Вант-Гоффа. Вплив дисоціації під час розчинення на осмотичний тиск.
67.Зрідження газів і методи одержання низьких температур(Джоуля-Томпсона, адіабатного розширення, адіабатного розмагнічення). Машини Клода і Лінде.
В техніці для зрідження газів використовуються такі основні методи: 1)випаровування рідини(так працюють домашні холодильники), метод заснований на ефекті пониження тем-ри при випаровуванні; 2)Адіабатичне розмагнічення - деякі речовини (парамагнетики) мають здатність зберігати свій магнітний момент. При намагнічуванні у таких речовин потенційна енергія взаємодії зменшується. Охолодимо деякий намагнічений парамагнетик і адіабатично розмагнітимо його. При повільному розмагнічуванні ентропія системи незмінна(процес оборотний), з іншого боку внаслідок зростання ентропії, пов’язаної з розмагніченням спадає ентропія теплового руху (іде ще більше охолодження).
3)використання ефекту Джоуля-Томпсона- ідея методу полягає в тому, що газ пропускають через деяку пористу перегородку (дроселювання), підтримуючи сталу різницю тисків. Ефект має місце лише для реальних газів. При цьому в залежності від початкової тем-ри (тем-ри інверсії) газ може як нагріватися так і охолоджуватися. 4)адіабатне розширення газу з виконанням зовнішньої роботи-ідея цього методу слідує з рівняння адіабати. Метод адіабатного розширення є більш ефективним, оскільки він придатний і для реальних газів. Це пояснюється тим, що у випадку ідеальних газів робота виконується за рахунок внутрішньої енергії, а вона є монотонно зростаючою функцією самої лише тем-ри. Якщо енергії для виконання роботи не вистачає, роботу можна виконувати над тілом (наприклад розширяти поршень мотором), охолодження все одно відбуватиметься.
Машина Клода - використовує адіабатичне розширення і є більш ефективною
П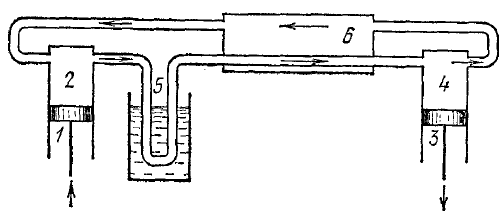 оршнем
1 газ подають в установку, перетікаючи
з циліндра 2 по трубкам 5, газ охолоджується
за допомогою води (або іншого холодильника),
і потрапляє в теплообмінник, де він
охолоджується завдяки теплообміну з
більш холодним газом. Потім газ потрапляє
в детандер 4, де зазнає адіабатичного
розширення і ще більш охолоджується.
Далі газ потрапляє до поршня 2 через
теплообмінник 6 і цикл повторюється,
поки не настане зрідження.
оршнем
1 газ подають в установку, перетікаючи
з циліндра 2 по трубкам 5, газ охолоджується
за допомогою води (або іншого холодильника),
і потрапляє в теплообмінник, де він
охолоджується завдяки теплообміну з
більш холодним газом. Потім газ потрапляє
в детандер 4, де зазнає адіабатичного
розширення і ще більш охолоджується.
Далі газ потрапляє до поршня 2 через
теплообмінник 6 і цикл повторюється,
поки не настане зрідження.
М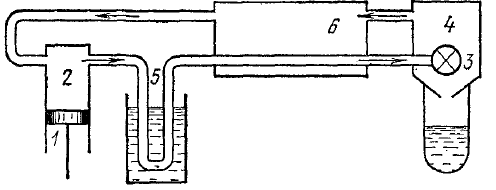 ашина
Лінде - повністю аналогічна машині
Клода, але замість детандера в ній
стоїть вентиль, завдяки чому відбувається
дроселювання.
ашина
Лінде - повністю аналогічна машині
Клода, але замість детандера в ній
стоїть вентиль, завдяки чому відбувається
дроселювання.
68. Рідини, дифузія, в’язкість.
О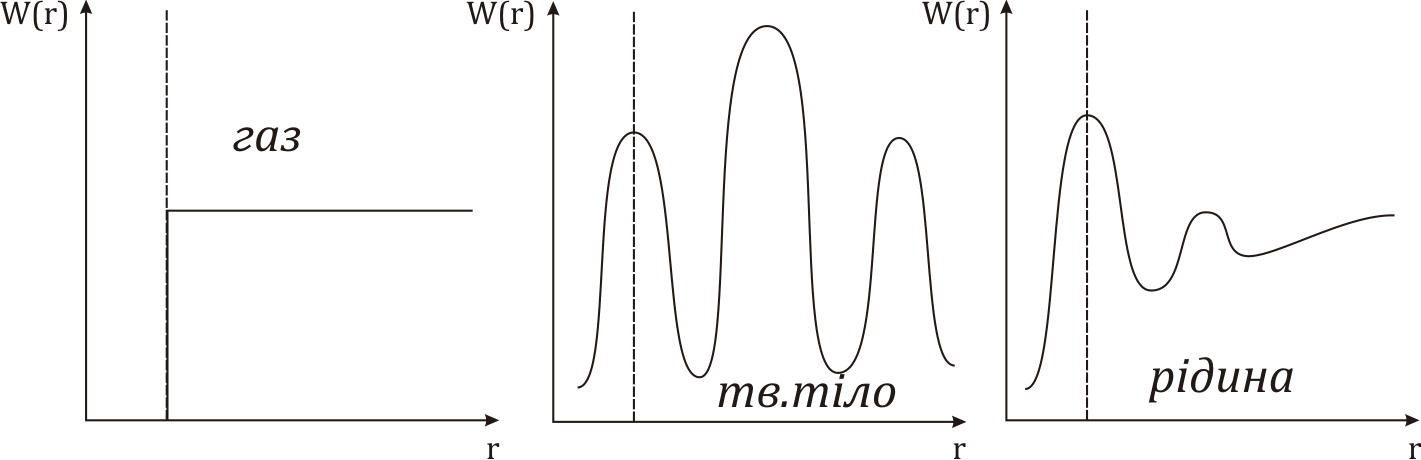 собливості
рідкого стану, модель рідини.
собливості
рідкого стану, модель рідини.

q – висота потенціального бар’єру
Тепловий рух у рідинах.
τ – час осідлого життя молекул, час знаходження мол. в потенціальній ямі.


j – кількість стрибків; а– const; ν – частота коливань молекул в ямі
1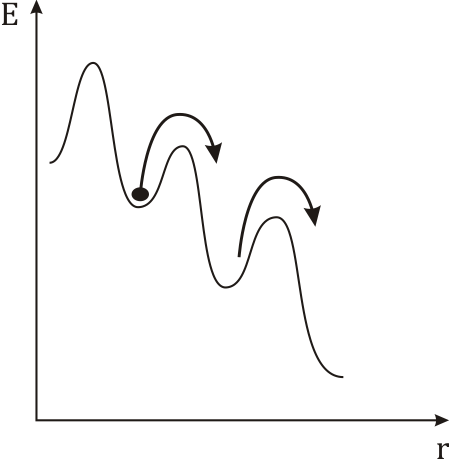 еВ = 1,6 * 10-19 Дж
еВ = 1,6 * 10-19 Дж






Явища переносу у рідинах
d N
– кількість молекул, що проходить
за одиницю часу через площадку dS
N
– кількість молекул, що проходить
за одиницю часу через площадку dS


…(далі зі шпор…)
В розташуванні частинок рідини спостерігається ближній порядок. Тобто, по відношенню до будь-якої частинки розташування найближчих до неї сусідів є впорядкованим. Через це структуру рідин називають квазікристалічною. Теорія рідин менш розвинута ніж теорія будови газу чи кристалу через проміжний? стан рідин. Найбільший вклад в розбудову теорії рідин зробив Френкель. Згідно з Френкелем, тепловий рух в рідинах має наступний характер. Кожна молекула на протязі деякого часу коливається коло визначеного положення рівноваги. Час від часу молекула змінює місце рівноваги, стрибком переміщуючись в нове положення, що знаходиться на відстані порядку розмірів молекули від попереднього. Таким чином, молекули лише повільно переміщуються всередині рідини, перебуваючи частину часу біля визначених місць. Довжина часу стоянки молекули є досить різними і хаотично чергуються, але середня величина коливань навколо одного й того самого положення рівноваги є у кожної рідини певної величини, що різко зменшується з підвищенням температури. В зв’язку з цим при підвищенні температури сильно збільшується рухомість молекул, що в свою чергу призводить до зменшення в’язкості рідин.
В’язкість рідин
виникає при русі рідини через перенос
імпульсу в напрямі, перпендикулярному
до напряму руху. Перенос імпульсу
здійснюється при стрибках молекул, про
які вже говорилось вище. Загальний закон
внутрішнього тертя:
 .
Рідина буде тим більш текучою (з меншою
в’язкістю), чим менший час t
стоянки молекул і
чим частіше відбуваються стрибки. Ці
міркування призводять до рівняння
Френзеля-Андраде для коефіцієнту
в’язкості:
.
Рідина буде тим більш текучою (з меншою
в’язкістю), чим менший час t
стоянки молекул і
чим частіше відбуваються стрибки. Ці
міркування призводять до рівняння
Френзеля-Андраде для коефіцієнту
в’язкості:
 .
Множник С, що входить у це рівняння,
залежить від відстані стрибка ,
частоти коливань v і
температури. Однако, температурний хід
в’язкості визначається множником
.
Множник С, що входить у це рівняння,
залежить від відстані стрибка ,
частоти коливань v і
температури. Однако, температурний хід
в’язкості визначається множником
 .
з
температури в’язкість швидко .
Так, в’язкість води при зміні температури
від 0С до 100С
зменшується від 1,8х10-3 до 2,8х10-4
кг/мс. Вимірюється
цей коефіцієнт за допомогою віскозіметра.
.
з
температури в’язкість швидко .
Так, в’язкість води при зміні температури
від 0С до 100С
зменшується від 1,8х10-3 до 2,8х10-4
кг/мс. Вимірюється
цей коефіцієнт за допомогою віскозіметра.
Частіше вони побудовані
на принципі спостереження стоку рідини
через капіляри, швидкість якого залежить
від в’язкості по закону Пуазейля:
 . Тут: V – об’єм рідини,
що протікає в одиницю часу через капіляр
радіусом r під дією
різниці тисків р
при довжині капіляру l.
. Тут: V – об’єм рідини,
що протікає в одиницю часу через капіляр
радіусом r під дією
різниці тисків р
при довжині капіляру l.
В рідині є істинним
закон Фіка (загальне рівняння явищ
переносу):
 .
Коеф. дифузії можна отримати з наступних
міркувань: якщо час між стрибками молекул
позначити через t, то
величина /t
є швидкість молекули. Це дозволяє
порівняти
.
Коеф. дифузії можна отримати з наступних
міркувань: якщо час між стрибками молекул
позначити через t, то
величина /t
є швидкість молекули. Це дозволяє
порівняти
 з
середньою довжиною вільного пробігу,
а
з
середньою довжиною вільного пробігу,
а
 -
з середньою швидкістю молекул.
Коеф. самодифузії рідини:
-
з середньою швидкістю молекул.
Коеф. самодифузії рідини:
 .
Множник 1/6 є тому, що рух носить хаотичний
характер, тому можливі 6 напрямів руху
молекули. Кількість молекул в одному
напрямі є (1/6)n0.
В формулу входить середнє значення
квадрату, а не квадрат середнього
значення (див. початок 2-го семестру з
фізики). Коеф. D залежить
від Т тому, що з
Т - час “спокійного”
життя молекули, що призводить до
D. Час перебування
молекули в даному місці рідини визначається
ймовірністю для молекули отр. енергію
, необхідну для
стрибка. Ця ймовірність визн. законом
Больцмана:
.
Множник 1/6 є тому, що рух носить хаотичний
характер, тому можливі 6 напрямів руху
молекули. Кількість молекул в одному
напрямі є (1/6)n0.
В формулу входить середнє значення
квадрату, а не квадрат середнього
значення (див. початок 2-го семестру з
фізики). Коеф. D залежить
від Т тому, що з
Т - час “спокійного”
життя молекули, що призводить до
D. Час перебування
молекули в даному місці рідини визначається
ймовірністю для молекули отр. енергію
, необхідну для
стрибка. Ця ймовірність визн. законом
Больцмана:
 . Тут п – число молекул в об’ємі,
енергія яких ,
а п0 – число молекул, що
мають середню теплову енергію, або kT.
. Тут п – число молекул в об’ємі,
енергія яких ,
а п0 – число молекул, що
мають середню теплову енергію, або kT.
 .
Множник А має сенс періода коливань
молекули (А=1/v).
Підставивши в формулу для коеф. дифузії,
отр.:
.
Множник А має сенс періода коливань
молекули (А=1/v).
Підставивши в формулу для коеф. дифузії,
отр.:
 .
Тут
.
Тут
 ,
а - енергія, що
необхідна для стрибка молекули, що наз.
енергією активації молекули. Числове
значення коеф. дифузії у рідин << ніж
у газів.
,
а - енергія, що
необхідна для стрибка молекули, що наз.
енергією активації молекули. Числове
значення коеф. дифузії у рідин << ніж
у газів.
