
- •58. Теорема Нернста. Формулювання третього начала термодинаміки. Наслідки із третього начала термодинаміки.
- •59.Метод термодинамічних потенціалів. Внутрішня енергія як термодинамічний потенціал. Співвідношення Максвела.
- •60.Метод термодинамічних потенціалів. Вільна енергія як термодинамічний потенціал. Співвідношення Максвела і рівняння Гіббса-Гельмгольца.
- •61.Метод термодинамічних потенціалів. Ентальпія як термодинамічний потенціал. Співвідношення Максвела і рівняння Гіббса-Гельмгольца.
- •62. Метод термодинамічних потенціалів. Термодинамічний потенціал Гібса. Співвідношення Максвелла і рівняння Гібса-Гельмгольца.
- •63. Рівняння Ван-дер-Вальса. Їзотерми Ван-дер-Вальса. Взаємні перетворення пари та рідини.
- •64.Критичний стан. Критичні параметри. Методи визначення критичних параметрів. Зведене рівняння Ван-дер-Вальса.
- •65. Внутрішня енергія газу Ван – дер – Ваальса.
- •66. Ефект Джоуля-Томсона.
- •67.Зрідження газів і методи одержання низьких температур(Джоуля-Томпсона, адіабатного розширення, адіабатного розмагнічення). Машини Клода і Лінде.
- •68. Рідини, дифузія, в’язкість.
- •69.Явище поверхневого натягу
- •70. Крайові кути.Змочування.Умови рівноваги на межі трьох рідин та на межі рідини з іншим середовищем.
- •71.Кривизна поверхні і додатковий тиск . Формула Лапласа . Капілярні явища
- •72.Капілярно-гравітаційні хвилі. (Доведення)
- •73.Кристалічний та аморфний стан речовини.
- •74. Просторові кристалічні гратки. Сингонії. Гратки Браве.
- •75. Атомні площини. Індекси Міллера.
- •76 . Поверхнева енергія і зовнішня форма кристала . Закон Кюрі та Вульфа .
- •77. Класифікація кристалів за типами зв’язку в кристалічній гратці.
- •78. Дефекти кристалічної гратки. Дефекти за Шотткі і за Френкелем. Температурна залежність концентрації.
- •79.Теплоємність твердих тіл. Закони Дюлонга і Пті та Джоуля і Каппа. Недоліки класичної теорії теплоємності твердих тіл.
- •80. Квантова теорія теплоємності твердих тіл Планка-Енштейна.
- •81. Квантова теорія теплоємності твердих тіл Дебая-Борна . Температура Дебая.
- •83. Кипіння та конденсація на ядрах.. Камера Вільсона, бульбашкова камера.
- •84. Фазові переходи II роду. Співвідношення Ернста
- •85. Рідкі розчини. Закон Генрі. Закон Рауля. Наслідки з них.
- •86. Осмос. Осмотичний тиск. Закон Вант-Гоффа. Вплив дисоціації під час розчинення на осмотичний тиск.
65. Внутрішня енергія газу Ван – дер – Ваальса.
Ця енергія складається із внутрішньої енергії, які складають газ, і кінетичної енергії руху ценру мас молекул (СvT), і із потенціальної енергіївзаємного притягування молекул , яка має відємне значення. Потенціальна енергія протягування рівна роботі , яку необхідно затратити проти сил протягування для того, щоб розвести молекули на нескінчену відстань одної від одної, коли взаємодію між ними можна вважати відсутню, а потенціальну енергію взаємодії – рівну нулю. Тиск за рахунок притягання між молекуламив рівняні Ван-дер-Ваальса рівне а/V2, і звідси потенціальна енергія:
Еп
=

Внутрішня енергія газу Ван-дер Ваальса :
dU = CVdT + [T(dp/dT)v-p]dV
Із рівнянь Ван-дер-Ваальса:
p = RT/(V-b) – a/V2
T(dp/dT)v = RT/(V - b) = p + a/V2
dU = Cv dT + (a*dV)/V2
Вважаючи що U=0 при Т=0 і V=∞, отримаємо:
U = CVT-a/V, де СV не залежить від Т.
66. Ефект Джоуля-Томсона.
(62. Ефект Джоуля-Томпсона для газу Ван-дер-Ваальса. Температура інверсії. Пояснення єфекту; 63. Досліди Гей-Люссака, Джоуля і Томпсона по визначенню залежностей внутрішньої енергії газу від об”єму. Використання методу циклів для вирішення цієї задачі)
Еф.Д-Т полягає в зміні
температури реального газу при його
адіабатному дроселюванні (повільному
протіканні газу крізь перешкоду, напр..
пористий корок) - розширенні без виконання
роботи. При такому розширенні енергія
газу залишається незмінною, а відбувається
взаємний перехід між кінетичною і
потенціальною її складовими. Якщо перед
розширенням у газі переважало притягання
молекул (потенціальна енергія при цьому
була від‘ємною), то при значних розширеннях
вона зростатиме за рахунок кінетичної
енергії молекул і газ охолоджуватиметься
(додатний еф.Д-Т). Якщо ж перед розширенням
домінувало відштовхування молекул
(потенціальна енергія додатна), то при
розширенні вона зменшиться , а кінетична
збільшиться і газ нагріється (від‘ємний
еф.Д-Т). Той самий газ, залежно від тиску
і температури, може виявити як додатний,
так і від‘ємний еф.Д-Т. Той стан газу,
при якому його розширення не веде до
зміни температури (еф.Д-Т відсутній)
наз. точкою інверсії, а температура, за
якої Еф.Д-Т був відкритий у 1853 р. ,
застосовується при зрідженні газів.
Щоб при черговому розширенні газ
охолоджувався, його треба охолодити
нижче від точки інверсії. ,
де
,
де
 -
температура охолодження газу,
-
температура охолодження газу,
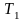 -початкова
температура,
-початкова
температура,
 -
об‘єм газу до розширення,
-
об‘єм газу до розширення,
 -
сталі в рівнянні Ван-дер-Ваальса. При
інверсії
-
сталі в рівнянні Ван-дер-Ваальса. При
інверсії
 ,
отже температура інверсії знаходиться
з рівняння:
,
отже температура інверсії знаходиться
з рівняння:

Пояснення ефекту Д-Т:
Для реального газу внутрішня енергія
складається з кінетичної енергії молекул
і потенціальної енергії їхньої взаємодії
між собою. Потенціальна енергія
знаходиться з рівняння Ван-дер-Ваальса
 наступним чином:
наступним чином:
 ,
отже для внутрішньої енергії реального
разу
,
отже для внутрішньої енергії реального
разу
 .
відсутнє еф.Д-Т наз. температурою
інверсії.Суть досліду полягає в тому,
що збільшення кінетичної енергії молекул
(отже і температури) відбувається за
рахунок зміни потенціальної енергії
взаємодії молекул. Внутрішня енергія
газу залишається незмінною, а енергія
перерозподіляється між першим і другим
доданками. Ідея досліду: у добре ізольовану
трубку поміщали пробку з вати. З одного
боку від цієї пробки був газ під тиском
.
відсутнє еф.Д-Т наз. температурою
інверсії.Суть досліду полягає в тому,
що збільшення кінетичної енергії молекул
(отже і температури) відбувається за
рахунок зміни потенціальної енергії
взаємодії молекул. Внутрішня енергія
газу залишається незмінною, а енергія
перерозподіляється між першим і другим
доданками. Ідея досліду: у добре ізольовану
трубку поміщали пробку з вати. З одного
боку від цієї пробки був газ під тиском
 ,
а з другого під тиском
,
а з другого під тиском
 .
Внаслідок різниці тисків газ протискувався
через корок, розширюючись адіабатно. З
обох боків пробки вимірювали температуру.
Для більшості газів температура при
цьому збільшувалась. “Протискування”
газу через пробку вимагає витрат роботи
.
Внаслідок різниці тисків газ протискувався
через корок, розширюючись адіабатно. З
обох боків пробки вимірювали температуру.
Для більшості газів температура при
цьому збільшувалась. “Протискування”
газу через пробку вимагає витрат роботи
 .
Пізніше під час розширення газ сам
виконує роботу
.
Пізніше під час розширення газ сам
виконує роботу
 ,
причому
,
причому
 . В лівій частині рівняння газ можна
вважати реальним, в правій частині –
можна газ прийняти за ідеальний
(спрощення). Для реального газу (ліва
частина) матиме:
. В лівій частині рівняння газ можна
вважати реальним, в правій частині –
можна газ прийняти за ідеальний
(спрощення). Для реального газу (ліва
частина) матиме: ,
а
,
а
 .
.
Прирівнюючи ці величини дістанемо рівняння з якого можна знайти


