
- •58. Теорема Нернста. Формулювання третього начала термодинаміки. Наслідки із третього начала термодинаміки.
- •59.Метод термодинамічних потенціалів. Внутрішня енергія як термодинамічний потенціал. Співвідношення Максвела.
- •60.Метод термодинамічних потенціалів. Вільна енергія як термодинамічний потенціал. Співвідношення Максвела і рівняння Гіббса-Гельмгольца.
- •61.Метод термодинамічних потенціалів. Ентальпія як термодинамічний потенціал. Співвідношення Максвела і рівняння Гіббса-Гельмгольца.
- •62. Метод термодинамічних потенціалів. Термодинамічний потенціал Гібса. Співвідношення Максвелла і рівняння Гібса-Гельмгольца.
- •63. Рівняння Ван-дер-Вальса. Їзотерми Ван-дер-Вальса. Взаємні перетворення пари та рідини.
- •64.Критичний стан. Критичні параметри. Методи визначення критичних параметрів. Зведене рівняння Ван-дер-Вальса.
- •65. Внутрішня енергія газу Ван – дер – Ваальса.
- •66. Ефект Джоуля-Томсона.
- •67.Зрідження газів і методи одержання низьких температур(Джоуля-Томпсона, адіабатного розширення, адіабатного розмагнічення). Машини Клода і Лінде.
- •68. Рідини, дифузія, в’язкість.
- •69.Явище поверхневого натягу
- •70. Крайові кути.Змочування.Умови рівноваги на межі трьох рідин та на межі рідини з іншим середовищем.
- •71.Кривизна поверхні і додатковий тиск . Формула Лапласа . Капілярні явища
- •72.Капілярно-гравітаційні хвилі. (Доведення)
- •73.Кристалічний та аморфний стан речовини.
- •74. Просторові кристалічні гратки. Сингонії. Гратки Браве.
- •75. Атомні площини. Індекси Міллера.
- •76 . Поверхнева енергія і зовнішня форма кристала . Закон Кюрі та Вульфа .
- •77. Класифікація кристалів за типами зв’язку в кристалічній гратці.
- •78. Дефекти кристалічної гратки. Дефекти за Шотткі і за Френкелем. Температурна залежність концентрації.
- •79.Теплоємність твердих тіл. Закони Дюлонга і Пті та Джоуля і Каппа. Недоліки класичної теорії теплоємності твердих тіл.
- •80. Квантова теорія теплоємності твердих тіл Планка-Енштейна.
- •81. Квантова теорія теплоємності твердих тіл Дебая-Борна . Температура Дебая.
- •83. Кипіння та конденсація на ядрах.. Камера Вільсона, бульбашкова камера.
- •84. Фазові переходи II роду. Співвідношення Ернста
- •85. Рідкі розчини. Закон Генрі. Закон Рауля. Наслідки з них.
- •86. Осмос. Осмотичний тиск. Закон Вант-Гоффа. Вплив дисоціації під час розчинення на осмотичний тиск.
63. Рівняння Ван-дер-Вальса. Їзотерми Ван-дер-Вальса. Взаємні перетворення пари та рідини.
Р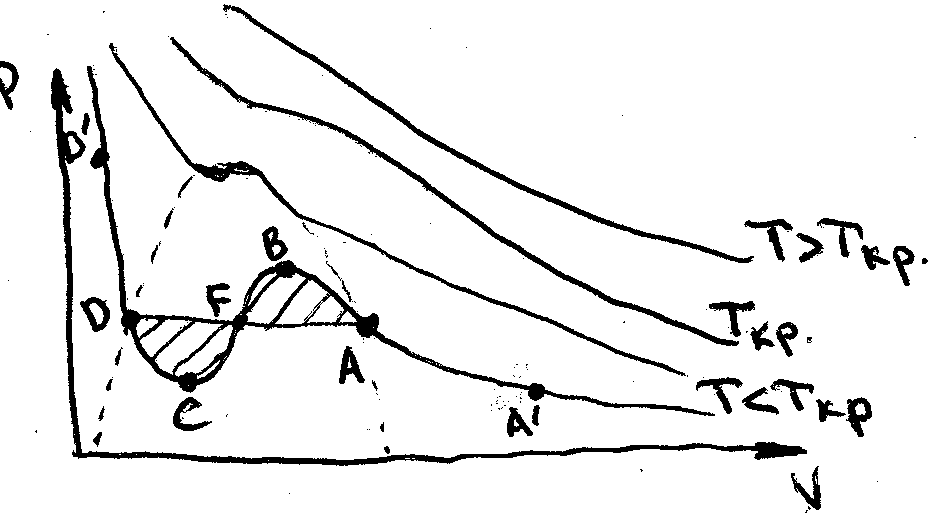 івняння
івняння
 називається рівнянням стану реального
газу, або рівнянням Ван-дер-Ваальса.
Поправки a і b називаються сталими
Ван-дер-Ваальса і залежать від природи
газу. Це рівняння описує стан одного
моля реального газу. Якщо розглядати
довільну кількість газу масою
називається рівнянням стану реального
газу, або рівнянням Ван-дер-Ваальса.
Поправки a і b називаються сталими
Ван-дер-Ваальса і залежать від природи
газу. Це рівняння описує стан одного
моля реального газу. Якщо розглядати
довільну кількість газу масою
 ,
то рівняння можна переписати так:
,
то рівняння можна переписати так:
 .
Доданок в перших дужках враховує
взаємодію молекул газу, а в других –
розміри молекул. Порівнюючи рівняння
Ван-дер-Ваальса з рівнянням стану
ідеального газу (
.
Доданок в перших дужках враховує
взаємодію молекул газу, а в других –
розміри молекул. Порівнюючи рівняння
Ван-дер-Ваальса з рівнянням стану
ідеального газу ( ),
приходимо до висновку, що ізотерми
реального газу відрізняються від ізотерм
ідеального. Типові ізотерми Ван-дер-Ваальса
наведено на рис. Кожному значенню тиску
відповідає одне або три значення об‘єму
(в ідеальному газі тільки одне).
Оскільки
рівняння Ван-дер-Ваальса для реального
газу є многочленом 3 степення відносно
V, то для різних P при T=const буде 1 або 3
різні значення V. Експериментальні
ізотерми T>Tкр збігаються з теор. А при
T<Tкр є деякі відмінності. На CB тиск (P)
росте із ростом об’єму (V)
),
приходимо до висновку, що ізотерми
реального газу відрізняються від ізотерм
ідеального. Типові ізотерми Ван-дер-Ваальса
наведено на рис. Кожному значенню тиску
відповідає одне або три значення об‘єму
(в ідеальному газі тільки одне).
Оскільки
рівняння Ван-дер-Ваальса для реального
газу є многочленом 3 степення відносно
V, то для різних P при T=const буде 1 або 3
різні значення V. Експериментальні
ізотерми T>Tкр збігаються з теор. А при
T<Tкр є деякі відмінності. На CB тиск (P)
росте із ростом об’єму (V)
 Ясно,
що ні в одній точці система не може бути
в рівновазі. Тому CB існує не стійко. В
областях D’DC і BAA’
Ясно,
що ні в одній точці система не може бути
в рівновазі. Тому CB існує не стійко. В
областях D’DC і BAA’
 .
Тому ці стани стійкі. Отже, цікаво, як
може система перейти з однієї області
в іншу через нестійку область. Експеримент
показав,що на цьому етапі ізотерма в
натурі горизонтальна DA. Перейдемо з D в
A оборотньо двома шляхами – DFA і DCFBA.
.
Тому ці стани стійкі. Отже, цікаво, як
може система перейти з однієї області
в іншу через нестійку область. Експеримент
показав,що на цьому етапі ізотерма в
натурі горизонтальна DA. Перейдемо з D в
A оборотньо двома шляхами – DFA і DCFBA.
Тоді:
 ,
оск. T1=const ,
,
оск. T1=const ,
 Отже DFA повинна бути так розміщена, щоб
Отже DFA повинна бути так розміщена, щоб
 а отже відповідні площі під кривими DFA
і DCBA повинні бути однакові. Ясно, що A’A
і DD’ – газоподібний та рідкий стани.
На AB і CD відповідно – переохолоджена
пара та перегріта рідина. Ці стани
метастабільні, тобто нестійкі.
Переохолоджена пара – це стан речовини
коли по параметрам має бути рідина але
є газ (має властивості газу – заповнює
весь об’єм і т.д. ), а перегріта рідина
відповідно – коли по параметрам має
бути газ а є рідина (по властивостям).
а отже відповідні площі під кривими DFA
і DCBA повинні бути однакові. Ясно, що A’A
і DD’ – газоподібний та рідкий стани.
На AB і CD відповідно – переохолоджена
пара та перегріта рідина. Ці стани
метастабільні, тобто нестійкі.
Переохолоджена пара – це стан речовини
коли по параметрам має бути рідина але
є газ (має властивості газу – заповнює
весь об’єм і т.д. ), а перегріта рідина
відповідно – коли по параметрам має
бути газ а є рідина (по властивостям).
64.Критичний стан. Критичні параметри. Методи визначення критичних параметрів. Зведене рівняння Ван-дер-Вальса.
При певних параметрах
T,P існує
тільки одне рішення рівняння
Ван-дер-Ваальса. Така ізотерма наз.
критичною, при цьому зникає різниця
між газом і рідиною і цей стан речовини
наз. критичним станом. Оцінити
критичні параметри можна на підставі
рівняння В-дер-В. Перепишемо
його так: ,
У критичній точці
,
У критичній точці
 ,
, знайдемо це:
знайдемо це:
 ,
,
 , З цих двох рівнянь
знаходимо критичні параметри:
, З цих двох рівнянь
знаходимо критичні параметри:
 ,
,
 ,
,
 .
Щоб знайти сталі a, b для різних газів на
експерименті фіксуються критичні
параметри газів, бо теоретично отримати
значення цих сталих з рівняння В-дер-В
неможливо. Щоб перевірити правильність
рівняння В-дер-В знайдемо величину
.
Щоб знайти сталі a, b для різних газів на
експерименті фіксуються критичні
параметри газів, бо теоретично отримати
значення цих сталих з рівняння В-дер-В
неможливо. Щоб перевірити правильність
рівняння В-дер-В знайдемо величину
 .
Експеримент дає такі значення: водень
– 3,28; кисень – 3,42. Це розходження свідчить
про те, що рівняння В-дер-В, яке виведено
з припущення, що молекули – це тверді
кулі, є неточним.
.
Експеримент дає такі значення: водень
– 3,28; кисень – 3,42. Це розходження свідчить
про те, що рівняння В-дер-В, яке виведено
з припущення, що молекули – це тверді
кулі, є неточним.
Зведене рівняння.
Треба отримати рівняння стану незалежно
від природи газу, тобто універсальне.
Будь-які гази з однаковим(відповідним)
відношенням

 ,
,
 будуть
описуватися ідентичними рівняннями.
Параметри
будуть
описуватися ідентичними рівняннями.
Параметри
 називають
зведеними.
називають
зведеними. ,
,
 ,
,



У даному рівнянні немає констант для окремих газів. Воно називається зведеним рівнянням стану. З нього випливає, що якщо гази мають два однакові зведені параметри з трьох, то й третій параметр для них однаковий. Цей закон називається законом відповідних станів.
