
- •«Молекулярные основы биоэнергетических процессов и общие пути катаболизма в организме человека . Ферменты»
- •Мультиферментные комплексы
- •Факторы, влияющие на скорость ферментативных реакций
- •Способы регуляции активности ферментов
- •Ковалентная (химическая) модификация
- •Диагностика энзима в моче
- •1. Обратимое 2. НеобратимоеА. Конкурентное а. Специфическое б. Неконкурентное б. Неспецифическое
- •Наследственные энзимопатии по типу нарушений метаболизма делят на:
- •Стадии метаболизма
- •Обмен веществ.Метаболические пути. Унификация питательных веществ.
- •Роль в организме
- •Энергетический эффект цикла Кребса Итак, при распаде 1 моль ацетил-КоА образуется 12 моль атф, следовательно, из 2 моль ацетил-КоА - 24 моль атф.
- •Механизм : Окислительное фосфорилирование
- •Специфические и общие пути катаболизма
- •Окислительное декарбоксилирование пировиноградной кислоты (пвк)
- •Окислительное декарбоксилирование пировиноградной кислоты (пвк)
Механизм : Окислительное фосфорилирование
Окислительное фосфорилирование состоит из процессов окисления и фосфорилирования, которые между собой сопряжены.
Катаболизм органических веществ в тканях сопровождается потреблением кислорода и выделением СО2. Этот процесс называют тканевым дыханием. Кислород в этом процессе используется как акцептор водорода от окисляемых (дегидрируемых) веществ (субстратов), в результате чего синтезируется вода. Процесс окисления можно представить следующим уравнением: SH2 + 1/2 O2 → S+ H2O. Окисляемые различные органические вещества (S — субстраты), представляют собой метаболиты катаболизма, их дегидрирование является экзоэргическим процессом. Энергия, освобождающаяся в ходе реакций окисления, либо полностью рассеивается в виде тепла, либо частично тратится на фосфорилирование ADP с образованием АТР. Организм превращает около 40% энергии, выделяющейся при окислении, в энергию макроэргических связей АТР. Большинство организмов в биосфере использует этот способ или очень сходный с ним (в качестве терминального акцептора водорода может быть не кислород, а другое соединение) как основной источник энергии, необходимый для синтеза внутриклеточной АТР. Таким путем клетка превращает химическую энергию питательных веществ, поступивших извне, в утилизируемую метаболическую энергию. Реакция дегидрирования и способ превращения выделившейся энергии путем синтеза АТР — это энергетически сопряженные реакции. Целиком весь сопряженный процесс называется окислительным фосфорилированием ADP:
---- МЕХАНИЗМ ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ Для объяснения механизма сопряжения окисления и фосфорилирования были выдвинуты две принципиальные гипотезы. Химическая гипотезапостулирует прямое химическое сопряжение на всех стадиях процесса, как при образовании АТРв процессе гликолиза. Предполагается, что существует интер-медиат, богатый энергией (I ~ X), связывающий процессы окисления и фосфорилирования. Поскольку такое соединение до сих пор не было обнаружено, эта гипотеза в известной мере дискредитирована и в дальнейшем не будет рассматриваться (подробно об этом вопросе можно прочесть в обзоре: Harper, Rodwell and Mayes,- 1979). Хемиосмотическая теорияпостулирует, что при окислении компонентов дыхательной цепи генерируются ионы водорода, которые выходят на наружную сторону сопрягающей мито-хондриальной мембраны. Возникающая в результате асимметричного распределения ионов водорода (протонов, Н+) разность электрохимических потенциалов используется для приведения в действие механизма образования АТР. Были выдвинуты и другие гипотезы; согласно одной из них, энергия окисления запасается в форме изменения конформации молекул, а затем используется для генерирования богатых энергией фосфатных связей.
30.Общие принципы биологической термодинамики. Окислительное и субстратное фосфорилирование. Механизм сопряжения окислительного фосфорилирования и тканевого дыхания.
Термодинамика биологических систем.
Термодинамика– наука о превращениях энергии при её переносе в макроскопических системах.
Макроскопические системы (макросистемы)– материальные объекты, состоящие из большого числа частиц.
Биологические системы– макроскопические. Обмен энергией с окружающей средой – обязательное условие их существования.
Особенности термодинамического подхода:
-
Описание макросистем в целом (без учёта составляющих)
-
Ограниченность – с помощью термодинамики нельзя исследовать природу или механизм биологического явления.
-
Универсальность – приложимость к процессам самого разного рода от транспорта веществ через мембрану клетки до биологической эволюции.
Окислительное фосфорилирование происходит в митохондриях в процессе биологического окисления в дыхательной цепи. Энергия, высвобождающаяся в дыхательной цепи, аккумулируется в макроэргических соединениях АТФ. Энергия, освобождающаяся в процессе биологического окисления только частично рассеивается в виде тепла (около 40%), а большая часть накапливается в форме макроэргических молекул АТФ (около 60%). Молекула АТФ – это универсальный акцептор и донор химической энергии в клетках. Гидролиз каждой макроэргической связи АТФ сопровождается выделением 7,3 килокалорий энергии на 1 грамм-молекулу. В дыхательной цепи при переносе каждой пары электронов на 1 атом кислорода образуется 3 молекулы АТФ, то есть отношение фосфора к кислороду равно трем: P / О = 3. Синтез молекулы АТФ происходит в определенных участках дыхательной цепи. На каждом этапе синтеза АТФ аккумулируется 8 ккал на каждую грамм-молекулу образовавшейся АТФ.
Субстратное фосфорилирование участвует в анаэробном расщеплении глюкозы. За счет субстратного фосфорилирования 1 молекулы глюкозы синтезируется 6 молекул АТФ.
Процесс сопряжения тканевого дыхания и фосфорилирования получил название окислительного фосфорилирования. Впервые в начале 30-х годов В. А. Энгельгардт высказал соображение о наличии сопряжения между фосфорилированием АДФ и аэробным дыханием. Позже, в 1940 г., В. А. Белицер и Е. Т. Цыбакова показали, что синтез АТФ из АДФ и Н3РО4 осуществляется в митохондриях при миграции электронов от субстрата к кислороду через цепь дыхательных катализаторов. При этом указанные авторы обнаружили, что отношение P/О, т. е. число молекул неорганического фосфата, перешедших в органическую форму (АТФ), в расчете на каждый поглощенный атом кислорода близко к 3.
Установлено, что уменьшение свободной энергии системы при переносе пары электронных эквивалентов от НАДН2 к молекулярному кислороду составляет 220 кДж (52,7 ккал). В свою очередь величина стандартной свободной энергии образования АТФ из АДФ и Н3РО4 (АДФ + Н3РО4 --> АТФ + Н2О) находится в пределах 30,2 кДж, или +7,3 ккал (по-видимому, в условиях in vivo эта величина около 34,5 кДж). Следовательно, уменьшение свободной энергии при переносе одной пары электронов от НАДН2 к кислороду способно обеспечить синтез нескольких молекул АТФ из АДФ и фосфата. В табл. 25 приведены некоторые данные об энергетических взаимоотношениях в пределах отдельных фрагментов дыхательной цепи.
31.Образование в процессах метаболизма воды и углекислоты - конечных продуктов обмена веществ; привести примеры.
32.Современные представления о мех-ме тканевого дыхания. Характеристика ферментов и коферментов.
Современная теория тканевого дыхания
Тканевое дыхание - основа биологического окисления и представляет собой совокупность окислительно-восстановительных реакций, связанных с потреблением организмом кислорода, освобождением химической энергии, выделением углекислого газа и воды. Часть окислительных реакций в организме не сопровождается накоплением энергии и не входит в комплекс тканевого дыхания. Эти реакции осуществляют превращения некоторых веществ (например, окисление при образовании стероидных гормонов, желчных кислот и т. д.).
Дыхательная цепь
Дыхательная цепь является частью процесса окислительного фосфорилирования (см. с. 126). Компоненты дыхательной цепи катализируют перенос электронов от НАДН + Н+ или восстановленного убихинона (QH2) на молекулярный кислород. Из-за большой разности окислительно-восстановительных потенциалов донора(НАДН + Н+ и, соответственно, QH2) и акцептора (О2) реакция является высокоэкзергонической (см. с. 24). Большая часть выделяющейся при этом энергии используется для создания градиента протонов (см. с. 128) и, наконец, для образования АТФ с помощью АТФ-синтазы.
Компоненты дыхательной цепи
Дыхательная цепь включает три белковых комплекса (комплексы I, III и IV), встроенных во внутреннюю митохондриальную мембрану, и две подвижные молекулы-переносчики — убихинон (кофермент Q) и цитохром с. Сукцинатдегидрогеназа, принадлежащая собственно к цитратному циклу, также может рассматриваться как комплекс II дыхательной цепи. АТФ-синтаза (см. с. 144) иногда называется комплексом V, хотя она не принимает участия в переносе электронов.
Комплексы дыхательной цепи построены из множества полипептидов и содержат ряд различныхокислительно-восстановительных коферментов, связанных с белками (см. сс. 108, 144). К ним принадлежат флавин [ФМН (FMN) или ФАД (FAD), в комплексах I и II], железо-серные центры (в I, II и III) и группы гема (в II, III и IV). Детальная структура большинства комплексов еще не установлена.
Электроны поступают в дыхательную цепь различными путями. При окислении НАДН + Н+ комплекс I переносит электроны через ФМН и Fe/S-центры на убихинон. Образующиеся при окислении сукцината, ацил-КоА и других субстратов электроны переносятся на убихинон комплексом II или другой митохондриальной дегидрогеназой через связанный с ферментом ФАДН2 или флавопротеин (см. с. 166), При этом окисленная форма кофермента Q восстанавливается в ароматический убигидрохинон. Последний переносит электроны в комплекс III, который поставляет их через два гема b, один Fe/S-центр и гем с1 на небольшой гемсодержащий белок цитохром с. Последний переносит электроны к комплексу IV, цитохром с-оксидазе. Цитохром с-оксидаза содержит для осуществления окислительно-восстановительных реакций два медьсодержащих центра (CuA и CuB) и гемы а и а3, через которые электроны, наконец, поступают к кислороду. При восстановлении О2образуется сильный основной анион О2-, который связывает два протона и переходит а воду. Поток электронов сопряжен с образованным комплексами I, III и IV протонным градиентом.
Ферменты подразделяют на простые и сложные. Простые ферменты состоят только из белка. Это многие ферменты пищеварительного тракта — амилаза, пепсин, трипсин. Сложные ферменты состоят из белковой части, которая называется апоферментом, и небелковой, которая называется кофактором. Молекулу сложного фермента часто называют холоферментом. Кофакторы, которые слабо связаны с белковой частью фермента, называются коферментами (коэнзимами). Кофермент может легко переходить от одного фермента к другому. Кофакторы, прочно связанные с белковой частью фермента, называются простетической группой. Кофакторами могут быть различные органические вещества и их комплексы, а также минеральные вещества. Многие из них термостабильны, но могут окисляться атмосферным кислородом. В организме человека ряд кофакторов не синтезируется, а поступает с продуктами питания. Их строение и участие в биологических процессах рассмотрено далее.
В проявлении каталитической активности фермента принимает участие не вся его молекула, а только незначительная часть, которая называется активным центром. Активный центр — это часть молекулы фермента, которая взаимодействует с коферментом и субстратом и участвует в преобразовании вещества. Активный центр ферментов может быть образован несколькими функциональными группами отдельных аминокислот, расположенными в различных участках полипептидной цепи белка. Поэтому для проявления каталитической активности фермента важна его нативная структурная организация. При нарушении этой структуры изменяется активный центр, а значит, и активность фермента. Существуют ферменты, которые состоят из нескольких белковых молекул, т. е. имеют субъединичное строение. Они могут иметь несколько активных центров или единый центр, образованный при взаимодействии этих субъединиц.
Кофакторы. Каталитическая активность сложных ферментов проявляется только в присутствии коферментов:
Кофермент участвует в формировании активного центра фермента. Многие коферменты имеют сложное строение и включают витамины. Таким образом, регуляторное влияние витаминов на обмен веществ опосредовано через ферменты.
33.Современная теория тканевого дыхания. Дыхательная цепь, ее надмолекулярная организация.
Современная теория тканевого дыхания
Тканевое дыхание - основа биологического окисления и представляет собой совокупность окислительно-восстановительных реакций, связанных с потреблением организмом кислорода, освобождением химической энергии, выделением углекислого газа и воды. Часть окислительных реакций в организме не сопровождается накоплением энергии и не входит в комплекс тканевого дыхания. Эти реакции осуществляют превращения некоторых веществ (например, окисление при образовании стероидных гормонов, желчных кислот и т. д.).
Дыхательная цепь
Дыхательная цепь является частью процесса окислительного фосфорилирования (см. с. 126). Компоненты дыхательной цепи катализируют перенос электронов от НАДН + Н+ или восстановленного убихинона (QH2) на молекулярный кислород. Из-за большой разности окислительно-восстановительных потенциалов донора(НАДН + Н+ и, соответственно, QH2) и акцептора (О2) реакция является высокоэкзергонической (см. с. 24). Большая часть выделяющейся при этом энергии используется для создания градиента протонов (см. с. 128) и, наконец, для образования АТФ с помощью АТФ-синтазы.
Компоненты дыхательной цепи
Дыхательная цепь включает три белковых комплекса (комплексы I, III и IV), встроенных во внутреннюю митохондриальную мембрану, и две подвижные молекулы-переносчики — убихинон (кофермент Q) и цитохром с. Сукцинатдегидрогеназа, принадлежащая собственно к цитратному циклу, также может рассматриваться как комплекс II дыхательной цепи. АТФ-синтаза (см. с. 144) иногда называется комплексом V, хотя она не принимает участия в переносе электронов.
Комплексы дыхательной цепи построены из множества полипептидов и содержат ряд различныхокислительно-восстановительных коферментов, связанных с белками (см. сс. 108, 144). К ним принадлежат флавин [ФМН (FMN) или ФАД (FAD), в комплексах I и II], железо-серные центры (в I, II и III) и группы гема (в II, III и IV). Детальная структура большинства комплексов еще не установлена.
Электроны поступают в дыхательную цепь различными путями. При окислении НАДН + Н+ комплекс I переносит электроны через ФМН и Fe/S-центры на убихинон. Образующиеся при окислении сукцината, ацил-КоА и других субстратов электроны переносятся на убихинон комплексом II или другой митохондриальной дегидрогеназой через связанный с ферментом ФАДН2 или флавопротеин (см. с. 166), При этом окисленная форма кофермента Q восстанавливается в ароматический убигидрохинон. Последний переносит электроны в комплекс III, который поставляет их через два гема b, один Fe/S-центр и гем с1 на небольшой гемсодержащий белок цитохром с. Последний переносит электроны к комплексу IV, цитохром с-оксидазе. Цитохром с-оксидаза содержит для осуществления окислительно-восстановительных реакций два медьсодержащих центра (CuA и CuB) и гемы а и а3, через которые электроны, наконец, поступают к кислороду. При восстановлении О2образуется сильный основной анион О2-, который связывает два протона и переходит а воду. Поток электронов сопряжен с образованным комплексами I, III и IV протонным градиентом.
34.Пиридинзависимые дегидрогеназы. Структура НАД и НАДФ, их участие в окислительно-восстановительных реакциях.
Пиридинзависимые дегидрогеназы
К числу пиридинзависимых дегидрогеназ относится свыше 150 ферментов, которые катализируют восстановление НАД и НАДФ различными органическими субстратами.
НАД и НАДФ являются динуклеотидами, в которых мононуклеотиды связаны между собой через остатки фосфорной кислоты. В состав одного из нуклеотидов входит амид никотиновой кислоты (витамин РР), другой представляет собой адениловую кислоту. В молекуле НАДФ имеется еще один остаток фосфорной кислоты, присоединенный к рибозе в положении С3'.
Катализируемые пиридинзависимыми дегидрогеназами реакции можно изобразить так:
Способность
НАД и НАДФ играть роль промежуточного
переносчика водорода связана с наличием
в их структуре амида никотиновой кислоты.
В электронно-протонной форме обратимое
гидрирование - дегидрирование
(присоединение и отдача протонов и
электронов)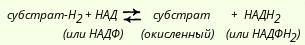
При переносе двух восстановительных эквивалентов от субстрата на НАД+ один из них затем присутствует в восстановленном коферменте в виде водорода, а другой - в виде электрона. Свободный ион Н+ остается в среде. Для простоты обычно восстановленные формы НАД и НАДФ изображают символами НАДН2 и НАДФН2.
-Метаболическая роль коферментов: НАД+ используется в окислении, которое является частью катаболических процессов, НАДФН используется как восстановитель в анаболических реакциях (биосинтезы, обезвреживание).
Некоторые ферменты могут использовать оба кофермента, но большинство ферментов имеют один из пиридинзависимых коферментов.
НАДН и НАДФН не проходят через внутреннюю мембрану митохондрий, но могут передавать электроны в митохондрию через специальные механизмы.
35.Флавинзависимые дегидрогеназы и оксидазы. Структура ФМН и ФАД. Их участие в ОВ реакциях.
Дегидрогеназы представляют собой энзимы класса оксидоредуктаз, которые катализируют реакции отщепления водорода (то есть протонов и электронов) от субстрата, который является окислителем, и транспортируют его на другой субстрат, который восстанавливается.
Флавинзависимые дегидрогеназы - флавопротеины, простетическими группами в которых ФАД или ФМН - производные витамина В2, которые прочно (ковалентно) связаны с апоферментом. Данные дегидрогеназы - мембраносвязанные ферменты, окисляющие неполярные и малополярные субстраты. Рабочей частью молекулы ФАД или ФМН, которая участвует в окислительно-восстановительных реакциях, является изоалоксазиновое кольцо рибофлавина, который акцептирует два атома водорода (2Н+ + 2е-) от субстрата.
Общее уравнение реакции с участием флавинзависимых дегидрогеназ выглядит так:
SH2 + ФМН → S + ФМН-Н2
SH2 + ФАД+ → S + ФАДН2
В процессах биологического окисления данные ферменты играют роль как анаэробных, так и аэробных дегидрогеназ. К, анаэробным дегидрогеназам принадлежит НАДН-дегидрогеназа, ФМН-зависимый фермент, который передает электроны от НАДН на более электроположительны компоненты дыхательной цепи митохондрий. Другие дегидрогеназы (ФАД-зависимые) переносят электроны непосредственно от субстрата на дыхательную цепь (например, сукцинатдегидрогеназа, ацил-КоА-дегидрогеназа). Транспортировка электронов от флавопротеинов к цитохромоксидазам в дыхательной цепи обеспечивают цитохромы, которые, кроме цитохромоксидазы, по классификации как анаэробные дегидрогеназы. Цитохромы – представляют собой железосодержащие протеины митохондрий - гемпротеины, которые за счет обратного изменения валентности геминового железа выполняют функцию транспортировки электронов в аэробных клетках непосредственно в цепях биологического окисления: цитохром (Fe3 +) + е → цитохром (Fe2 +).
В состав дыхательной цепи митохондрий входят цитохромы b, с1, с, а и а3 (цитохромоксидаза). Кроме дыхательной цепи, цитохромы содержатся в эндоплазматическом ретикулуме (450 и b5). К аэробным флавинзависимым дегидрогеназам принадлежат оксидазы L-аминокислот, ксантиноксидаза и др.
Дегидрогеназы, катализируют включение одного или двух атомов кислорода в молекулу субстрата, получили название оксигеназы. В зависимости от количества атомов кислорода, которые взаимодействуют с субстратом, оксигеназы делят на 2 группы:
-
Диоксигеназы
-
Монооксигеназы
Оксидазы.Катализируют удаление водорода из субстрата, используя при этом в качестве акцептора водорода только кислород. Оксидазы содержат медь, продуктом реакции является вода (исключение составляют реакции, катализируемые уриказой и моноаминоксидазой, в результате которых образуется Н2О2).
В качестве субстратов оксидаз могут выступать фенолы, полифенолы, амины. Примерами ферментов класса оксидаз являются фенолаза, цитохром-оксидаза, моноаминоксидаза, уриказа.
Флавиновые ферменты – это сложные белки, простетической группой которых, как уже отмечалось, являются либо флавинмононуклеотид (ФМН), либо флавинадениндинуклеотид (ФАД).
ФМН и ФАД прочно, в отличие от коферментов НАД+ и НАДФ+, присоединены к апоферменту, выступая, таким образом, в качестве простетических групп, а не свободно диссоциирующих коферментов. Обе группы представляют собой метаболически активную форму рибофлавина (витамин В2).
Механизм действия ФМН и ФАД. Активной частью молекулы ФАД или ФМН служит изоаллоксазиновое кольцо рибофлавина. Два атома водорода (два протона и два электрона) присоединяются к первому и десятому атомам азота за счет внутримолекулярной перегруппировки двойных связей в кольце. Реакция восстановления ФМН имеет вид:
Окисленная форма ФМН Восстановленная форма ФМН.2Н В соответствии с более положительными величинами окислительно-восстановительных потенциалов, чем у никотинамидных коферментов (около - 0,1 В), флавопротеиды могут акцептировать водород от НАД.2Н: НАД.2Н + ФМН = НАД+ + ФМН.2Н. Именно этот процесс протекает в дыхательной цепи ферментов на внутренней мембране митохондрий. В некоторых случаях, например при окислении янтарной кислоты, α-глицерофосфата и КоА-производных жирных кислот, флавинзависимые ферменты могут играть роль первичных дегидрогеназ и непосредственно принимать электроны и протоны от окисляемых субстратов без участия НАД и связанных с ним дегидрогеназ. В клетках также имеются аэробные флавиновые ферменты, осуществляющие перенос атомов водорода от субстрата к кислороду с образованием Н2О2.
36.Строение и роль железосодержащих ферментов в тканевом дыхании.
Железосодержащие ферменты играют очень важную роль в качестве катализаторов окислительно-восстановительных реакций в животном организме; железо входит в состав их простетическои группы в комплексном соединении с порфирином.
Железо-серные ферменты-это еще один важный класс железосодержащих ферментов, участвующих в переносе электронов в клетках животных, растений и бактерий. Железо-серные ферменты не содержат гемогрупп; они характеризуются тем, что в их молекулах присутствует равное число атомов железа и серы, которые находятся в особой лабильной форме, расщепляющейся под действием кислот. К железо-серным ферментам относится, например, ферредок-син хлоропластов, осуществляющий перенос электронов от возбужденного светом хлорофилла на разнообразные акцепторы электронов.
Полагают, что введение метгемоглобинообразователей будет способствовать связыванию сероводорода метгемоглобином и тем самым уменьшать его взаимодействие с тканевыми железосодержащими ферментами.
Со стороны нервной системы бывают галлюцинации, расстройства речи и др., нарушается углеводный и холестериновый обмен, а также окислительно-восстановительные процессы железосодержащих ферментов.
Перенос водорода с субстрата на кислород при тканевом дыхании, как правило, совершается не непосредственно, а при участии ряда промежуточных ферментативных систем. Первой из этих систем тканевого дыхания при окислении таких веществ, как фосфоглицериновый альдегид, молочная кислота, лимонная кислота, является дегидраза. В систему дегидразы входит кодегидраза, играющая роль водородного акцептора. Образовавшаяся восстановленная кодегидраза не может непосредственно окисляться кислородом. Она подвергается дегидрированию, взаимодействуя с флавиновым ферментом. Последний при тканевом дыхании в свою очередь окисляется одним из цитохромов. Цитохромы представляют собой железосодержащие клеточные пигменты, причем восстановленный цитохром содержит двухвалентное железо в геминовой группе, а окисленный — трехвалентное. Система окислительных ферментов тканевого дыхания завершается также железосодержащим ферментом — цитохромоксидазой, окисляющей цитохромы и способной реагировать непосредственно с кислородом, который окисляет двухвалентное железо этого фермента в трехвалентное.
37.Что такое разобщители и блокаторы тканевого дыхания? Охарактеризуйте механизм разобщения цепи тканевого дыхания. Каков энергетический эффект разобщения? Приведите примеры необратимой блокировки цепи тканевого дыхания.
Разобщители тканевого дыхания
Известны вещества, способные разобщать процессы биологического окисления и фосфорилирования. Такими свойствами обладают, как правило, липофильные соединения, содержащие фенольную группировку в молекуле и являющиеся слабыми органическими кислотами. Наиболее известными и широко используемыми в хозяйственной деятельности являются 2,4-динитрофенол (ДНФ), динитро-о-крезол (ДНОК), пентахлорфенол. При авариях на промышленных объектах и других чрезвычайных ситуациях эти вещества могут стать причиной массового поражения людей.
In vitro «разобщители» стимулируют скорость потребления кислорода митохондриями и индуцируют активность АТФазы. In vivo в результате их действия значительно активируются процессы биологического окисления и потребление кислорода тканями, однако содержание АТФ и других макроэргов в клетках при этом снижается. Развиваются типичные для отравления веществами общеядовитого действия признаки интоксикации (см. выше). Образующаяся в ходе окисления субстратов энергия рассеивается в форме тепла, температура тела отравленного резко повышается, что является характерным признаком острого отравления «разобщителями».
Блокаторы: Ингибиторы тканевого дыхания блокируют один из трех пунктов сопряжения дыхания и фосфорилирования. Все ингибиторы можно разделить на три группы, действие которых представлено на схеме 11.
I группа ингибирует дыхательную цепь на уровне 1-го пункта сопряжения дыхания и фосфорилирования. К данным веществам относятся, например, ротенон («рыбий яд»), амобарбитал (препарат барбитурового ряда). При этом прерывается поступление водорода от субстратов окисляющихся через НАД-зависимые дегидрогеназы. Выключается также первое из трех звеньев фосфорилирования. Данная группа ингибиторов не влияет на использование субстратов, окисляющихся через ФАД-зависимые дегидрогеназы.
II группа ингибиторов, к которым относится антимицин А (антибиотик, выделенный из стрептомицетов) блокирует дыхательную цепь на уровне 2-го сопряжения дыхания и фосфорилирования и выключает участок цепи до блока.
Дыхание возможно только в присутствии аскорбиновой кислоты, которая, превращаясь в дегидроаскорбиновую кислоту по уравнению, представленному ниже, передает водород непосредственно на цитохром с. При этом образуется только одна молекула АТФ на уровне цитохромоксидазы.
III группа ингибиторов тканевого дыхания, к которым относятся цианиды (например, NaCN, KCN), сероводород (H2S), оксид углерода (II), (СО, угарный газ) необратимо блокируют цитохромоксидазу, т.е. 3-й пункт сопряжения дыхания и фосфорилирования.
Это приводит к полному прекращению тканевого дыхания и быстрой гибели клетки от дефицита энергии. Поэтому ингибиторы цитохромоксидазы являются сильнейшими ядами. Оксид углерода (II), кроме того, нарушает транспорт кислорода кровью путем образования с гемоглобином устойчивого соединения - карбоксигемоглобин.
38.Факторы, влияющие на активность тканевого дыхания и окислительного фосфорилирования.
39.Микросомальное окисление, характеристика ферментов в тканевом дыхании.
Микросомальное окисление – это каскад реакций, входящих в первую фазу преобразования ксенобиотиков. Суть процесса заключается в гидроксилировании веществ с использованием атомов кислорода и образованием воды. Благодаря этому меняется структура первоначального вещества, а его свойства могут как подавляться, так и усиливаться.
Микросомальное окисление позволяет перейти к реакции конъюгации. Это вторая фаза преобразования ксенобиотиков, в конце которой к уже существующей функциональной группе присоединятся молекулы, вырабатываемые внутри организма. Иногда образуются промежуточные вещества, вызывающие повреждение клеток печени, некроз и онкологическое перерождение тканей.
Окисление оксидазного типа
Реакции микросомального окисления происходят вне митохондрий, поэтому на них расходуется около десяти процентов всего кислорода, попадающего в организм. Основные ферменты в этом процессе – оксидазы. В их структуре присутствуют атомы металлов с переменной валентностью, такие как железо, молибден, медь и другие, а значит, они способны принимать электроны. В клетке оксидазы расположены в особых пузырьках (пероксисомах), которые находятся на внешних мембранах митохондрий и в ЭПР (зернистый эндоплазматический ретикулюм). Субстрат, попадая на пероксисомы, теряет молекулы водорода, которые присоединяются к молекуле воды и образуют перекись.
Существует всего пять оксидаз: - моноаминооксигеназа (МАО) – помогает окислять адреналин и другие биогенные амины, образующиеся в надпочечниках; - диаминооксигеназа (ДАО) – участвует в окислении гистамина (медиатор воспаления и аллергии), полиаминов и диаминов; - оксидаза L-аминокислот (то есть левовращающихся молекул); - оксидаза D-аминокислот (правовращающихся молекул); - ксантиноксидаза – окислят аденин и гуанин (азотистые основания, входящие в молекулу ДНК).
Тканевое дыхание представляет собой сложный ферментативный процесс. Все ферменты тканевого дыхания делятся на три группы: никотинамидные дегидрогеназы, флавиновые дегидрогеназы и цитохромы.
Никотинамидные дегидрогеназы отнимают два атома водорода от окисляемого субстрата и временно присоединяют их к своему коферменту НАД(никотинамид-аденин-динуклеотид). По строению НАД является динуклеотидом, в котором два нуклеодида соединяются между собой остатками фосфорной кислоты. В состав одного из нуклеодидов в качестве азотистого основания входит амид никотиновой кислоты(никитинамид, витамин РР), вторым нуклеотидом является аденозинмонофосфат (АМФ):
Отнимаемые от окисляемого вещества атомы водорода присоединяются непосредственно к никотинамиду (отсюда название данных ферментов – никотинамидные дегидрогеназы), при этом НАД переходит в свою восстановленную форму НАД·Н2:
Флавиновые дегидрогеназыотщепляют два атомаводорода от образовавшегося НАД·Н2 и временно присоединяют их к своему коферменту ФМН (флавин-мононуклеотид). По строению этот кофермент является мононуклеотидом, содержащимвитамин В2 (рибофлавин):
Два атома водорода, отнимаемые флавиновыми дегидрогеназами от восстановленного НАД (НАД·Н2) присоединяются к флавину, выполняющего роль акцептора водорода. В результате этой стадии образуется восстановленная форма кофермента - ФМН·Н2:
В некоторых случаях флавиновые дегидрогеназы, подобно никотинамидным, отнимают два атома водорода непосредственно от окисляемых веществ. Такие флавиновые дегидрогеназы используют кофермент ФАД (флавин-аденин-динуклеотид), похожий по строению на ФМН и тоже содержащий витамин В2:
40.Специфические и общие пути катаболизма углеводов, липидов, белков. Ацетилкоэнзим А, его возникновение и превращения.
Катаболизм углеводов
Процессы обмена углеводов у человека начинаются в ротовой полости, так как в состав слюны входит фермент амилаза, который способен расщеплять крахмал и гликоген до дисахарида – мальтозы, которая ферментом мальтазой расщепляет последнюю до глюкозы. Поступление глюкозы в клетки различных органов зависит от гормона инсулина, который регулирует скорость переноса глюкозы через мембраны клеток. переносчиками – белками.
Обмен глюкозы в клетке начинается с ее фосфорилирования:
![]() глюкоза
+ АТФ глюкозо-6-фосфат + АДФ
глюкоза
+ АТФ глюкозо-6-фосфат + АДФ
+ АТФ → + АДФ
В отличие от свободной глюкозы, глюклзо-6-фосфат не способен проходить через клеточные мембраны, поэтому фосфорилированная глюкоза как бы «запирается» в клетке, и там запасается в форме гликогена – животного крахмала, который синтезируется из молекул глюкозо-6-фосфата.
Катаболизм глюкозы в клетке может идти по трем основным направлениям, которые различаются по способу изменения углеродного скелета молекулы:
1. Дихотомический путь, при котором происходит расщепление связи С-С между третьим и четвертым атомами углерода, и из одной молекулы гексозы получаются две триозы (С6→2С3).
2. Апотомический путь (пентозофосфатный), при котором гексоза превращается в пентозу (С6 → С5) в результате окисления и отщепления одного (первого) углеродного атома.
3.Глюкуроновый путь, когда происходит окисление и отщепление шестого углеродного атома
Катаболизм липидов:
Липиды это основной энергетический резерв человеческого (да не только) организма. Удельная энергоемкость на один грамм превышает таковую у белков и углеводов в два раза. Это также дает "экономию" свободного места в теле.Для такого же объема энергии в виде гликогена пришлось бы увеличить массу тела на 10-15 кг. Нормально так.
Для мышц, сердца, почек, печени при голодании или физической работе жирные кислоты становятся важным источником энергии. Печень перерабатывает часть жирных кислот в кетоновые тела, используемые мозгом, нервной тканью и некоторыми другими тканями как источники энергии.
Основной процесс катаболизма липида - это расщепление триацилглицерола до глицерина и трех молекул жирных кислот, которые дают существуенный выбор энергии.
