
- •«Молекулярные основы биоэнергетических процессов и общие пути катаболизма в организме человека . Ферменты»
- •Мультиферментные комплексы
- •Факторы, влияющие на скорость ферментативных реакций
- •Способы регуляции активности ферментов
- •Ковалентная (химическая) модификация
- •Диагностика энзима в моче
- •1. Обратимое 2. НеобратимоеА. Конкурентное а. Специфическое б. Неконкурентное б. Неспецифическое
- •Наследственные энзимопатии по типу нарушений метаболизма делят на:
- •Стадии метаболизма
- •Обмен веществ.Метаболические пути. Унификация питательных веществ.
- •Роль в организме
- •Энергетический эффект цикла Кребса Итак, при распаде 1 моль ацетил-КоА образуется 12 моль атф, следовательно, из 2 моль ацетил-КоА - 24 моль атф.
- •Механизм : Окислительное фосфорилирование
- •Специфические и общие пути катаболизма
- •Окислительное декарбоксилирование пировиноградной кислоты (пвк)
- •Окислительное декарбоксилирование пировиноградной кислоты (пвк)
1. Обратимое 2. НеобратимоеА. Конкурентное а. Специфическое б. Неконкурентное б. Неспецифическое
23.Применение ферментов в медицине. Понятие об энзимопатиях. Примеры.
Ферментные препараты широко используют в медицине. Ферменты в медицинской практике находят применение в качестве диагностических (энзимодиагностика) и терапевтических (энзимотерапия) средств.
Кроме того, ферменты используют в качестве специфических реактивов для определения ряда веществ. Так, глюкозооксидазу применяют для количественного определения глюкозы в моче и крови. Фермент уреазу используют для определения содержания количества мочевины в крови и моче.
Энзимопатии – это группа заболеваний, которые вызваны различными дефектами ферментов. Энзимопатий делятся на: наследственные (первичные) и приобретенные (вторичные).
Наследственные энзимопатии – это заболевания, вызванные наследственными нарушениями биосинтеза ферментов или их структуры и функции.
Наследственные энзимопатии по типу нарушений метаболизма делят на:
-
нарушения обмена аминокислот: фенилкетонурия, альбинизм, алкаптонурия
-
нарушения углеводного обмена: наследственная непереносимость фруктозы,
-
нарушения липидного обмена: липидозы;
-
нарушения обмена нуклеиновых оснований: подагры
-
нарушение обмена в соединительной ткани: хондродистрофия и др.;
24.Понятие метаболизма. Стадии метаболизма. Цикл трикарбоновых кислот (цикл Кребса), его роль в обмене углеводов, липидов, аминокислот.
Метаболизм – это химические реакции, возникающие с момента поступления в организм питательных веществ до момента выделения во внешнюю среду конечных продуктов этих реакций. Это сложный процесс преобразования потребляемой пищи в жизненную энергию. В метаболизм вовлечены все реакции, протекающие в живых клетках, результатом которых является строительство структур тканей и клеток. То есть, метаболизм можно рассматривать, как процесс обмена в организме веществ и энергии.
Стадии метаболизма
-
Стадия анаболизма, то есть комплекс химических процессов, которые направлены на создание клеток и тканей.
-
Стадия катаболизма, то есть процесс, во время которого происходит расщепление собственных и пищевых молекул на простые вещества, с последующим высвобождением энергии.
Эти две стадии в идеале должны быть гармонично сбалансированными при помощи ферментов и гормонов, так как именно они отвечают за обменные процессы в организме и являются своеобразными катализаторами химических реакций.
Цикл трикарбоновых кислот (цикл Кребса)
образовавшийся в результате окислительного декарбоксилирования пирувата ацетил-КоА вступает в цикл Кребса. Данный цикл состоит из восьми последовательных реакций
В первой реакции, катализируемой ферментом цитратсинтазой, ацетил-КоА конденсируется с оксалоацетатом. В результате образуется лимонная кислота:
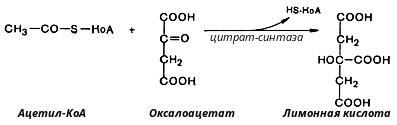
По-видимому, в данной реакции в качестве промежуточного продукта образуется связанный с ферментом цитрил-КоА. Затем последний самопроизвольно и необратимо гидролизуется с образованием цитрата и HS-KoA.
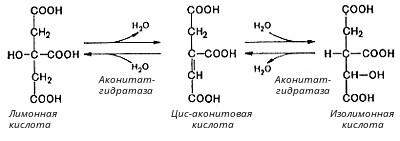
Во второй реакции цикла образовавшаяся лимонная кислота подвергается дегидратированию с образованием цис-аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту. Катализирует эти обратимые реакции гидратации-дегидратации фермент аконитат-гидратаза:
В третьей реакции, которая, по-видимому, лимитирует скорость цикла Кребса, изолимонная кислота дегидрируется в присутствии НАД-зависимой изоцитратдегидрогеназы:
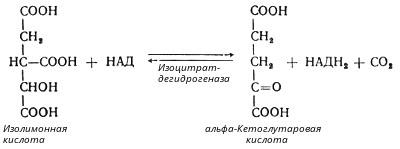
(В тканях существует два типа изоцитратдегидрогеназ: НАД- и НАДФ-зависимые. Установлено, что роль основного катализатора окисления изолимонной кислоты в цикле Кребса выполняет НАД-зависимая изоцитратдегидрогеназа.)
В ходе изоцитратдегидрогеназной реакции изолимонная кислота декарбоксилируется. НАД-зависимая изоцитратдегидрогеназа является аллостерическим ферментом, которому в качестве специфического активатора необходим АДФ. Кроме того, фермент для проявления своей активности нуждается в ионах Mg2+или Мn2+.
В четвертой реакции происходит окислительное декарбоксилирование α-кетоглутаровой кислоты до сукцинил-КоА. Механизм этой реакции сходен с реакцией окислительного декарбоксилирования пирувата до ацетил-КоА. α-Кетоглутаратдегидрогеназный комплекс напоминает по своей структуре пируватдегидрогеназный комплекс. Как в одном, так и в другом случае в ходе реакции принимают участие пять коферментов: TДФ, амид липоевой кислоты, HS-KoA, ФАД и НАД. Суммарно данную реакцию можно написать так:
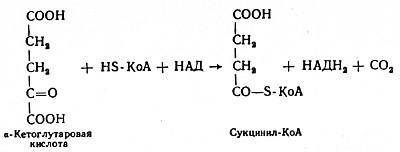
Пятая реакция катализируется ферментом сукцинил-КоА-синтетазой. В ходе этой реакции сукцинил-КоА при участии ГДФ и неорганического фосфата превращается в янтарную кислоту (сукцинат). Одновременно происходит образование высокоэргической фосфатной связи ГТФ1 за счет высокоэргической тиоэфирной связи сукцинил-КоА:
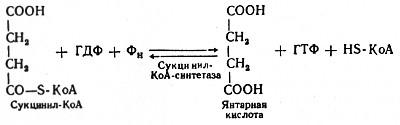
(Образовавшийся ГТФ отдает затем свою концевую фосфатную группу на АДФ, вследствие чего образуется АТФ. Образование высокоэргического нуклеозидтрифосфата в ходе сукцинил-КоА-синтетазной реакции - пример фосфорилирования на уровне субстрата.)
В шестой реакции сукцинат дегидрируется в фумаровую кислоту. Окисление сукцината катализируется сукцинатдегидрогеназой, в молекуле которой с белком ковалентно связан кофермент ФАД:
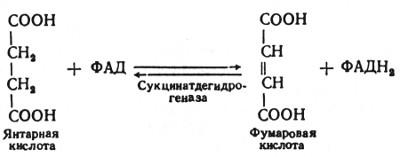
В седьмой реакции образовавшаяся фумаровая кислота гидратируется под влиянием фермента фумаратгидратазы. Продуктом данной реакции является яблочная кислота (малат). Следует отметить, что фумаратгидратаза обладает стереоспецифичностью, - в ходе данной реакции образуется L-яблочная кислота:
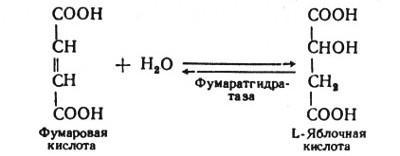
Наконец, в восьмой реакции цикла трикарбоновых кислот под влиянием митохондриальной НАД-зависимой малатдегидрогеназы происходит окисление L-малата в оксалоацетат:
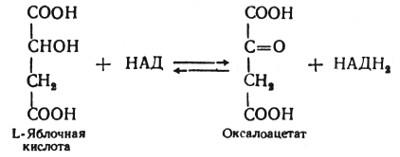
Как видно, за один оборот цикла, состоящего из восьми ферментативных реакций, происходит полное окисление ("сгорание") одной молекулы ацетил-КоА. Для непрерывной работы цикла необходимо постоянное поступление в систему ацетил-КоА, а коферменты (НАД и ФАД), перешедшие в восстановленное состояние, должны снова и снова окисляться. Это окисление осуществляется в системе переносчиков электронов (или в цепи дыхательных ферментов), локализованной в митохондриях.
