- ••Бактериологические исследования мяса
- ••При различных заболеваниях животных и птицы мышцы и внутренние органы нередко обсеменены микроорганизмами.
- •1.при подозрении на остропротекающие инфекционные заболевания (сибирская язва, эмфизематозный карбункул и др.);
- •11.при пироплазмидозах в случае исчезновения желтушности в течение двух суток;
- •23.при обнаружении серозных и фибринозных, перикардитов у свиней;
- •В зависимости от предполагаемого диагноза и характера патологоанатомических изменений для бактериологического исследования в
- •Пробы берут стерильными инструментами. Каждую пробу в отдельности заворачивают в пергаментную бумагу или
- •Пробы: мясо, лимфатические узлы, внутренние органы, костный мозг
- •Образцы освобождают от жировой и соединительной ткани, погружают на 2—3 мин. в спирт
- •Посев в среду обогащения производят следующим
- •Колонии, подозрительные на Вас. anthracis, отвивают на
- •Обнаружение бацилл сибирской язвы. Сущность метода выявления бацилл сибирской язвы заключается в определении
- •Рост Вас. Anthracis на кровяном МПА
- •Мазок из чистой культуры Вас. Anthracis (РИФ)
- •На МПБ сибиреязвенные бациллы растут в виде крупных хлопьев, оседающих на дно пробирки
- •Из исследуемого материала готовят взвесь на физиологическом растворе. 0,5 мл этой взвеси вводят
- •2 г исследуемого материала мелко нарезают, помещают в пробирку и заливают 10 мл
- •Для дифференциации необходимо сделать посевы на МПБ с кровью, МПЖ и исследовать культуру
- •В две пробирки с МПА, содержащими 0,5 и 0,05 ед. пенициллина, и в
- •Для постановки этого теста применяют фаг «Гамма МВА». Исследуемую культуру высевают в 3
- •Свертываемость желтка куриного яйца определяют следующим образом. Исследуемую культуру высевают в пробирку со
- •Наличие в чашках с МПА прозрачных колоний обусловливает необходимость проведения исследований на присутствие
- •Если в мазках, приготовленных из мелких прозрачных колоний, обнаруживают коккообразные грамотрицательные палочки, расположенные
- •Показатели
- •Наличие на чашках с МПА мелких прозрачных или слегка мутноватых колоний, образующих иногда
- •На дифференциально-диагностических средах (Эндо, Левина) учитывают подозрительные колонии, характерные для сальмонелл. В случае
- •Сначала культуру испытывают в реакции агглютинации с одной из О- сывороток. Выбирают сыворотку,
- •На предметное стекло из ампулы наносят каплю неразведенной сыворотки. Затем платиновой петлей берут
- •В случае отрицательной реакции агглютинации, но при характерном росте на элективной среде и
- •Для идентификации сальмонеллезных культур предлагается использовать О-фаготест — определение фагочувствительности сальмонелл к О-бактериофагу.
- •Сущность метода заключается в изучении морфологических, культуральных, ферментативных свойств этих бактерий.
- •Сущность выявления анаэробов заключается в определении их морфологии, способности расти на питательных средах
- •Диагноз на анаэробные инфекции ставят на основании бактериоскопии, посева материала на питательные среды
- •Cl. perfringens — короткая, спорообразующая, неподвижная, грамположительная палочка, анаэроб. Существуют 6 типов Cl.
- •При подозрении на Cl. botulinum для выявления типа Е пробирки — одну непрогретую
- •Аналогичный эксперимент можно провести с 6—7-месячной культурой, выращенной на печеночном бульоне. Пастеровской пипеткой
- •Вид возбудителя
- •Вид возбудителя
- •Вид возбудителя
- •Микобактерии — это микроорганизмы, обладающие способностью при культивировании на питательных средах образовывать длинные
- •Влаборатории из присланного материала (кусочки печени, селезенки, легких
- •Для получения культур микобактерий туберкулеза материал перед посевом обрабатывают по методу Л, П.
Cl. perfringens — короткая, спорообразующая, неподвижная, грамположительная палочка, анаэроб. Существуют 6 типов Cl. perfringens, обозначаемых начальными буквами латинского алфавита. Некоторые представители этих типов могут быть патогенными. Типы В, С, D, E являются возбудителями энтеротоксемии различных животных, а тип С также и возбудителем некротического энтерита людей.
В отличие от ботулизма пищевые заболевания, связанные с заражением продуктов Cl. perfringens, по-видимому, следует отнести к токсикоинфекциям.
Для бактериоскопии готовят 2—5 мазков-отпечатков Из каждой присланной пробы и окрашивают по Граму Или метиленовой синью, а при необходимости — на споры или капсулы. При микроскопировании обращают внимание на форму, наличие спор и капсул и расположение отдельных микроорганизмов.
Для посева на питательные среды пробы обжигают и навеску массой около 10 г растирают в стерильной ступке с физиологическим раствором в соотношении 1 : 2.
По 3—5 мл приготовленной взвеси засевают в четыре большие пробирки с мясной средой типа Тароцци, залитой слоем вазелинового масла толщиной 0,5 см, предварительно прогретой в кипящей водяной бане в течение 20—30 мин., а затем быстро охлажденной до температуры не ниже 50 °С. Посевы перед термостатированием прогревают при температуре 80°С в течение 20 мин. (две пробирки); при исследовании на Cl. botulinum типа Е одну пробирку прогревают при температуре 60 °С в течение 15 мин. (при этом сохраняются споры Cl. botulinum E), а другую при 80 °С в течение 20 мин. Остальные пробирки оставляют непрогретыми.

При подозрении на Cl. botulinum для выявления типа Е пробирки — одну непрогретую и одну прогретую до 60 °С — выдерживают при температуре 28°С.
Другие пробирки (непрогретую и прогретую при 80 °С) инкубируют при температуре 37 °С для выявления остальных анаэробов.
Термостатирование проводят в течение 5—10 сут.; наблюдают за ростом ежедневно. При обнаружении роста осуществляют микроскопическое исследование.
Для биологической пробы можно использовать присланный материал, а также чистую культуру. При подозрении на ботулизм биопробу ставят на белых мышах (реакция нейтрализации токсина противоботулинической сывороткой). Для этого исходный материал растирают в ступке со стерильным физиологическим раствором в соотношении 1 :2, для экстрагирования токсина выдерживают 1 —1,5 ч при комнатной температуре, а затем фильтруют через ватно-марлевый фильтр или центрифугируют при 3000 об/мин в течение 15—20 мин.
Далее проводят реакцию нейтрализации токсина; к 0,5—0,8 мл фильтрата (центрифугата) добавляют 0,24 мл смеси диагностических, моновалентных, противоботулинических сывороток типа А, В, С, D, E, F (по 0,04 мл каждого типа).
Двум мышам вводят внутривенно или внутрибрюшинно по 0,5—0,8 мл исследуемого фильтрата. Центрифугат вводят в такой же дозе только внутривенно. Другим двум мышам вводят смесь фильтрата (центрифугата) и сыворотки, где токсин находится в нейтрализованном состоянии (контроль).

Аналогичный эксперимент можно провести с 6—7-месячной культурой, выращенной на печеночном бульоне. Пастеровской пипеткой отсасывают верхний слой культуры, фильтруют через ватно-марлевый фильтр и вводят белым мышам в той же дозе.
Если при введении необработанного противоботулинической сывороткой фильтрата мыши погибли, биопроба считается положительной, то есть в исследуемом материале имеется токсин. Мыши, которым вводили смесь фильтрата (центрифугата) с сывороткой, выживают.
В случае гибели всех четырех мышей повторяют реакцию нейтрализации токсина в фильтрате (центрифугате) в разведении в 5, 10, 20 и более раз и вновь ставят биопробу.
При обнаружении в присланных пробах ботулинического токсина сразу же ставят развернутую реакцию нейтрализации с типоспецифическими диагностическими сыворотками для определения типа токсина.
При подозрении на энтеротоксемию овец и дизентерию ягнят взвесь в дозе 0,5—1 мл вводят внутримышечно кроликам или морским свинкам (гибель в течение суток); при подозрении на некробактериоз заражают подкожно кролика в область уха или мышь в область живота (появляются некрозы); при подозрении на столбняк — вводят подкожно фильтрат из культуры в дозе 0,5—0,8 мл белым мышам в область корня хвоста (погибают на третьи- четвертые сутки); при подозрении на эмкар — заражают внутримышечно взвесью в дозе 0,5—1 мл морскую свинку (погибает через 16—96 ч.); при подозрении на злокачественный отек — вводят внутримышечно взвесь. в дозе 1 мл морской свинке или мышке (погибают через 12—24 ч.); при подозрении на брадзот овец заражают взвесью подкожно или внутримышечно морскую свинку в дозе 1 мл (погибает через одни-двое суток).


Вид возбудителя
Возбудитель
эмкара: Cl. chauvoei
Возбудитель
злокачественного
отека: Cl. septicum *(+возбудитель брадзота овец)
Cl. oedematiens (Cl. novjyi)
* (+возбудитель брадзота овец)
Краткая характеристика в мазках из материала
Спорообразующая,
полиморфная палочка с закругленными концами, располагается попарно или одиночно
Спорообразующая,
полиморфная палочка с закругленными краями, располагается одиночно, иногда цепочки или нити
Спорообразующая,
крупная
полиморфная палочка с обрубленными краями, иногда короткие цепочки
Окраска по Граму
Положитель- ная; в старой культуре отрицательная
Положитель- ная; в старой культуре отрицательная
Положитель- ная; в старой культуре отрицательная
Под- |
Форма и |
виж- |
расположение |
ность |
спор |
Овальная,
центральное + или
сублингваль- ное
Овальная;
центральное + или
субцентраль- ное
Овальная;
центральное + или
субцентраль- ное
Капсу- |
|
|
лооб- |
Характер роста на |
|
ра- |
||
среде Китта-Тароцци |
||
зова- |
||
|
||
ние |
|
Через 16—20 ч. —
—слабое равномерное
помутнение
Через 16—24 ч. — равномерное помутнение с газом, за
— тем наступает просветление с хлопьевидным
осадком
Через 16—24 ч. — сплошное помутнение со слабым
— газообразованием, затем наступает просветление с хлопьевидным
осадком

Вид возбудителя
Cl. Perfringers *(возбудитель энтеротокси- мии овец – типы A, C, D)
Cl. histolyticum
Cl. sordelli
Краткая
характеристика в мазках из материала
Спорообразующая, толстая палочка
с
закругленными
концами
Спорообразующая, мелкая палочка
с закруг- ленными концами; располагается
одиночно, парами или цепочками
Спорообразующая,
полиморфная палочка с закругленными краями; располагается, одиночно, но 2 —3 вместе, редко цепочками
Окраска по Граму
Положитель- ная, о старой культуре отрицательная
Положительная
Положительная
Подв
.
—
+
+
Форма и расположен Капс.
ие спор
Овальная; централь- ное или + субтермина
льное
Овальная; централь- ное или
субтермина — льное (форма
игольного
ушка)
Овальная; централь- ное или — субтермина
льное
Характер роста на среде Кита-
Тароцци
Через 5—6 ч. — равномерное помутнение с
бурным
газообразованием; через 48 ч. — просветление с обильным осадком
Через 5—6 ч. — равномерное
помутнение, без газообразования с последующим просветлением и образованием осадка
Через 24 ч. — интенсивное
помутнение и газ; в старых культурах дает осадок, который тянется в виде слизистых нитей

Вид возбудителя
Возбудитель
столбняка: Cl. tetani
Возбудитель
ботулизма: Cl. Botulinum (типы A, B, C,D, E И F)
Возбудитель
некробактер
иоза:
Bact. necrophorum
Краткая
характеристика в мазках из материала
Спорообразующая крупная тонкая
палочка с закругленными концами; располагается одиночно или группами (по 2 —3 клетки), из жидких сред — длинные нити
Спорообразующая, толстая палочка
с
закругленными
краями;
располагается
одиночно, парами или в виде коротких цепочек
Неспорообразующая,
полиморфная палочка или длинные зернясто окрашенные нити
Окраска по |
Подв |
Граму |
. |
Положительная, в старой
культуре + отрицатель
ная
Положительная; в старой
культуре + отрицатель
ная
Отрицательная —
Форма и |
Характер роста на |
расположен Капс. |
среде Кита- |
ие спор |
Тароцци |
|
|
Через 24—36 ч. — |
|
Круглая; |
|
неинтенсивное |
|
|
помутнение, |
||
концевое в |
|
||
|
через 48—72 ч. — |
||
виде |
— |
||
просветление с |
|||
барабанной |
|
||
|
рыхлым |
||
палочки |
|
||
|
осадком; запах |
||
|
|
||
|
|
жженого рога |
|
|
Через 24—36 ч. — |
|
Овальная; |
|
помутнение, |
|
субтермина |
|
слабое |
|
льное, реже |
|
газообразование; |
|
централь- |
— |
затем — |
|
ное в виде |
|
просветление; |
|
теннисной |
|
запах |
|
ракетки |
|
прогорклого |
|
|
|
масла |
|
|
|
Через 24—48 ч. — |
|
|
|
помутнение, |
|
|
|
слабое |
|
Не образует |
— |
газообразование; |
|
через 5—8 сут. — |
|||
|
|
||
|
|
просветление с |
|
|
|
крошковатым |
|
|
|
осадком |

Микобактерии — это микроорганизмы, обладающие способностью при культивировании на питательных средах образовывать длинные нити со вздутиями на концах, и виде колбочек. Под микроскопом они похожи на мицелий плесневых грибов. Среди микобактерий различают патогенные виды и сапрофиты. Последние широко распространены в природе.
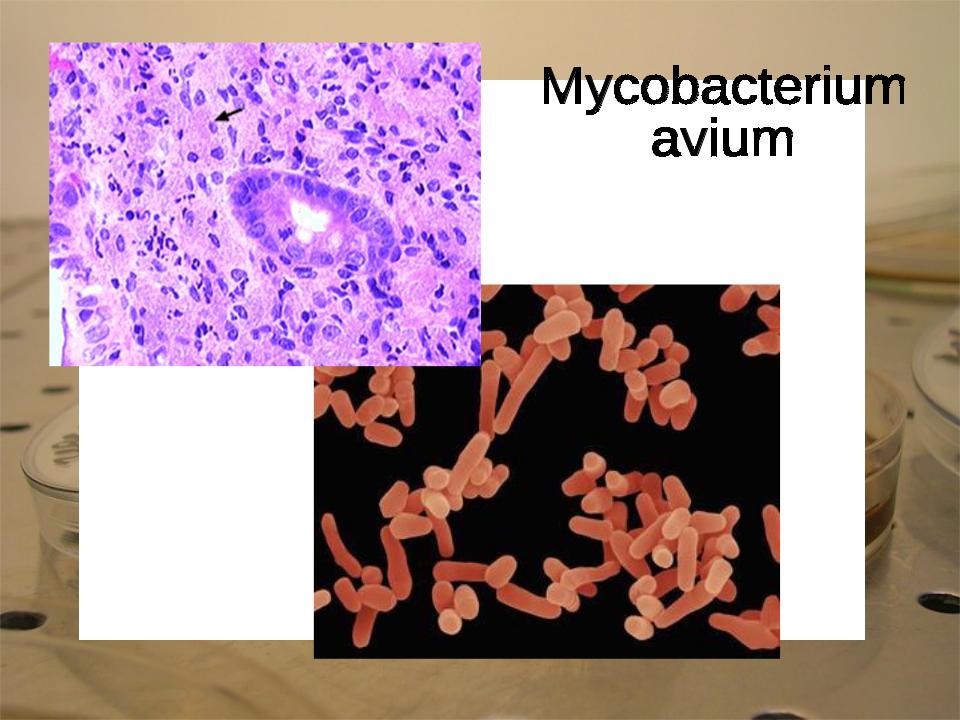
Патогенные микобактерии — возбудители ряда инфекционных заболеваний животных и человека. Они вызывают туберкулез многих видов сельскохозяйственных животных, а также паратуберкулез крупного рогатого скота.
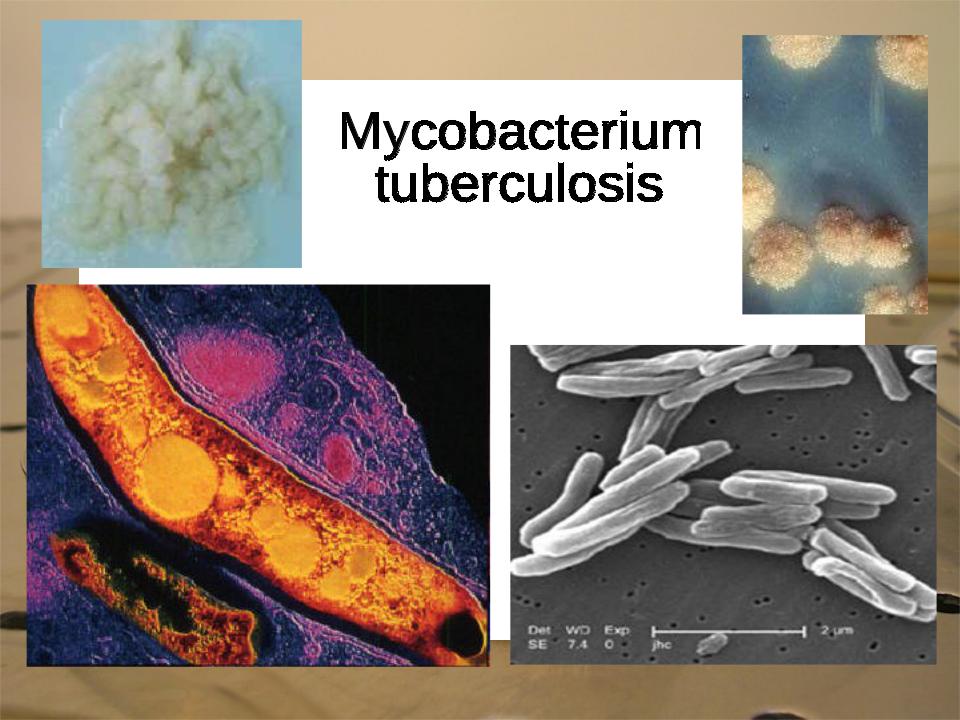
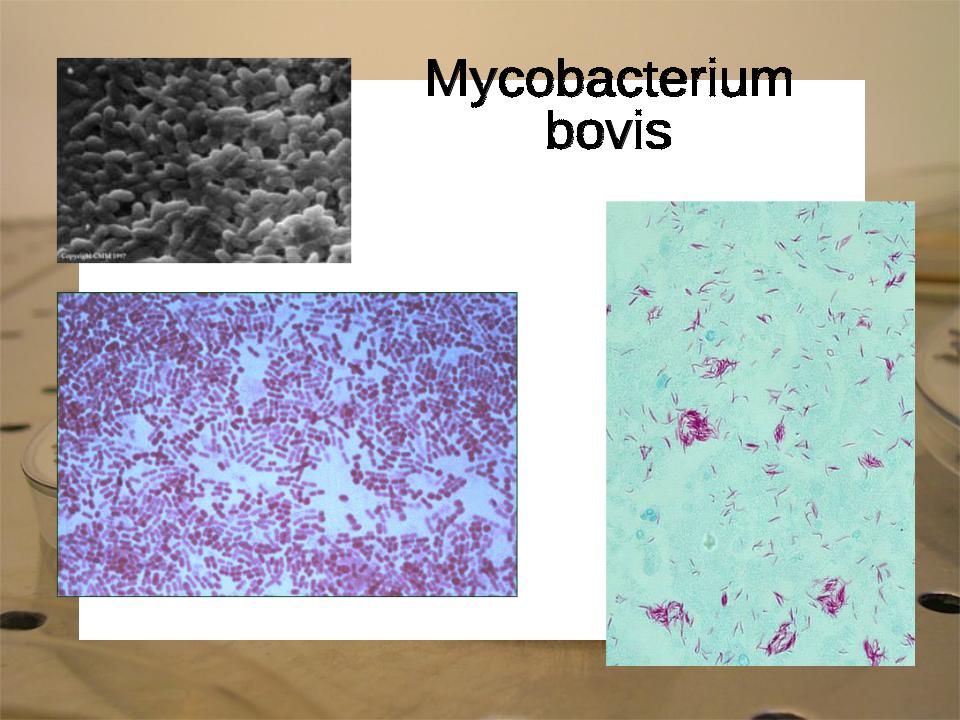
Обнаружение возбудителя туберкулеза. Существует пять видов микобактерий туберкулеза: М. tuberculosis, М. bovis, M. avium, M. murium,
M. poykilothermorum. Сущность метода выявления этих микроорганизмов и их видовая типизация заключается в определении по мор фологии, скорости и характеру роста на питательных средах, по патогенности и другим свойствам. Микобактерии туберкулеза — тонкие, прямые или слегка изогнутые палочки с закругленными краями. Располагаются изолированно или группами. Спор и капсул не образуют, неподвижны, кислото- и спиртоустойчивы.
Ввиду гидрофобности оболочек грамокраску микобактерий проводят модифицированным методом (по Грам — Мухе). Вначале мазок окрашивают карболовым метилвиолетом с подогреванием до появления паров, затем Краску сливают, а мазок обрабатывают раствором Люголя с последующим обесцвечиванием поочередно 5%-ной азотной кислотой, 3 %-ной соляной кислотой и смесью ацетона и алкоголя. Дополнительно препарат окрашивают сафранином или разведенным фуксином. При микроскопии на красном фоне видны фиолетовые микобактерии.

Влаборатории из присланного материала (кусочки печени, селезенки, легких
илимфоузлов) делают мазки, фиксируют их на пламени и окрашивают по Цилю— Нильсену. Микобактерии можно обнаружить не в каждом случае, поэтому просматривают 100—200 полей зрения. Для бактериоскопического исследования применяют люминесцентный анализ: простое флуорохромирование или иммунофлуоресцентный метод.
Если в исследуемом материале туберкулезных микобактерий слишком мало, то прибегают к обогащению — центрифугированию или флотации. Для этого материал измельчают, растирают в ступке, заливают 1 %-ным раствором едкого натра, размешивают и переносят в колбу, которую встряхивают 10—15 мин. Затем содержимое центрифугируют 10 мин., надосадочную жидкость сливают, осадок нейтрализуют кислотой и из него делают мазки.
Метод флотации основан на адсорбции углеводородами (ксилолом, бензином, лигроином) микобактерий туберкулеза и всплывании последних вместе с ними. Этот метод применяют при исследовании молока и мокроты, реже — бронхиальной слизи, экссудата, суспензий из растертых органов и тканей.
Питательные среды для культивирования микобактерий делят на: глицериносодержащие (простые) и элективные (белковые и безбелковые). К первым относят глицериновый мясо-пептонный бульон и агар, а также глицериновый картофель. Ко вторым относят среды: Петраньяни, Гельберга, Левенштейна — Йенсена, а так же безбелковые среды: Сотона, Моделя и др.

Для получения культур микобактерий туберкулеза материал перед посевом обрабатывают по методу Л, П. Аликаевой или Гона. По методу А. П. Аликаевой, материал разрезают на кусочки размером 0,5 см2, помещают
в ступку и заливают 3—6 %-ным раствором серной кислоты на 10—20 мин. Затем кусочки тканей промывают 5 мин физиологическим раствором и растирают. Из полученной суспензии делают посевы и готовят мазки.
На жидких питательных средах с глицерином рост микобактерий туберкулеза проявляется в виде пленки только через 30—30 сут., а иногда и позже.
На плотных питательных средах они образуют вначале едва заметные микроколонии, которые затем увеличиваются и приобретают различные размеры. Они могут быть мелкими, крупными, блестящими или матовыми, гладкими или шероховатыми. Располагаются колонии единично, однако может быть и сплошной рост.
Для биологического исследования используют тот же материал, который был приготовлен для посева на питательные среды, а серную кислоту, находящуюся в нем, необходимо нейтрализовать стерильным 10 %-ным раствором двууглекислой соды. Заражают кроликов, морских свинок, а при необходимости и кур. Биопроба наряду с бактериоскопическим, культуральным и биохимическим методами позволяет определить вид микобактерий туберкулеза.