
- •Содержание
- •Введение
- •Раздел 1. Геометрическая и структурная кристаллографии
- •Тема 1.1. Основные характеристики
- •Кристаллического состояния вещества
- •Тема 1.2. Кристаллографические индексы узлов, узловых рядов и узловых плоскостей
- •Тема 1.3. Кристаллографические проекции
- •Тема 1.4. Элементы симметрии кристаллических многогранников
- •Тема 1.5. Классы симметрии, сингонии и категории кристаллов
- •Классов симметрии кристаллов
- •Тема 1.6. Специфические элементы симметрии кристаллических структур
- •Тема 1.7. Трансляция и системы трансляций (решетки бравэ)
- •Тема 1.8. Условия выбора и характеристики элементарных ячеек
- •Тема 1.10. Пространственные группы симметрии и правильные системы точек
- •Раздел 2. Элементы кристаллохимии и кристаллофизики
- •Тема 2.1.Типы взаимодействия частиц
- •В кристаллах
- •Тема 2.2. Координационные числа и координационные многогранники
- •Тема 2.3. Плотноупакованные слои и многослойные плотнейшие упаковки
- •Тема 2.4. Пустоты в плотнейших упаковках
- •Тема 2.5. Основные структурные типы металлических элементов
- •Тема 2.6. Изоморфизм и полиморфизм
- •Тема 2.7. Структурные типы алмаза и графита
- •Тема 2.8. Симметрия и анизотропия физических свойств кристаллов
- •Вопросы для самопроверки
- •Раздел 3. Идеальный кристалл и дефекты строения реальных кристаллических материалов. Точечные дефекты
- •Тема 3.1. Понятие об идеальном кристалле
- •Тема 3.2. Точечные, линейные, поверхностные и объемные дефекты кристаллического строения. Виды точечных дефектов.
- •Тема 3.3. Энергия образования и равновесная концентрация вакансий и межузельных атомов. Миграция точечных дефектов
- •Вакансия 1,5 ± 0,5 1,0 ± 0,5
- •Тема 3.4. Источники и стоки точечных дефектов
- •Тема 3.5. Комплексы точечных дефектов
- •Вопросы для самопроверки
- •Раздел 4. Дислокации, их движение и упругие свойства
- •Тема 4.1. Теоретическая и реальная прочность
- •Кристаллов
- •Тема 4.2. Основные типы дислокаций и их движение
- •Тема 4.3. Контур и вектор бюргерса дислокаций
- •Тема 4.4. Плотность дислокаций
- •Раздел 5. Дислокации и дефекты упаковки в типичных металлических структурах тема 5.1. Полные и частичные дислокации
- •Тема 5.2. Дислокационные реакции
- •Тема 5.3. Плотнейшие упаковки и дефекты упаковки
- •Тема 5.4. Стандартный тетраэдр и дислокационные реакции в гцк-решётке
- •Дислокации в упорядоченных сплавах. В сплавах с дальним порядком (сверхструктурой) атомы разного сорта закономерно чередуются в определённых кристаллографических плоскостях и направлениях.
- •Раздел 6. Пересечение дислокаций и их взаимодействие с точечными дефектами
- •Тема 6.1. Пересечение единичных краевых, краевой и винтовой и винтовых дислокаций
- •Пересечение единичных краевой и винтовой дислокаций. Пусть в плоскости, перпендикулярной линии винтовой дислокации ав, движется краевая дислокация dс (рис. 6.3).
- •Пересечение единичных винтовых дислокаций. Если обе дислокации ав и сd винтовые, то при их пересечении также образуются пороги с краевой ориентацией (рис. 6.4).
- •Тема 6.2. Пороги на дислокациях. Движение дислокаций с порогами
- •Пересечение расщепленных дислокаций. При встрече расщепленных дислокаций их головные частичные дислокации из-за упругого взаимодействия прогибаются в сторону хвостовых частичных дислокаций.
- •Тема 6.3. Взаимодействие дислокаций с вакансиями, межузельными и примесными атомами. Атмосферы коттрелла, снука и сузуки.
- •Атмосферы Коттрелла. Поля напряжений вокруг дислокации и вокруг примесного атома упруго взаимодействуют.
- •Раздел 7. Дислокационные системы и границы раздела
- •Тема 7.1. Образование дислокаций при
- •Кристаллизации и последующем охлаждении металлов. Дислокационные сетки и сплетения.
- •7.2. Размножение дислокаций при пластической деформации
- •Тема 7.3. Границы наклона и кручения, границы малоугловые и большеугловые
- •Раздел 8. Строение твердых фаз и диффузия в металлических сплавах
- •Тема 8.1. Система, сплав, компонент, фаза, структура
- •Тема 8.2. Механические смеси, химические соединения, твердые растворы
- •Тема 8.3. Возможные механизмы диффузии, уравнения диффузии. Основные факторы, влияющие на коэффициент диффузии
- •Вопросы для самопроверки
- •Раздел 9. Кристаллизация расплавов
- •Тема 9.1. Особенности строения жидких сплавов
- •Тема 9.2. Термодинамика, механизм и кинетика процесса кристаллизации
- •9.3. Влияние степени переохлаждения, примесей и модификаторов на процесс кристаллизации, размер и форму кристаллов затвердевшего сплава
- •Тема 9.4. Строение реальных металлических отливок
- •Тема 9.5. Направленная кристаллизация. Выращивание монокристаллов из расплавов
- •Раздел 10. Наклеп и рекристаллизация
- •Тема 10.1. Упругая и пластическая деформация металлов
- •Тема 10.2. Механизмы пластической деформации
- •Тема 10.3. Деформационное упрочнение и его причины
- •Тема 10.4. Понятие о сверхпластичности металлов
- •Тема 10.5. Процессы, происходящие при отжиге деформированных металлов. Разновидности рекристаллизации
- •Тема 10.7. Горячая и холодная пластическая деформация
- •14.В чем различие между холодной и горячей пластической деформацией? Опишите особенности обоих видов деформации.
- •Раздел 11. Диаграммы состояния (фазового равновесия) двойных и тройных систем
- •Тема 11.1. Правило фаз
- •Тема 11.2. Важнейшие типы диаграмм состояния двойных сплавов
- •Раздел 12. Структуры, формирующиеся при неравновесной кристаллизации расплавов
- •Тема 12.1. Кристаллизация сплавов в неравновесных условиях
- •Тема 12.2. Аморфизация металлических сплавов
- •Раздел 13. Превращения в металлических сплавах в твердом состоянии
- •Тема 13.1. Основы термодинамики и кинетики полиморфных превращений
- •Тема 13.2.Образование квазиэвтектоида и мартенситных фаз в сплавах с полиморфными превращениями
- •Тема 13.3. Образование пересыщенных твердых растворов и их распад
- •Раздел 14. Диаграммы состояния и структура сплавов железа с углеродом
- •Тема 14.1. Компоненты и фазы в сплавах железа с углеродом в равновесном состоянии
- •Тема 14.2. Кристаллизация и превращения в твердом состоянии в железоуглеродистых сплавах различного состава
- •Раздел 15. Строение неметаллических материалов
- •Тема 15.1. Строение, стеклообразное состояние и старение полимеров
- •Тема 15.2. Строение и кристаллизация стекол
- •Тема 15.3. Строение керамических материалов
- •Заключение
- •Библиографический список
Тема 2.5. Основные структурные типы металлических элементов
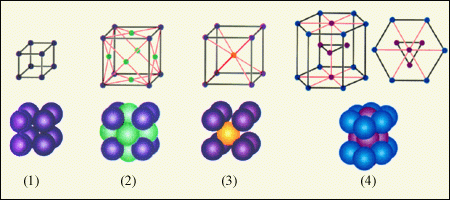
Одними из наиболее известных являются структурные типы Cu, Mg и -Fe, взаимное размещение атомов в элементарных ячейках которых эквивалентно соответственно ГЦК-, ОЦК- и ГПУ-решеткам (рис. 2.3, а, б, в).
б в г
Рис. 2.3. Элементарные ячейки: а – гранецентрированная кубическая решетка; б – объемно-центрированная кубическая решетка; в – гексагональная плотноупакованная решетка
При обычных условиях относятся к структурному типу меди (имеют ГЦК-решетку) кристаллы Al, Ni, Ag, Pt, Au. Например, при обычных условиях медь и алюминий имеют ГЦК-решетку соответственно с а = 3,615 и 4,05 А, где а - параметр элементарной ячейки, изображенной на рис. 2.3, а, выраженный в ангстремах (1А = 10- 8 см). В тех же условиях железо образует ОЦК-решетку с а = 2,866 А (так называемая -модификация железа, устойчивая вплоть до 769С, рис. 2.3, б ), а магний - ГПУ (рис. 2.3, в) с а = 3,21 А, с = 5,2.
Тема 2.6. Изоморфизм и полиморфизм
Многие кристаллические вещества имеют одинаковые структуры. В то же время одно и то же вещество может образовывать разные кристаллические структуры. Это находит отражение в явлениях изоморфизма и полиморфизма.
Изоморфизм заключается в способности атомов, ионов или молекул замещать друг друга в кристаллических структурах. Этот термин (от греческих «изос» – равный и «морфе» – форма) был сформулирован Э. Мичерлихом в 1821 г. таким образом: «Одинаковые количества атомов, соединенные одинаковым способом, дают одинаковые кристаллические формы; при этом кристаллическая форма не зависит от химической природы атомов, а определяется только их числом и относительным положением».
При совместной кристаллизации веществ, склонных к изоморфизму (изоморфных веществ), образуются смешанные кристаллы (изоморфные смеси). Изоморфизм широко распространен в природе. Большинство минералов представляет собой изоморфные смеси сложного переменного состава. Например, в минерале сфалерите ZnS до 20% атомов цинка могут быть замещены атомами железа (при этом ZnS и FeS имеют разные кристаллические структуры).
Полиморфизм – способность твердых веществ в зависимости от давления и температуры иметь разную кристаллическую структуру и свойства при одном и том же химическом составе. Это слово происходит от греческого «полиморфос» – многообразный. Явление полиморфизма было открыто М. Клапротом, который в 1798 г. обнаружил, что два разных минерала – кальцит и арагонит – имеют одинаковый химический состав СаСО3.
Примером полиморфного металла является железо, обладающее сложным полиморфизмом. Так при давлении, равном 1 атм, в интервале 917-1394 С существует -Fe с ГЦК-решеткой и а = 3,656 А, в интервале от 1394 С до температуры плавления 1535 С - -Fe с ОЦК-решеткой и а = 2,930 А, а при высоких давлениях существует и -Fe с ГПУ-решеткой.
Тема 2.7. Структурные типы алмаза и графита
Углерод обладает полиморфизмом и существует в двух модификациях: графита и алмаза. При нормальных условиях стабилен графит, алмаз представляет собой его метастабильную модификацию. При высоких давлениях и температурах стабильным становится алмаз (это используют при получении синтетических алмазов).
Структура алмаза изображена на рис. 2.4, а. Необходимо отметить, что расстояние С – С равно 1,54 А, и их тетраэдрическое окружение является аналогичным для всех предельных алифатических и алициклических соединений. Структура алмаза характеризуется координационным числом 4. В структуре алмаза ближайшие соседние атомы будут располагаться по вершинам тетраэдра, т. е. координационный многогранник для нее будет тетраэдром.
а
б
Рис.
2.4.
Кристаллическая структура алмаза (а)
и графита (б)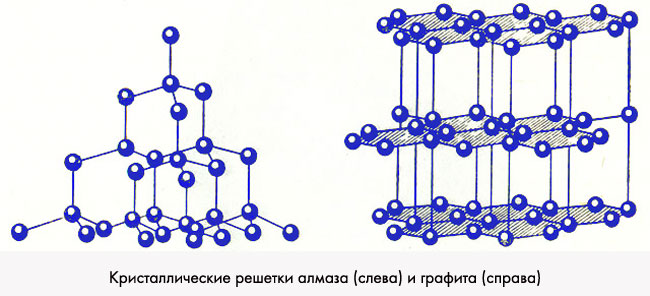 труктура
графита показана на рис. 2.4, б. Она состоит
из отдельных слоев. Атомы углерода в
слое расположены по вершинам правильных
шестиугольников. Взаимная ориентировка
слоев такова, что три вершины шестиугольника
одного слоя располагаются над центром
шестиугольника следующего слоя. Таким
образом, полная вертикальная трансляция
равна удвоенному расстоянию между
слоями.
труктура
графита показана на рис. 2.4, б. Она состоит
из отдельных слоев. Атомы углерода в
слое расположены по вершинам правильных
шестиугольников. Взаимная ориентировка
слоев такова, что три вершины шестиугольника
одного слоя располагаются над центром
шестиугольника следующего слоя. Таким
образом, полная вертикальная трансляция
равна удвоенному расстоянию между
слоями.
Структуры, подобные графиту, в которых расстояния между атомами в одном слое значительно меньше расстояния между слоями, называются слоистыми структурами. У графита эти расстояния 1,42 и 3,39А. По аналогии со структурой алмаза структура графита является прототипом ароматических соединений.
Структура графита служит примером структуры с координационным числом 3. Каждый атом располагается в центре равностороннего треугольника.
