
- •Передмова
- •Вступ до органічної хімії
- •1.1. Предмет органічної хімії
- •1.2. Короткий огляд історії розвитку органічної хімії
- •Глава 1 6
- •1.3. Розвиток теоретичних уявлень про будову органічних сполук
- •Глава 1
- •1.4. Способи зображення органічних молекул
- •Глава 1
- •2.1. Класифікація органічних сполук
- •Глава 2
- •2.2. Номенклатура органічних сполук
- •Глава 2
- •Глава 2
- •ХїмГчний зв'язок
- •3.1. Типи хімічних зв'язків
- •3.2. Хімічний зв'язок в органічних сполуках
- •3.2.1. Гібридизація атомних орбіталей
- •3.2.2. Ковалентні о- і я-зв'язки
- •3.2.3. Основні характеристики ковалентних зв'язків
- •4.1. Індуктивний ефект
- •Глава 40
- •4.2. Мезомерний ефект (ефект спряження)*
- •Глава 4
- •Глава 4
- •4.4. Надспряження (гіперкон'югація)
- •Глава 4
- •Класифікація ізомерії ізомерія
- •48 Глава 5
- •5.2. Просторова ізомерія (стереоізомерія)
- •Глава 5
- •5.3. Способи зображення просторової будови
- •Глава 5
- •6.1. Кислотність і основність за теорією бренстеда
- •Глава 6
- •6.2. Типи органічних кислот і основ
- •Глава 6
- •6.3. Кислоти і основи льюїса
- •7.1. Поняття про типи механізмів реакцій
- •Глава 7
- •7.2. Поняття про типи органічних реакцій
- •Глава 7
- •Вуглеводні
- •8.1. Електронна та просторова будова алканів
- •8.2. Номенклатура
- •8 .3. Ізомерія
- •8.4. Способи добування
- •8.4.1. Природні джерела
- •8.4.2. Синтетичні методи добування
- •8.5. Фізичні властивості
- •8.6. Хімічні властивості
- •8.6.1. Реакції радикального заміщення (5*)
- •76 Вуглеводні. Глава 8
- •8.6.2. Крекінг
- •8.7. Окремі представники. Застосування
- •1. Напишіть структурні формули наведених вуглеводнів і назвіть їх за раціональною номенклатурою:
- •2. Напишіть структурні формули таких вуглеводнів і назвіть їх за но менклатурою шрас:
- •Ц иклоалкани
- •9.1. Класифікація та номенклатура
- •9.2. Ізомерія
- •9.3. Способи добування. Фізичні властивості
- •9.4. Будова циклоалканів
- •9.5. Хімічні властивості
- •9.6. Окремі представники. Застосування
- •4 Органічна хімія
- •10.1. Номенклатура
- •Перші члени гомологічного ряду алкенів
- •100 Ненасичені вуглеводні. Глава іо
- •10.2. Ізомерія
- •10.3. Електронна і просторова будова алкенів
- •10.4. Способи добування
- •10.5. Фізичні властивості
- •10.6. Хімічні властивості
- •109 Ненасичені вуглеводні. Глава 10 108
- •1 0.6.1. Реакції електрофільного приєднання (ае)
- •10.6.2. Реакції відновлення та окиснення
- •10.6.3. Полімеризація алкенів
- •10.6.4. Алільне галогенування алкенів
- •118 Ненасичені вуглеводні. Глава ю
- •10.7. Окремі представники. Застосування. Ідентифікація
- •0 Контрольні питання та вправи
- •Алкадієни
- •11.2. Будова алкадієнів
- •11.1. Номенклатура
- •11.3. Алкадієни зі спряженими зв'язками 11.3.1. Способи добування
- •11.3.2. Хімічні властивості
- •11.3.3. Натуральний і синтетичний каучук
- •11.4 Окремі представники. Застосування
- •12.1. Номенклатура та ізомерія
- •12.2. Електронна та просторова будова молекул алкінів
- •12.3. Способи добування
- •138 Ненасичені вуглеводні. Глава т2
- •12.4. Фізичні властивості
- •12.5. Хімічні властивості
- •12.5.1. Реакції електрофільного приєднання (ае)
- •12.5.2. Реакції заміщення
- •12.6. Окремі представники. Застосування
- •Одноядерні арени
- •13.1. Будова бензену. Ароматичність
- •13.2. Номенклатура та ізомерія
- •13.3. Способи добування 13.3.1. Природні джерела
- •13.3.2. Синтетичні методи добування
- •13.4. Фізичні властивості
- •13.5. Хімічні властивості
- •13.5.1. Реакції електрофільного заміщення (5£)
- •0/1Ноядєрні аРени
- •13.5.2. Реакції приєднання
- •13.5.3. Реакції окиснення
- •13.5.4. Галогенування гомологів бензену з участю бокового ланцюга
- •165 0ДнояДерн[арени
- •13.6. Вплив замісників у бензеновому кільці на напрямок та швидкість реакцій
- •Електрофільного заміщення
- •13.7. Орієнтація в дизаміщеному бензені
- •1 3.8. Окремі представники. Застосування
- •13.9. Представники багатоядерних аренів
- •13.9.1. Нафтален
- •13.9.2. Антрацен
- •14.1. Природний та попутний нафтовий гази
- •Глава 14
- •14.2. Нафта. Нафтопродукти
- •14.3. Коксування вугілля
- •Глава 1і0у глава Глава 14 186 !
- •15.1. Класифікація та номенклатура
- •15.2. Ароматичність гетероциклів
- •Глава 15
- •15.3. Кислотно-осНбВні властивості гетероциклів
- •15.4. П'ятичленні гетероциклічні сполуки з одним гетероатомом
- •15.4.1. Способи добування
- •15.4.2. Фізичні властивості
- •15.4.3. Хімічні властивості
- •Глава 15
- •15.4.4. Найважливіші похідні піролу
- •Глава 15
- •15.5. Шестичленні гетероциклічні сполуки з одним гетероатомом
- •Глава 15
- •Глава 15
- •В. Реакції відновлення і окиснення
- •15.6. П'яти-1 шестичленні гетероцикли з двома гетероатомами
- •208 Глава 15
- •15.7. Представники конденсованих систем гетероциклів
- •16.1. Одноатомні спирти
- •16.1.1. Номенклатура
- •Глава 16
- •16.1.2. Ізомерія
- •16.1.3. Фізичні властивості
- •Глава 1
- •16.1.4. Способи добування
- •16.1.5. Хімічні властивості
- •16.1.6. Ідентифікація спиртів
- •16.1.7. Окремі представники
- •230 Глава 16
- •16.2.1. Способи добування дво- і триатомних спиртів
- •16.2.2. Фізичні властивості
- •16.2.3. Хімічні властивості
- •16.2.4. Окремі представники
- •16.3.2. Способи добування
- •16.3. Одноатомні феноли 16.3.1. Номенклатура та ізомерія
- •16.3.4. Хімічні властивості
- •16.3.3. Фізичні властивості
- •249 Гідроксильні похідні вуглеводнів
- •В. Реакції відновлення і окиснення
- •255 Гідроксильні похідні вуглеводнів
- •17.1. Номенклатура та ізомерія
- •17.2. Способи добування
- •17.3. Фізичні властивості
- •263 Цясимені альдегіди і кетони
- •269 Насичені альдегіди і кетони
- •271 ИаСйчені альдегіди і кетони
- •17.5. Окремі представники
- •Монокарбонові кислоти
- •18.1. Насичені монокарбонові кислоти
- •18.1.1. Номенклатура та ізомерія
- •18.1.3. Фізичні властивості
- •18.1.4. Хімічні властивості
- •А. Кислотні властивості
- •Г. Окиснення та відновлення
- •18.1.5. Окремі представники
- •18.2. Ненасичені монокарбонові кислоти
- •18.2.1. Номенклатура та ізомерія
- •18.2.2. Способи добування
- •18.2.4. Хімічні властивості
- •18.2.3. Фізичні властивості
- •18.2.5. Окремі представники
- •299 Монокарбонові кислоти
- •18.3. Ароматичні монокарбонові кислоти
- •18.3.1. Способи добування
- •18.3.2. Фізичні властивості
- •18.3.3. Хімічні властивості
- •18.3.4. Окремі представники. Ідентифікація
- •303 Монокарбонові кислоти
- •18.4.1. Номенклатура та ізомерія
- •Назви деяких дикарбонових кислот
- •18.4.2. Способи добування
- •18.4.3. Фізичні властивості
- •18.4.4. Хімічні властивості
- •18.4.5. Окремі представники
- •309 Мриокар6онові кислоти
- •18.5. Ароматичні дикарбонові кислоти
- •310 Карбонові кислоти. Глава и
- •313 Монокарбонові кислоти
- •19.1.2. Способи добування
- •19.1. Галогенангідриди карбонових кислот (ацилгалогеніди)
- •19.1.1. Номенклатура
- •19.1.3. Фізичні властивості
- •19.1.4. Хімічні властивості
- •19.1.5. Окремі представники
- •19.2. Ангідриди карбонових кислот
- •19.2.1. Номенклатура
- •19.2.2. Способи добування
- •19.2.3. Фізичні властивості
- •19.2.4. Хімічні властивості
- •19.2.5. Окремі представники
- •19.3. Естери карбонових кислот
- •19.3.1. Номенклатура
- •19.3.3. Фізичні властивості
- •19.3.4. Хімічні властивості
- •19.3.5. Окремі представники
- •19.4. Жири
- •19.4.1. Номенклатура та ізомерія
- •19.4.2. Способи добування
- •19.4.3. Фізичні властивості
- •19.4.4. Хімічні властивості
- •19.4.5. Воски. Твіни
- •19.5. Аміди карбонових кислот
- •19.5.1. Номенклатура
- •Ацетамщ,
- •19.5.2. Способи добування
- •19.5.3. Фізичні властивості
- •19.5.4. Хімічні властивості
- •19.5.5. Окремі представники
- •19.6. Нітрили (ціаніди)
- •19.6.1. Номенклатура
- •19.6.2. Способи добування
- •19.6.3. Хімічні властивості
- •19.6.4. Окремі представники
- •20.1. Галогенокарбонові кислоти
- •20.1.1. Номенклатура
- •20.1.2. Способи добування
- •20.1.3. Фізичні та хімічні властивості
- •20.2. Гідроксикислоти
- •20.2.2. Оптична ізомерія
- •20.2.3. Аліфатичні пдроксикислоти
- •359 Гетерофункціональні карбонові кислоти
- •Фізичні та хімічні властивості
- •361 Гетерофункціональні карбонові кислоти
- •20.3. Амінокислоти
- •II Амінокислотами називаються похідні карбонових кислот, у вуглеводневому радикалі яких один або кілька атомів Гідрогену замінені аміногрупою.
- •20.3.1. Номенклатура та ізомерія
- •20.3.2. Способи добування
- •20.3.3. Фізичні та хімічні властивості
- •367 Гетерофункціональні карбонові кислоти
- •20.3.4. Окремі представники
- •0 Контрольні питання та вправи
- •21.1. Номенклатура та ізомерія
- •Глава 21
- •Глава 21
- •21.2.1. Способи добування
- •21.2.2. Фізичні властивості. Просторова будова
- •21.2.3. Хімічні властивості
- •Глава 21 378 — —
- •21.3. Ариламіни
- •Глава 21
- •21.3.2. Фізичні та хімічні властивості
- •А. Реакції за участю атома Нітрогену
- •Глава 21
- •Глава 21
- •21.4. Окремі представники. Застосування
- •В. Окислення ариламінів
- •Глава 21
- •Глава 21
- •22.1. Моносахариди
- •22.1.1. Класифікація та номенклатура
- •Глава 22
- •22.1.2. Стереоізомерія
- •Глава 22
- •22.1.3. Будова моносахаридів
- •Глава 22
- •Глава 22 402
- •Глава 22
- •22.1.4. Способи добування
- •22.1.5. Фізичні властивості
- •22.1.6. Хімічні властивості
- •Глава 22
- •Глава 22
- •Б. Реакції за участю циклічних форм
- •Глава 22
- •22.1.7. Окремі представники
- •Глава 22 412
- •Глава 22
- •22.2. Дисахариди
- •22.2.1. Відновні дисахариди
- •Глава 22
- •22.2.2. Невідновні дисахариди
- •14 Органічна хімія
- •Глава 22 418
- •22.3. Полісахариди
- •Глава 22 н он н он н он н он
- •Глава 22 422
- •Глава 22 424
- •425 Вуглеводи
- •Глава 23
- •Глава 23
- •23.1.1. Стереоізомерія
- •23.1.2. Фізичні властивості
- •23.1.3. Способи добування
- •23.1.4. Хімічні властивості
- •Глава 23
- •23.2. Будова пептидів і білків
- •Глава 23
- •23.3. Синтез пептидів та їх властивості
- •440 Глава 23
- •23.4. Функції білків в організмі
- •Нуклеїнові кислоти
- •24.1. Будова нуклеїнових кислот
- •Глава 24
- •Глава 24
- •24.2. Рибонуклеїнові (рнк) і дезоксирибонуклеїнові (днк) кислоти
- •Глава 24
- •Глава 24
- •Глава 25
- •Неомилювані ліпіди
- •Глава 25
- •Глава 9. Циклоалкани 86
- •Глава 10. Алкени 98
- •Глава 11. Алкадієни 122
- •Глава 12. Алкіни 135
- •Глава 13. Одноядерні арени 147
- •Глава 14. Природні джерела вуглеводнів 179
- •Глава 15. Гетероциклічні сполуки 187
- •Глава 16. Гідроксильні похідні вуглеводнів 212
- •Глава 17. Насичені альдегіди і кетони 256
- •Глава 18. Монокарбонові кислоти 280
- •Глава 19. Функціональні похідні карбонових кислот 314
- •Глава 20. Гетерофункціональні карбонові кислоти 346
- •Глава 21. Аміни 371
- •Глава 22. Вуглеводи 394 о
- •Глава 23. Білки 426 •
- •Глава 24. Нуклеїнові кислоти 444
- •Глава 25. Ліпіди 453
- •Органічна хімія
- •61002, Харків, вул. Пушкінська, 53.
- •61022, Харків, пл. Свободи, 5, Держпром, 6-й під'їзд, 6-й поверх.
- •61012, Харків, вул. Енгельса, 11.
19.4.1. Номенклатура та ізомерія
За систематичною номенклатурою ШРАС родоначальною структурою в молекулі жиру вважають гліцерин. Ацильні залишки жирних кислот перелічують в алфавітному порядку на початку назви, при необхідності вживають множні префікси ди- (ді-) та три-. Тривіальні назви жирів утворюють від назв відповідних жирних кислот шляхом заміни частини назви кислоти -инова (-їнова) на суфікс -ин (-Ги).
н2с—о-
Н2С-
т
"СО (_^27Г135
не—о—со—с17н35
н2с—о—со—с17н35
тристеароїлгліцерин, тристеарин
не—о—со—спн33
н2с—о—со—с17н35
2-олеоїл-1,3-дистеароїлгліцерин, 2-олеодистеарин
н2с—о—со—син23 не о со с15н31 н2с—о—со—с17н35
І-лауроїл-2-пальмітоїл-
3-стеароїлгліцерин,
1-лауро-2-пальмітостеарин
функціональні похідні карбонових кислот
Ізомерія жирів пов'язана здебільшого з різним взаємним розміщенням ацильних залишків у структурі триацилгліцерину (структурна ізомерія).
19.4.2. Способи добування
Для синтезу триацилгліцеринів придатна більшість реакцій ацилування спиртів (естерифікація, взаємодія натрій гліцератів з хлорангідридами кислот та інші), проте синтетичні способи добування жирів з гліцерину не мають промислового значення через доступність різноманітної природної сировини. До основних методів виділення жирів та масел із здрібнених тканин рослин і тварин належать: витоплювання, пресування та екстракція органічними розчинниками.
19.4.3. Фізичні властивості
Фізичні властивості жирів залежать здебільшого від будови жирних кислот, які утворюють їх молекули. Так, температури плавлення жирів, що містять залишки ненасичених кислот, значно нижчі, ніж у жирів з тією ж самою кількістю атомів Карбону насичених кислот. Зі збільшенням довжини карбонових ланцюгів жирних кислот температури плавлення жирів підвищуються. Оскільки природні жири є сумішами триацилгліцеринів, вони не мають чітких температур плавлення. Більшість жирів розтоплюється при 22—55 °С.
Жири легко розчинні у вуглеводнях та їх хлорпохідних, етерах, малорозчинні в етиловому спирті, нерозчинні у воді, але в присутності поверхнево-активних речовин (ПАР), які ще називають емульгаторами, жири утворюють високодисперсні гетерогенні системи — емульсії. Зокрема, емульгуюча дія білків надає стабільності емульсії жиру у воді, що входить до складу молока.
19.4.4. Хімічні властивості
1. Гідроліз жирів. Мила. Детергенти. Як і всі естери, жири здатні піддаватися гідролізу:
^°
НС-о-С^К' + ЗН20 -Ж-* *0
тригліцерид
функціональні
похідні карбонових кислот
Карбонові
кислоти. Глава
1,
-ОН
-ОН + КСОО" + К'СОО- + К."СО(
Н2С-
— не-
Н2С—ОН
Унаслідок взаємодії жирів з водними розчинами гідроксидів лужних металів (ИаОН, КОН) утворюється суміш гліцерину тая натрієвих (калієвих) солей вищих жирних кислот. Зазначені солі називають милами, а реакцію лужного гідролізу жирів, якою утворюються мила,— омиленням*.
Лужний гідроліз жирів прискорюється при заміні водного середовища на водно-спиртове. Луг діє і як реагент, і як емульгатор жирів, збільшуючи поверхню зіткнення жирової фази з гідролізуючим середовищем; спирт зменшує в'язкість реакційного середовища.
При температурі 200—225 °С і тиску 2—2,5 МПа гідроліз жирів відбувається і без додавання лугу.
Суміш твердих високомолекулярних жирних кислот, здебільшого стеаринової та пальмітинової, яку отримують при гідролізі жирів у кислому та нейтральному середовищах, називають стеарином. Стеарин використовують поряд із парафіном для виготовлення свічок.
Для одержання твердого мила виділену суміш вищих жирних кислот нейтралізують содою. Якщо нейтралізацію суміші вищих жирних кислот проводять за допомогою поташу (калій карбонату), то утворюється калійне («зелене») мило, на відміну від натрієвого, має рідку консистенцію.
При нейтралізації суміші жирних кислот оксидами лужноземельних і перехідних металів (Са, М§, 2п, РЬ тощо) утворюються нерозчинні у воді, так звані «металічні» мила, які використовують як медичні пластирі (наприклад, простий свинцевий) та ін. Молекули мила містять у своїй структурі гідрофільний (такий, що «тягнеться» до молекул води) карбоксилат-аніонний фрагмент і гідрофобний (такий, що «уникає» контакту з водою) протяжний карбоновий ланцюг. Через таку будову мила мають практично однакову здатність розчиняти як гідрофільні (вода, спирти тощо), так і ліпофільні (вуглеводні, жири, етери тощо) речовини. Крім того, на відміну від молекул натрієвих і калієвих солей нижчих жирних кислот, молекули мила здатні до агрегації («злипання» одна з одною) з утворенням сферичних структур — міцел. У водному
І
* Термін «омилення» часто застосовують і до реакції гідролізу інших функціональних похідних кислот: усіх естерів, амідів, нітрилів тощо, навіть до реакції гідролізу галогенопохідних.
полярна
карбоксилатна
група
І
—; °
неполярний
вуглеводневий
«хвіст»
331
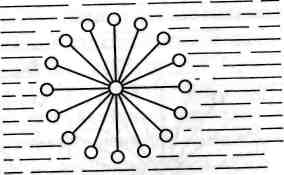
Рис. 19.1. Будова міцели мила у воді
63 6~6~б (Ж> 6~5 6^> 6_б б 66 оо
Рис. 19.2. Орієнтація молекул мила на межі водного та повітряного середовищ
середовищі міцели мила мають будову, схематично показану на рис. 19.1. У міцелі молекули мила зчеплені між собою вуглеводневими «хвостами», а до води спрямовані полярними карбоксилатни-ми групами. Беручи участь в утворенні багатьох міцел, молекули мила не можуть рівномірно розподілятися серед молекул води, тобто мила не здатні до утворення справжніх водних розчинів.
На межі водної та газової (повітряної) фаз, молекули мила орієнтуються полярними кінцями «до води», а гідрофобними — «назовні» (рис. 19.2). При цьому вони зменшують поверхневий натяг води, тобто виявляють так звані поверхнево-активні властивості.
Завдяки наявності в їх молекулах карбоксилатних груп мила відносять до аніонних поверхнево-активних речовин (аніонні ПАР). Зазначені властивості мил зумовлюють їх миючу дію. Вода, що містить мило, завдяки зменшенню свого поверхневого натягу набуває здатності проникати в найменші пори на поверхні, яку відмивають. При наявності на цій поверхні частинок речовин, які не змочуються водою (жирів, восків, нафтопродуктів тощо), молекули мила зчеплюються з гідрофобними частинками забруднень своїми вуглеводневими «хвостами», утворюючи навколо таких частинок щільну плівку (рис. 19.3, а), вклинюються між забруднювальною частинкою та поверхнею, що очищується (рис. 19.3, б), і зрештою
Рис. 19.3. Схема миючої дії мила
відривають цю частинку, переводячи її в завислий стан у товщі водного середовища (рис. 19.3, в).
Аналогічний механізм має процес солюбілізації нерозчинних у воді органічних (у тому числі лікарських) речовин.
Ширше застосування мил як миючих засобів обмежене тим, що в твердій воді (з підвищеним вмістом іонів Са2+ та М§2+) мила утворюють нерозчинні солі Кальцію та Магнію, які осаджуються у вигляді пластівців і забруднюють поверхні. На утворення цих солей витрачається значна кількість мила. Будучи солями слабких кислот і сильних основ, мила внаслідок гідролізу утворюють лужне середовище у водних розчинах, що зумовлює подразливу дію мил на слизові оболонки.
Зазначені вади мил були причиною створення широкого асортименту дешевших і більш технологічних синтетичних замінників мил — детергентів.
Детергенти, або синтетичні миючі засоби, як і мила, відносять до ПАР. їхні молекули також містять неполярний (гідрофобний) вуглеводневий фрагмент і полярну (гідрофільну) частину.
Прикладом детергенту може бути:
Н3С-(СН2)6 /=\
натрій л-(децил-3)бензенсульфонат Щ
Детергенти з розгалуженими вуглеводневими ланцюжками неприйнятні в екологічному відношенні, оскільки під час очищення
функціональні похідні карбонових кислот
стічних вод вони не розкладаються мікроорганізмами, що призводить до накопичення синтетичних миючих речовин у природних водоймищах у згубних концентраціях.
На відміну від мил, синтетичні миючі засоби не утворюють нерозчинних солей з катіонами кальцію та магнію, а їх водні розчини мають нейтральну реакцію, оскільки детергенти є або солями сильних кислот і сильних основ, або не містять груп, здатних гідролізуватися за звичайних умов. Важливою перевагою детергентів перед милами є також те, що їх виробництво не потребує використання як сировини жирів — цінних харчових продуктів. 2. Окиснення жирів. Причиною здатності жирів легко окисню-ватися киснем повітря є наявність подвійних зв'язків у їх молекулах, що призводить до «гіркнення» жирів. При їх окисненні утворюються альдегіди з короткими карбоновими ланцюгами, які зумовлюють неприємний запах і смак «згірклих» жирів.
Окиснення ненасичених жирів можна здійснити водним розчином калій перманганату КМп04: якщо збовтати цей розчин у пробірці з маслом, відбувається його знебарвлення (утворюються гліколі за місцем розриву подвійних зв'язків). Реакція застосовується для доведення ненасиченого характеру масел.
3. Гідрогенізація жирів. Гідрогенізації піддають рослинні олії та жири, які отримують з морських тварин (китовий жир та ін.).
В основу процесу покладено реакцію приєднання водню за місцем розриву карбон-карбонових подвійних зв'язків у залишках лінолевої, ліноленової, олеїнової та інших ненасичених кислот у присутності нікелевого або платинового каталізатора при температурі 190—220 °С і тиску 0,2—2,0 МПа (каталітичне гідрування).
Через насичення карбон-карбонових зв'язків воднем, а також унаслідок ізомеризації залишків олеїнової кислоти (цнс-ізомер, т. пл. 13,4 і 16,3 °С) в елащинову (транс-ізомер, т. пл. 51,5 °С) під впливом нікелевого каталізатора (елаїдування) рослинні олії перетворюються на тверді жири.
н2с-
н2с-о-с-с17н33 н2с-о-с-(сн2)16-сн3
ні-о-с^с17н3з т^г 4-о-с^сн2)16-сн3
Н2с-0-С^С17Нзз ' Н2і-0-С^?СН2)16-СН3
тристеарин (рщкий^р-масло) (твердий жир)
Карбонові кислоти. Глава /о 334 я
Промислові жири, здобуті шляхом гідрогенізації рослинщ олій або жирів, одержаних з морської фауни, називають салома-сами. Харчові саломаси (т. пл. 31—32 °С) використовуються у ви»І робництві кондитерських, кулінарних жирів і маргарину. Маргарин — це харчовий жир, що являє собою суміш гідрогенізованих жирів рослинного та тваринного походження з додаванням вершків, смакових та ароматичних речовин, наприклад, діацетилу СН3—СО—СО—СНз та ін. Технічні саломаси (т. пл. 39—49 °С) сировина для вироблення мила, стеарину тощо.
Унаслідок гідрогенізації жирів змінюються не лише їх фізичні властивості. Завдяки різкому зменшенню кількості подвійних зв'язків у молекулах вони набувають стійкості до дії окисників, зокрема кисню повітря, що запобігає гіркненню. При цьому зберігається висока поживність, характерна для кращих сортів рослинних і тваринних жирів, але, на відміну від тваринних жирів, продукти гідрогенізації рослинних олій не містять домішок холестерину, надлишок якого в організмі призводить до атеросклерозу.
