
- •Передмова
- •Вступ до органічної хімії
- •1.1. Предмет органічної хімії
- •1.2. Короткий огляд історії розвитку органічної хімії
- •Глава 1 6
- •1.3. Розвиток теоретичних уявлень про будову органічних сполук
- •Глава 1
- •1.4. Способи зображення органічних молекул
- •Глава 1
- •2.1. Класифікація органічних сполук
- •Глава 2
- •2.2. Номенклатура органічних сполук
- •Глава 2
- •Глава 2
- •ХїмГчний зв'язок
- •3.1. Типи хімічних зв'язків
- •3.2. Хімічний зв'язок в органічних сполуках
- •3.2.1. Гібридизація атомних орбіталей
- •3.2.2. Ковалентні о- і я-зв'язки
- •3.2.3. Основні характеристики ковалентних зв'язків
- •4.1. Індуктивний ефект
- •Глава 40
- •4.2. Мезомерний ефект (ефект спряження)*
- •Глава 4
- •Глава 4
- •4.4. Надспряження (гіперкон'югація)
- •Глава 4
- •Класифікація ізомерії ізомерія
- •48 Глава 5
- •5.2. Просторова ізомерія (стереоізомерія)
- •Глава 5
- •5.3. Способи зображення просторової будови
- •Глава 5
- •6.1. Кислотність і основність за теорією бренстеда
- •Глава 6
- •6.2. Типи органічних кислот і основ
- •Глава 6
- •6.3. Кислоти і основи льюїса
- •7.1. Поняття про типи механізмів реакцій
- •Глава 7
- •7.2. Поняття про типи органічних реакцій
- •Глава 7
- •Вуглеводні
- •8.1. Електронна та просторова будова алканів
- •8.2. Номенклатура
- •8 .3. Ізомерія
- •8.4. Способи добування
- •8.4.1. Природні джерела
- •8.4.2. Синтетичні методи добування
- •8.5. Фізичні властивості
- •8.6. Хімічні властивості
- •8.6.1. Реакції радикального заміщення (5*)
- •76 Вуглеводні. Глава 8
- •8.6.2. Крекінг
- •8.7. Окремі представники. Застосування
- •1. Напишіть структурні формули наведених вуглеводнів і назвіть їх за раціональною номенклатурою:
- •2. Напишіть структурні формули таких вуглеводнів і назвіть їх за но менклатурою шрас:
- •Ц иклоалкани
- •9.1. Класифікація та номенклатура
- •9.2. Ізомерія
- •9.3. Способи добування. Фізичні властивості
- •9.4. Будова циклоалканів
- •9.5. Хімічні властивості
- •9.6. Окремі представники. Застосування
- •4 Органічна хімія
- •10.1. Номенклатура
- •Перші члени гомологічного ряду алкенів
- •100 Ненасичені вуглеводні. Глава іо
- •10.2. Ізомерія
- •10.3. Електронна і просторова будова алкенів
- •10.4. Способи добування
- •10.5. Фізичні властивості
- •10.6. Хімічні властивості
- •109 Ненасичені вуглеводні. Глава 10 108
- •1 0.6.1. Реакції електрофільного приєднання (ае)
- •10.6.2. Реакції відновлення та окиснення
- •10.6.3. Полімеризація алкенів
- •10.6.4. Алільне галогенування алкенів
- •118 Ненасичені вуглеводні. Глава ю
- •10.7. Окремі представники. Застосування. Ідентифікація
- •0 Контрольні питання та вправи
- •Алкадієни
- •11.2. Будова алкадієнів
- •11.1. Номенклатура
- •11.3. Алкадієни зі спряженими зв'язками 11.3.1. Способи добування
- •11.3.2. Хімічні властивості
- •11.3.3. Натуральний і синтетичний каучук
- •11.4 Окремі представники. Застосування
- •12.1. Номенклатура та ізомерія
- •12.2. Електронна та просторова будова молекул алкінів
- •12.3. Способи добування
- •138 Ненасичені вуглеводні. Глава т2
- •12.4. Фізичні властивості
- •12.5. Хімічні властивості
- •12.5.1. Реакції електрофільного приєднання (ае)
- •12.5.2. Реакції заміщення
- •12.6. Окремі представники. Застосування
- •Одноядерні арени
- •13.1. Будова бензену. Ароматичність
- •13.2. Номенклатура та ізомерія
- •13.3. Способи добування 13.3.1. Природні джерела
- •13.3.2. Синтетичні методи добування
- •13.4. Фізичні властивості
- •13.5. Хімічні властивості
- •13.5.1. Реакції електрофільного заміщення (5£)
- •0/1Ноядєрні аРени
- •13.5.2. Реакції приєднання
- •13.5.3. Реакції окиснення
- •13.5.4. Галогенування гомологів бензену з участю бокового ланцюга
- •165 0ДнояДерн[арени
- •13.6. Вплив замісників у бензеновому кільці на напрямок та швидкість реакцій
- •Електрофільного заміщення
- •13.7. Орієнтація в дизаміщеному бензені
- •1 3.8. Окремі представники. Застосування
- •13.9. Представники багатоядерних аренів
- •13.9.1. Нафтален
- •13.9.2. Антрацен
- •14.1. Природний та попутний нафтовий гази
- •Глава 14
- •14.2. Нафта. Нафтопродукти
- •14.3. Коксування вугілля
- •Глава 1і0у глава Глава 14 186 !
- •15.1. Класифікація та номенклатура
- •15.2. Ароматичність гетероциклів
- •Глава 15
- •15.3. Кислотно-осНбВні властивості гетероциклів
- •15.4. П'ятичленні гетероциклічні сполуки з одним гетероатомом
- •15.4.1. Способи добування
- •15.4.2. Фізичні властивості
- •15.4.3. Хімічні властивості
- •Глава 15
- •15.4.4. Найважливіші похідні піролу
- •Глава 15
- •15.5. Шестичленні гетероциклічні сполуки з одним гетероатомом
- •Глава 15
- •Глава 15
- •В. Реакції відновлення і окиснення
- •15.6. П'яти-1 шестичленні гетероцикли з двома гетероатомами
- •208 Глава 15
- •15.7. Представники конденсованих систем гетероциклів
- •16.1. Одноатомні спирти
- •16.1.1. Номенклатура
- •Глава 16
- •16.1.2. Ізомерія
- •16.1.3. Фізичні властивості
- •Глава 1
- •16.1.4. Способи добування
- •16.1.5. Хімічні властивості
- •16.1.6. Ідентифікація спиртів
- •16.1.7. Окремі представники
- •230 Глава 16
- •16.2.1. Способи добування дво- і триатомних спиртів
- •16.2.2. Фізичні властивості
- •16.2.3. Хімічні властивості
- •16.2.4. Окремі представники
- •16.3.2. Способи добування
- •16.3. Одноатомні феноли 16.3.1. Номенклатура та ізомерія
- •16.3.4. Хімічні властивості
- •16.3.3. Фізичні властивості
- •249 Гідроксильні похідні вуглеводнів
- •В. Реакції відновлення і окиснення
- •255 Гідроксильні похідні вуглеводнів
- •17.1. Номенклатура та ізомерія
- •17.2. Способи добування
- •17.3. Фізичні властивості
- •263 Цясимені альдегіди і кетони
- •269 Насичені альдегіди і кетони
- •271 ИаСйчені альдегіди і кетони
- •17.5. Окремі представники
- •Монокарбонові кислоти
- •18.1. Насичені монокарбонові кислоти
- •18.1.1. Номенклатура та ізомерія
- •18.1.3. Фізичні властивості
- •18.1.4. Хімічні властивості
- •А. Кислотні властивості
- •Г. Окиснення та відновлення
- •18.1.5. Окремі представники
- •18.2. Ненасичені монокарбонові кислоти
- •18.2.1. Номенклатура та ізомерія
- •18.2.2. Способи добування
- •18.2.4. Хімічні властивості
- •18.2.3. Фізичні властивості
- •18.2.5. Окремі представники
- •299 Монокарбонові кислоти
- •18.3. Ароматичні монокарбонові кислоти
- •18.3.1. Способи добування
- •18.3.2. Фізичні властивості
- •18.3.3. Хімічні властивості
- •18.3.4. Окремі представники. Ідентифікація
- •303 Монокарбонові кислоти
- •18.4.1. Номенклатура та ізомерія
- •Назви деяких дикарбонових кислот
- •18.4.2. Способи добування
- •18.4.3. Фізичні властивості
- •18.4.4. Хімічні властивості
- •18.4.5. Окремі представники
- •309 Мриокар6онові кислоти
- •18.5. Ароматичні дикарбонові кислоти
- •310 Карбонові кислоти. Глава и
- •313 Монокарбонові кислоти
- •19.1.2. Способи добування
- •19.1. Галогенангідриди карбонових кислот (ацилгалогеніди)
- •19.1.1. Номенклатура
- •19.1.3. Фізичні властивості
- •19.1.4. Хімічні властивості
- •19.1.5. Окремі представники
- •19.2. Ангідриди карбонових кислот
- •19.2.1. Номенклатура
- •19.2.2. Способи добування
- •19.2.3. Фізичні властивості
- •19.2.4. Хімічні властивості
- •19.2.5. Окремі представники
- •19.3. Естери карбонових кислот
- •19.3.1. Номенклатура
- •19.3.3. Фізичні властивості
- •19.3.4. Хімічні властивості
- •19.3.5. Окремі представники
- •19.4. Жири
- •19.4.1. Номенклатура та ізомерія
- •19.4.2. Способи добування
- •19.4.3. Фізичні властивості
- •19.4.4. Хімічні властивості
- •19.4.5. Воски. Твіни
- •19.5. Аміди карбонових кислот
- •19.5.1. Номенклатура
- •Ацетамщ,
- •19.5.2. Способи добування
- •19.5.3. Фізичні властивості
- •19.5.4. Хімічні властивості
- •19.5.5. Окремі представники
- •19.6. Нітрили (ціаніди)
- •19.6.1. Номенклатура
- •19.6.2. Способи добування
- •19.6.3. Хімічні властивості
- •19.6.4. Окремі представники
- •20.1. Галогенокарбонові кислоти
- •20.1.1. Номенклатура
- •20.1.2. Способи добування
- •20.1.3. Фізичні та хімічні властивості
- •20.2. Гідроксикислоти
- •20.2.2. Оптична ізомерія
- •20.2.3. Аліфатичні пдроксикислоти
- •359 Гетерофункціональні карбонові кислоти
- •Фізичні та хімічні властивості
- •361 Гетерофункціональні карбонові кислоти
- •20.3. Амінокислоти
- •II Амінокислотами називаються похідні карбонових кислот, у вуглеводневому радикалі яких один або кілька атомів Гідрогену замінені аміногрупою.
- •20.3.1. Номенклатура та ізомерія
- •20.3.2. Способи добування
- •20.3.3. Фізичні та хімічні властивості
- •367 Гетерофункціональні карбонові кислоти
- •20.3.4. Окремі представники
- •0 Контрольні питання та вправи
- •21.1. Номенклатура та ізомерія
- •Глава 21
- •Глава 21
- •21.2.1. Способи добування
- •21.2.2. Фізичні властивості. Просторова будова
- •21.2.3. Хімічні властивості
- •Глава 21 378 — —
- •21.3. Ариламіни
- •Глава 21
- •21.3.2. Фізичні та хімічні властивості
- •А. Реакції за участю атома Нітрогену
- •Глава 21
- •Глава 21
- •21.4. Окремі представники. Застосування
- •В. Окислення ариламінів
- •Глава 21
- •Глава 21
- •22.1. Моносахариди
- •22.1.1. Класифікація та номенклатура
- •Глава 22
- •22.1.2. Стереоізомерія
- •Глава 22
- •22.1.3. Будова моносахаридів
- •Глава 22
- •Глава 22 402
- •Глава 22
- •22.1.4. Способи добування
- •22.1.5. Фізичні властивості
- •22.1.6. Хімічні властивості
- •Глава 22
- •Глава 22
- •Б. Реакції за участю циклічних форм
- •Глава 22
- •22.1.7. Окремі представники
- •Глава 22 412
- •Глава 22
- •22.2. Дисахариди
- •22.2.1. Відновні дисахариди
- •Глава 22
- •22.2.2. Невідновні дисахариди
- •14 Органічна хімія
- •Глава 22 418
- •22.3. Полісахариди
- •Глава 22 н он н он н он н он
- •Глава 22 422
- •Глава 22 424
- •425 Вуглеводи
- •Глава 23
- •Глава 23
- •23.1.1. Стереоізомерія
- •23.1.2. Фізичні властивості
- •23.1.3. Способи добування
- •23.1.4. Хімічні властивості
- •Глава 23
- •23.2. Будова пептидів і білків
- •Глава 23
- •23.3. Синтез пептидів та їх властивості
- •440 Глава 23
- •23.4. Функції білків в організмі
- •Нуклеїнові кислоти
- •24.1. Будова нуклеїнових кислот
- •Глава 24
- •Глава 24
- •24.2. Рибонуклеїнові (рнк) і дезоксирибонуклеїнові (днк) кислоти
- •Глава 24
- •Глава 24
- •Глава 25
- •Неомилювані ліпіди
- •Глава 25
- •Глава 9. Циклоалкани 86
- •Глава 10. Алкени 98
- •Глава 11. Алкадієни 122
- •Глава 12. Алкіни 135
- •Глава 13. Одноядерні арени 147
- •Глава 14. Природні джерела вуглеводнів 179
- •Глава 15. Гетероциклічні сполуки 187
- •Глава 16. Гідроксильні похідні вуглеводнів 212
- •Глава 17. Насичені альдегіди і кетони 256
- •Глава 18. Монокарбонові кислоти 280
- •Глава 19. Функціональні похідні карбонових кислот 314
- •Глава 20. Гетерофункціональні карбонові кислоти 346
- •Глава 21. Аміни 371
- •Глава 22. Вуглеводи 394 о
- •Глава 23. Білки 426 •
- •Глава 24. Нуклеїнові кислоти 444
- •Глава 25. Ліпіди 453
- •Органічна хімія
- •61002, Харків, вул. Пушкінська, 53.
- •61022, Харків, пл. Свободи, 5, Держпром, 6-й під'їзд, 6-й поверх.
- •61012, Харків, вул. Енгельса, 11.
271 ИаСйчені альдегіди і кетони
Ґ. Реакції відновлення та окиснення Реакції відновлення. Реакцію відновлення альдегідів і кетонів широко застосовують для отримання спиртів (альдегіди відновлюються до первинних, а кетони — до вторинних спиртів). У техніці спирти добувають у результаті каталітичного гідрування; приєднання водню відбувається в присутності кобальту, нікелю або платини:
К—С
,^° .>% к—сн2—он
"Н
Відновлення альдегідів або кетонів до спиртів у лабораторії проводять за допомогою літійалюмінійгідриду (ІлА1Н4) або воднем у момент виділення:
-сн2—сн2—он
1-пропанол
н3с-сн-сн3
н3с-
^О ьіаіН4
н3с-сн2-с
н2
пропаналь
он
2-пропанол
н3с-с-сн3 о
пропанон
Реакції окиснення. Альдегіди й кетони по-різному реагують на дію окисників. Альдегіди дуже легко окиснюються, навіть при дії таких слабких окисників, якими є іони А§+ і Си2+ , перетворюючись на карбонові кислоти.
Реакцію окиснення альдегідів аміачним розчином аргентум нітрату (реактив Толленса) часто називають реакцією «срібного Дзеркала». Аргентум-іон у цій реакції відновлюється до вільного срібла, яке виділяється у вигляді дзеркала на стінках пробірки:
я
2[Ае(Ш3)2]ОН
^
Р
а—с
К_С^ + 2М\ + 4Ш3 + Н20 ^ОН
"Н
Альдегіди також відновлюють реактив Фелінга (суміш розчину купрум (II) сульфату з лужним розчином солі виннокам'яної кислоти):
Си504 -1* Си(ОН)2 + №2$04
">ОН
К-С^ + Си20
жовтий осад
К-С^ + Си(ОН)2


К—С
^он
^Н
2СиОН
Си20
+ Н20
О
О
*
<*?
+
Си(ОН)2
К—С
червоний осад
Реакції окиснення альдегідів аміачним розчином аргентум (І) оксиду і реактивом Фелінга застосовують в аналітичній практиці для виявлення альдегідної групи. Кетони за даних умов не окисі нюються, тому цими реакціями розрізняють альдегіди й кетони. Відрізнити альдегіди від кетонів можна також кольоровою реакці-1 єю з фуксинсульфітною кислотою, з якою реагують тільки альде-1 гіди (фіолетове забарвлення).
Окиснення кетонів відбувається лише в присутності сильних окисників, таких як калій перманганат або калій дихромат, при \ цьому відбувається розрив зв'язків С—С між атомами Карбону] карбонільної групи та вуглеводневого радикала. У результаті реакції утворюється суміш кислот:
н-
мурашина кислота
Т)Н
_
СҐ
[О]
Н3С
.0
2Н,С-
ГЧ>н
•_,г-СН2 СН3
оцтова кислота
■* н,с—сн
2![]() -бутанон
-бутанон
прошонова кислота
За продуктами, що утворюються при окисненні, визначають будову кетонів.
17.5. Окремі представники
Мурашиний альдегід (формальдегід, метаналь) СН20. Безбарвний газ з різким запахом, розчинний у воді, здобувають термічним дегідруванням метанолу (600 °С) над срібним каталізатором:
•<
сн,он
»
н—сг + н2
Насичені альдегіди і кетони
37—40 %-вий водний розчин формальдегіду, який містить 6— 15 % метанолу (інгібітор полімеризації формальдегіду), застосовується під назвою «формалін» як дезінфікувальний та дубильний засіб, консервант для анатомічних препаратів. У промисловості формалін потрібен у виробництві фенолоформальдегідних, сечо-виноформальдегідних та інших смол, необхідних в електропромисловості та машинобудуванні. У медицині як дезінфікувальний засіб використовується препарат гексаметилентетрамін (уротропін) — похідне формальдегіду:
6СН20
+
4NНз
_6Н20
'
(СН2)^4 МІ
Під час нітрування уротропіну отримують речовину гексоген, яка має бризантні властивості.
Оцтовий альдегід (ацетальдегід, етаналь) СН3СНО. Безбарвна рідина з різким запахом (т. кип. 21 °С), змішується з водою, етанолом, діетиловим етером в будь-яких співвідношеннях. Може бути одержаний дегідруванням або окисненням етанолу над срібним каталізатором, гідратацією ацетилену (реакція Кучерова). Застосовується для одержання оцтової кислоти.
Ацетон (диметилкетон, пропанон) СН3СОСН3. Безбарвна рідина (т. кип. 56,5 °С), змішується з водою та органічними розчинниками. Добувається сухою перегонкою деревини, піролізом кальцій ацетату, дегідруванням 2-пропанолу та з кумену (поряд із фенолом).
Ацетон застосовується як розчинник органічних речовин (лаків, нітроцелюлози) і як вихідна речовина в синтезі деяких лікарських препаратів, наприклад йодоформу:
ь, он~
н3с—с—сн3 — н3с—с—о- + сні3
о о
Цією реакцією часто користуються для відкриття ацетону, проте в заданих умовах йодоформ утворюється також з інших речовин. "°на придатна також для виявлення ацетону в сечі при цукровому
Діабеті.
Ненасиченим альдегідам притаманні властивості альдегідів та ^Кенів. Приєднання галогеноводнів, води до а,Р-ненасичених ^ьдегідів відбувається всупереч правилу Марковникова.
274
Главо
цасичені альдегіди і кетони
275
П
 редставниками
ненасичених альдегідів є
акролеїн і кротоно» вий
альдегід:
редставниками
ненасичених альдегідів є
акролеїн і кротоно» вий
альдегід:
О "Н
.0
н
н,с=сн—сг
акролеїн
Н3С—СН=СН—С^
кротоновий альдегід
Акролеїн здобувають дегідратацією гліцерину (див. розд. 16.2.3. при нагріванні з КН803, а кротоновий альдегід — з оцтового алі дегіду в результаті кротонової конденсації (див. розд. 17.4.4., Б). 1
Акролеїн і кротоновий альдегід використовуються в синтез ряду сполук, зокрема лікарських препаратів.
Представниками ароматичних альдегідів і кетонів є:
![]()
ОН
-^
О
Н.
•![]() Ч^о
Ч^о
![]()
саліциловий альдегід, 2-гідроксибензальдегід
сн3
бензальдегід, я-толуїловий альдегід,
бензофенон,
дифенілкетон
бензойний альдегід 4-метилбензальдегід
ацетофенон, метил фенілкетон
Бензальдегід (бензойний альдегід) С6Н5СНО. Безбарвна рідина із запахом гіркого мигдалю (т. кип. 179,2 °С). Розчинний у спирті, практично нерозчинний у воді. Бензальдегід здобувають каталітичним окисненням толуену, гідролізом бензиліденхлориду. На повітрі бензальдегід легко окиснюється до бензойної кислоти. Бензойний альдегід використовується як ароматизатор у парфумерії та як сировина для отримання барвників у харчовій промисловості.
Ванілін (4-гідрокси-З-метоксибензальдегід). Кристалічна речовина (т. пл. 81—83 °С), добре розчинна в етанолі, етері, малороз-
![]()
чинна у воді. Ванілін як ароматична речовина Н^ ^О використовується в харчовій і парфумерній про- V
^исловості, є вихідною сполукою в синтезі фтивазиду — протитуберкульозного препарату.
ОСН,
ОН
А![]() цетофенон
(метилфенілкетон) СНз-СО—С6Н5.
Кристалічна
речовина (т. пл. 19,6 °С, т. кип. 202,3 °С),
розчинна в спирті, етері, бензені,
нерозчинна у воді.
цетофенон
(метилфенілкетон) СНз-СО—С6Н5.
Кристалічна
речовина (т. пл. 19,6 °С, т. кип. 202,3 °С),
розчинна в спирті, етері, бензені,
нерозчинна у воді.
Ацетофенон використовується як ароматизатор у парфумерії, а також у синтезі деяких лікарських препаратів.
-С
~ ^СН3 + НС1
^^
Основним методом здобування ароматичних кетонів є ацилування ароматичних вуглеводнів за Фріделем—Крафтсом:
сн3сосі, аісі3
Ароматичні альдегіди й кетони є також сполуками з подвійними властивостями: ароматичних та оксосполук.
КОНТРОЛЬНІ ПИТАННЯ ТА ВПРАВИ
1. Напишіть структурні формули поданих сполук і назвіть їх за іншою номенклатурою:
а) 2-метилбутаналь; є) гліоксаль;
б) етилізопропілкетон; є) дибутилкетон;
в) ж-нітробензальдегід; ж) ізопропіл-/ире/и-бутилкетон;
г) а-фенілпропіоновий альдегід; з) метилвінілкетон;
ґ) триетилоцтовий альдегід; и) метилпропілоцтовий альдегід;
д) 2-метил-З-пентеналь; і) триметилацетальдегід.
£>
Р
2. Назвіть наведені сполуки:
^
О
в) н2с=с—с:
б) (СНзЬС-С
«?
^а
^
СН,
а) (сн3)2сн—с:
ґ) (СН3)2СН-С-СН3
о
є) Н3С—С—СН2Вг
о
г) (СН3)2С=СН—С
^н
—СН2СН3
д) СН3СН:
ТГн
Глава
276
є) (СН3)2СН—С—СН(СН3)2 ж) (СН3)3С—С—СН(СН3)2 І
О О
3 ^
~СН2_СС.
! и
ОН
Напишіть формули ізомерів оксосполук, які відповідають формулі С5НшО; назвіть їх за двома номенклатурами. Отримайте кожним ізомер за допомогою реактиву Гриньяра.
Розташуйте подані сполуки в ряд за збільшенням реакційної здатності в реакціях нуклеофільного приєднання:
СН3 О
а) Н3С—СН—С—СН3; С6Н5—С—С6Н5; Н3С—СН2—СГ; С6Н5—С< А
о
НзС-сн-сС' ; (сн3)3с-сГ
Г ^'
^н
б) (сн3)2сн—ссГ ; сн3сн2—с^_ ;
СІ
в) Н3С-СГ; С6Н5-С-СН3; Н-СГ ; Н3С-С-СН3.
о о
Наведіть механізм альдольної та кротонової конденсації пропіоно-вого альдегіду. Назвіть добуті продукти.
Запропонуйте схеми перетворень:
а) пропаналь — етилметилкетон;
б) пропаналь -* 2-метил-З-пентанол;
в) ацетон ■— 2,3-диметил-2-бутанол;
г) ацетон — діізопропіловий етер; ґ) бензен -*- и-метилацетофенон;
д) 2-бромобутан -»- 2-бутанон; є) бромистий етил -* діетилкетон; є) етанол — кротоновий альдегід.
7. Напишіть схеми здобування наведених сполук, виходячи з пропіс нового альдегіду:
а) а-оксимасляної кислоти;
б) в/иор-бутилового спирту;
в) а-метил-Р-оксивалеріанового альдегіду;
г) етилметилкетону.
„сичені альдегіди і кетони
а^__ 277
8. Напишіть схеми і назвіть продукти взаємодії фенілоцтового альдегі ду із зазначеними реагентами:
а) реактивом Толленса; б) реактивом Фелінга; в) ціановодневою кислотою; г) фенілмагнійбромідом з подальшим гідролізом продукту.
9. На прикладі пропаналю і пропанону напишіть схеми загальних та відмітних реакцій альдегідів і кетонів.
10. Напишіть рівняння реакцій і назвіть продукти взаємодії л-бромо- бензальдегіду з такими реагентами:
а) амоніаком; б) хлором; в) метилмагнійбромідом з подальшим гідролізом; г) калій ціанідом з подальшим гідролізом.
На прикладі оцтового і бензойного альдегідів напишіть схеми загальних та відмітних реакцій аліфатичних і ароматичних альдегідів.
Як розрізнити:
а) пропаналь і пропанон;
б) 2-пентанон і 3-пентанон;
в) бензальдегід і оцтовий альдегід;
г) пропаналь і пропеналь? Складіть рівняння реакцій.
Наведіть схеми реакцій, що характеризують особливі властивості мурашиного альдегіду у порівнянні з його гомологами.
Напишіть схеми взаємодії акролеїну та вінілоцтового альдегіду з такими реагентами:
а) ціановодневою кислотою;
б) водою в кислому середовищі;
в) амоніачним розчином аргентум (І) оксиду.
Як впливає альдегідна група на реакційну здатність кратного зв'язку? Відповідь поясніть.
15. Здійсніть перетворення:
оЧ _ СН3М8Вг Н2Р
а) метан ■■ ацетилен * етаналь *■ ? -
![]()
„ КСК . 2Н,0 2№ОН, /
„ НСИ „ 2Н,0 „ NНз „
Кч НВг М8,етер СН20 Н20
о) етилен •■ етанол *■ ? "- ? *" і -
. „ о СиО^ альдольно- г ? Н2Р > [О] > НВг КСК
*" • кротонова • " • .
конденсація
-^7 2Н^°. 7-^9
278
Глав
в) етилен ——"г ацетилен • бензен
толуен
• ^
№он
„
г)
натрій бензоат ►•
?
— хлористий бензил » бензальдегід »
Иа СН3Вг
•*■ бензиловий спирт ? "■ ?
бензальдегід •
РСЦ 2Nа, СН,С1 2С1,, Ік
-» 9
бензиловий спирт ► ?
? спирт, р-н ОН' ? Н2Р, Н82+, Н+ ? [О^ ?
|
|
|
|
|
|
|
|
. |
,-
Карбоновими кислотами називаються похідні вуглеводнів, що містять у своєму складі карбоксильну гру-
I пу—СООН.
<
■
Залежно від природи вуглеводневого радикала, з яким зв'язана карбоксильна група, відрізняють аліфатичні, аліциклічні й ароматичні карбонові кислоти.
Кислоти поділяють за кількістю карбоксильних груп на моно-карбонові (містять одну групу —СООН), дикарбонові (дві), трикар-бонові (три) та полікарбонові (більше трьох).
Аліфатичні карбонові кислоти класифікують за мірою насиченості вуглеводневого радикала на насичені й ненасичені.
■
Монокарбонові
кислоти
281


5
ГЛАВА
метилоцтова
кислота етилметилоцтова
кислота
арбонових
кислот наведено в табл. 18.1.
Таблиця
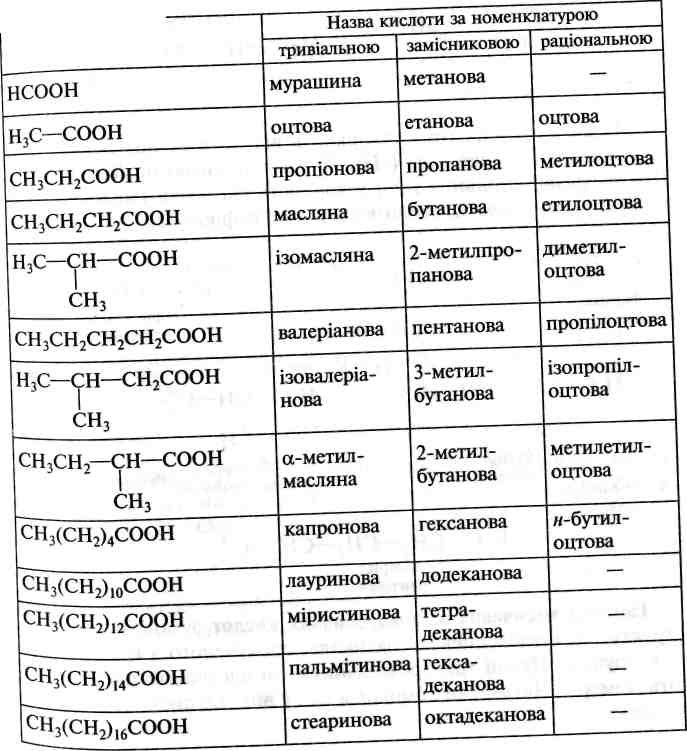
18.1.![]()
ГЛАВА
