
- •Передмова
- •Вступ до органічної хімії
- •1.1. Предмет органічної хімії
- •1.2. Короткий огляд історії розвитку органічної хімії
- •Глава 1 6
- •1.3. Розвиток теоретичних уявлень про будову органічних сполук
- •Глава 1
- •1.4. Способи зображення органічних молекул
- •Глава 1
- •2.1. Класифікація органічних сполук
- •Глава 2
- •2.2. Номенклатура органічних сполук
- •Глава 2
- •Глава 2
- •ХїмГчний зв'язок
- •3.1. Типи хімічних зв'язків
- •3.2. Хімічний зв'язок в органічних сполуках
- •3.2.1. Гібридизація атомних орбіталей
- •3.2.2. Ковалентні о- і я-зв'язки
- •3.2.3. Основні характеристики ковалентних зв'язків
- •4.1. Індуктивний ефект
- •Глава 40
- •4.2. Мезомерний ефект (ефект спряження)*
- •Глава 4
- •Глава 4
- •4.4. Надспряження (гіперкон'югація)
- •Глава 4
- •Класифікація ізомерії ізомерія
- •48 Глава 5
- •5.2. Просторова ізомерія (стереоізомерія)
- •Глава 5
- •5.3. Способи зображення просторової будови
- •Глава 5
- •6.1. Кислотність і основність за теорією бренстеда
- •Глава 6
- •6.2. Типи органічних кислот і основ
- •Глава 6
- •6.3. Кислоти і основи льюїса
- •7.1. Поняття про типи механізмів реакцій
- •Глава 7
- •7.2. Поняття про типи органічних реакцій
- •Глава 7
- •Вуглеводні
- •8.1. Електронна та просторова будова алканів
- •8.2. Номенклатура
- •8 .3. Ізомерія
- •8.4. Способи добування
- •8.4.1. Природні джерела
- •8.4.2. Синтетичні методи добування
- •8.5. Фізичні властивості
- •8.6. Хімічні властивості
- •8.6.1. Реакції радикального заміщення (5*)
- •76 Вуглеводні. Глава 8
- •8.6.2. Крекінг
- •8.7. Окремі представники. Застосування
- •1. Напишіть структурні формули наведених вуглеводнів і назвіть їх за раціональною номенклатурою:
- •2. Напишіть структурні формули таких вуглеводнів і назвіть їх за но менклатурою шрас:
- •Ц иклоалкани
- •9.1. Класифікація та номенклатура
- •9.2. Ізомерія
- •9.3. Способи добування. Фізичні властивості
- •9.4. Будова циклоалканів
- •9.5. Хімічні властивості
- •9.6. Окремі представники. Застосування
- •4 Органічна хімія
- •10.1. Номенклатура
- •Перші члени гомологічного ряду алкенів
- •100 Ненасичені вуглеводні. Глава іо
- •10.2. Ізомерія
- •10.3. Електронна і просторова будова алкенів
- •10.4. Способи добування
- •10.5. Фізичні властивості
- •10.6. Хімічні властивості
- •109 Ненасичені вуглеводні. Глава 10 108
- •1 0.6.1. Реакції електрофільного приєднання (ае)
- •10.6.2. Реакції відновлення та окиснення
- •10.6.3. Полімеризація алкенів
- •10.6.4. Алільне галогенування алкенів
- •118 Ненасичені вуглеводні. Глава ю
- •10.7. Окремі представники. Застосування. Ідентифікація
- •0 Контрольні питання та вправи
- •Алкадієни
- •11.2. Будова алкадієнів
- •11.1. Номенклатура
- •11.3. Алкадієни зі спряженими зв'язками 11.3.1. Способи добування
- •11.3.2. Хімічні властивості
- •11.3.3. Натуральний і синтетичний каучук
- •11.4 Окремі представники. Застосування
- •12.1. Номенклатура та ізомерія
- •12.2. Електронна та просторова будова молекул алкінів
- •12.3. Способи добування
- •138 Ненасичені вуглеводні. Глава т2
- •12.4. Фізичні властивості
- •12.5. Хімічні властивості
- •12.5.1. Реакції електрофільного приєднання (ае)
- •12.5.2. Реакції заміщення
- •12.6. Окремі представники. Застосування
- •Одноядерні арени
- •13.1. Будова бензену. Ароматичність
- •13.2. Номенклатура та ізомерія
- •13.3. Способи добування 13.3.1. Природні джерела
- •13.3.2. Синтетичні методи добування
- •13.4. Фізичні властивості
- •13.5. Хімічні властивості
- •13.5.1. Реакції електрофільного заміщення (5£)
- •0/1Ноядєрні аРени
- •13.5.2. Реакції приєднання
- •13.5.3. Реакції окиснення
- •13.5.4. Галогенування гомологів бензену з участю бокового ланцюга
- •165 0ДнояДерн[арени
- •13.6. Вплив замісників у бензеновому кільці на напрямок та швидкість реакцій
- •Електрофільного заміщення
- •13.7. Орієнтація в дизаміщеному бензені
- •1 3.8. Окремі представники. Застосування
- •13.9. Представники багатоядерних аренів
- •13.9.1. Нафтален
- •13.9.2. Антрацен
- •14.1. Природний та попутний нафтовий гази
- •Глава 14
- •14.2. Нафта. Нафтопродукти
- •14.3. Коксування вугілля
- •Глава 1і0у глава Глава 14 186 !
- •15.1. Класифікація та номенклатура
- •15.2. Ароматичність гетероциклів
- •Глава 15
- •15.3. Кислотно-осНбВні властивості гетероциклів
- •15.4. П'ятичленні гетероциклічні сполуки з одним гетероатомом
- •15.4.1. Способи добування
- •15.4.2. Фізичні властивості
- •15.4.3. Хімічні властивості
- •Глава 15
- •15.4.4. Найважливіші похідні піролу
- •Глава 15
- •15.5. Шестичленні гетероциклічні сполуки з одним гетероатомом
- •Глава 15
- •Глава 15
- •В. Реакції відновлення і окиснення
- •15.6. П'яти-1 шестичленні гетероцикли з двома гетероатомами
- •208 Глава 15
- •15.7. Представники конденсованих систем гетероциклів
- •16.1. Одноатомні спирти
- •16.1.1. Номенклатура
- •Глава 16
- •16.1.2. Ізомерія
- •16.1.3. Фізичні властивості
- •Глава 1
- •16.1.4. Способи добування
- •16.1.5. Хімічні властивості
- •16.1.6. Ідентифікація спиртів
- •16.1.7. Окремі представники
- •230 Глава 16
- •16.2.1. Способи добування дво- і триатомних спиртів
- •16.2.2. Фізичні властивості
- •16.2.3. Хімічні властивості
- •16.2.4. Окремі представники
- •16.3.2. Способи добування
- •16.3. Одноатомні феноли 16.3.1. Номенклатура та ізомерія
- •16.3.4. Хімічні властивості
- •16.3.3. Фізичні властивості
- •249 Гідроксильні похідні вуглеводнів
- •В. Реакції відновлення і окиснення
- •255 Гідроксильні похідні вуглеводнів
- •17.1. Номенклатура та ізомерія
- •17.2. Способи добування
- •17.3. Фізичні властивості
- •263 Цясимені альдегіди і кетони
- •269 Насичені альдегіди і кетони
- •271 ИаСйчені альдегіди і кетони
- •17.5. Окремі представники
- •Монокарбонові кислоти
- •18.1. Насичені монокарбонові кислоти
- •18.1.1. Номенклатура та ізомерія
- •18.1.3. Фізичні властивості
- •18.1.4. Хімічні властивості
- •А. Кислотні властивості
- •Г. Окиснення та відновлення
- •18.1.5. Окремі представники
- •18.2. Ненасичені монокарбонові кислоти
- •18.2.1. Номенклатура та ізомерія
- •18.2.2. Способи добування
- •18.2.4. Хімічні властивості
- •18.2.3. Фізичні властивості
- •18.2.5. Окремі представники
- •299 Монокарбонові кислоти
- •18.3. Ароматичні монокарбонові кислоти
- •18.3.1. Способи добування
- •18.3.2. Фізичні властивості
- •18.3.3. Хімічні властивості
- •18.3.4. Окремі представники. Ідентифікація
- •303 Монокарбонові кислоти
- •18.4.1. Номенклатура та ізомерія
- •Назви деяких дикарбонових кислот
- •18.4.2. Способи добування
- •18.4.3. Фізичні властивості
- •18.4.4. Хімічні властивості
- •18.4.5. Окремі представники
- •309 Мриокар6онові кислоти
- •18.5. Ароматичні дикарбонові кислоти
- •310 Карбонові кислоти. Глава и
- •313 Монокарбонові кислоти
- •19.1.2. Способи добування
- •19.1. Галогенангідриди карбонових кислот (ацилгалогеніди)
- •19.1.1. Номенклатура
- •19.1.3. Фізичні властивості
- •19.1.4. Хімічні властивості
- •19.1.5. Окремі представники
- •19.2. Ангідриди карбонових кислот
- •19.2.1. Номенклатура
- •19.2.2. Способи добування
- •19.2.3. Фізичні властивості
- •19.2.4. Хімічні властивості
- •19.2.5. Окремі представники
- •19.3. Естери карбонових кислот
- •19.3.1. Номенклатура
- •19.3.3. Фізичні властивості
- •19.3.4. Хімічні властивості
- •19.3.5. Окремі представники
- •19.4. Жири
- •19.4.1. Номенклатура та ізомерія
- •19.4.2. Способи добування
- •19.4.3. Фізичні властивості
- •19.4.4. Хімічні властивості
- •19.4.5. Воски. Твіни
- •19.5. Аміди карбонових кислот
- •19.5.1. Номенклатура
- •Ацетамщ,
- •19.5.2. Способи добування
- •19.5.3. Фізичні властивості
- •19.5.4. Хімічні властивості
- •19.5.5. Окремі представники
- •19.6. Нітрили (ціаніди)
- •19.6.1. Номенклатура
- •19.6.2. Способи добування
- •19.6.3. Хімічні властивості
- •19.6.4. Окремі представники
- •20.1. Галогенокарбонові кислоти
- •20.1.1. Номенклатура
- •20.1.2. Способи добування
- •20.1.3. Фізичні та хімічні властивості
- •20.2. Гідроксикислоти
- •20.2.2. Оптична ізомерія
- •20.2.3. Аліфатичні пдроксикислоти
- •359 Гетерофункціональні карбонові кислоти
- •Фізичні та хімічні властивості
- •361 Гетерофункціональні карбонові кислоти
- •20.3. Амінокислоти
- •II Амінокислотами називаються похідні карбонових кислот, у вуглеводневому радикалі яких один або кілька атомів Гідрогену замінені аміногрупою.
- •20.3.1. Номенклатура та ізомерія
- •20.3.2. Способи добування
- •20.3.3. Фізичні та хімічні властивості
- •367 Гетерофункціональні карбонові кислоти
- •20.3.4. Окремі представники
- •0 Контрольні питання та вправи
- •21.1. Номенклатура та ізомерія
- •Глава 21
- •Глава 21
- •21.2.1. Способи добування
- •21.2.2. Фізичні властивості. Просторова будова
- •21.2.3. Хімічні властивості
- •Глава 21 378 — —
- •21.3. Ариламіни
- •Глава 21
- •21.3.2. Фізичні та хімічні властивості
- •А. Реакції за участю атома Нітрогену
- •Глава 21
- •Глава 21
- •21.4. Окремі представники. Застосування
- •В. Окислення ариламінів
- •Глава 21
- •Глава 21
- •22.1. Моносахариди
- •22.1.1. Класифікація та номенклатура
- •Глава 22
- •22.1.2. Стереоізомерія
- •Глава 22
- •22.1.3. Будова моносахаридів
- •Глава 22
- •Глава 22 402
- •Глава 22
- •22.1.4. Способи добування
- •22.1.5. Фізичні властивості
- •22.1.6. Хімічні властивості
- •Глава 22
- •Глава 22
- •Б. Реакції за участю циклічних форм
- •Глава 22
- •22.1.7. Окремі представники
- •Глава 22 412
- •Глава 22
- •22.2. Дисахариди
- •22.2.1. Відновні дисахариди
- •Глава 22
- •22.2.2. Невідновні дисахариди
- •14 Органічна хімія
- •Глава 22 418
- •22.3. Полісахариди
- •Глава 22 н он н он н он н он
- •Глава 22 422
- •Глава 22 424
- •425 Вуглеводи
- •Глава 23
- •Глава 23
- •23.1.1. Стереоізомерія
- •23.1.2. Фізичні властивості
- •23.1.3. Способи добування
- •23.1.4. Хімічні властивості
- •Глава 23
- •23.2. Будова пептидів і білків
- •Глава 23
- •23.3. Синтез пептидів та їх властивості
- •440 Глава 23
- •23.4. Функції білків в організмі
- •Нуклеїнові кислоти
- •24.1. Будова нуклеїнових кислот
- •Глава 24
- •Глава 24
- •24.2. Рибонуклеїнові (рнк) і дезоксирибонуклеїнові (днк) кислоти
- •Глава 24
- •Глава 24
- •Глава 25
- •Неомилювані ліпіди
- •Глава 25
- •Глава 9. Циклоалкани 86
- •Глава 10. Алкени 98
- •Глава 11. Алкадієни 122
- •Глава 12. Алкіни 135
- •Глава 13. Одноядерні арени 147
- •Глава 14. Природні джерела вуглеводнів 179
- •Глава 15. Гетероциклічні сполуки 187
- •Глава 16. Гідроксильні похідні вуглеводнів 212
- •Глава 17. Насичені альдегіди і кетони 256
- •Глава 18. Монокарбонові кислоти 280
- •Глава 19. Функціональні похідні карбонових кислот 314
- •Глава 20. Гетерофункціональні карбонові кислоти 346
- •Глава 21. Аміни 371
- •Глава 22. Вуглеводи 394 о
- •Глава 23. Білки 426 •
- •Глава 24. Нуклеїнові кислоти 444
- •Глава 25. Ліпіди 453
- •Органічна хімія
- •61002, Харків, вул. Пушкінська, 53.
- •61022, Харків, пл. Свободи, 5, Держпром, 6-й під'їзд, 6-й поверх.
- •61012, Харків, вул. Енгельса, 11.
263 Цясимені альдегіди і кетони
пература кипіння кетонів, як правило, вища, ніж ізомерних до
них альдегідів.
Нижчі альдегіди та кетони мають різкий запах, вищі — приємний запах, що нагадує квітковий.
Альдегіди та кетони добре розчиняються в органічних розчинниках, нижчі — розчинні у воді. Густина альдегідів та кетонів нижча за одиницю.
. ■ 17.4. ХІМІЧНІ ВЛАСТИВОСТІ
.о.
зр'-АО
Я»
Х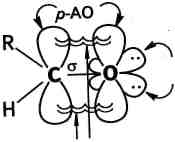 імічні
властивості альдегідів та кетонів
визначаються наявністю
в їх молекулі карбонільної групи, будову
якої зображено на рис.
17.1.
імічні
властивості альдегідів та кетонів
визначаються наявністю
в їх молекулі карбонільної групи, будову
якої зображено на рис.
17.1.
•н
к-с';
■
я-зв'язок Рис. 17.1. Електронна і просторова будова карбонільної групи
Атом Карбону карбонільної групи знаходиться в стані ^-гіб ридизації. Три а-зв'язки розташовані в одній площині під кутом ~120°. Негібридизована р-орбіталь атома Карбону перекривається з р-орбіталлю атома Оксигену, утворючи я-зв'язок. Атом Оксиге- ну, як більш електронегативний, притягує до себе о- та л-електро- ни подвійного зв'язку (останні більш рухливі). Унаслідок цього подвійний.зв'язок карбонільної групи сильно поляризований, на ^С+=П атомі Оксигену виникає частковий негативний заряд, а на "^ атомі Карбону — частковий позитивний.
Завдяки такій поляризації альдегіди та кетони здатні вступати в реакцію з нуклеофільними реагентами, які атакують атом Карбону карбонільної групи. Реакційна здатність карбонільних сполук визначається величиною часткового позитивного заряду на атомі Карбону СО-групи. Чим більший цей заряд, тим легше відбувається приєднання нуклеофілу.


8+^
5+>5+
& ї)
Крім того, алкільні радикали в молекулі кетону більше заважають підходу нуклеофілу до карбонільної групи.
Електроноакцепторні замісники відтягують електронну густину, тим самим збільшують позитивний заряд на атомі Карбону. Порівняйте величину заряду (5+) в таких сполуках:
н—СҐ н3с—сҐ с\гс—сҐ
^н ті лі
метаналь етаналь трихлороетаналь
Поряд з реакціями, що проходять з участю карбонільної групи, для альдегідів та кетонів характерні також перетворення по сс-атому Карбону.
Умовно реакції альдегідів та кетонів по карбонільній групі можна поділити на такі типи:
а) нуклеофільного приєднання;
б) конденсації;
в) з участю сс-карбонового атома;
г) полімеризації;
ґ) окиснення та відновлення.
А. Реакції нуклеофільного приєднання (Ам)
До реакцій А$ альдегідів та кетонів належать: приєднання синильної кислоти, натрій гідросульфіту, води, спиртів, взаємодія з магнійорганічними сполуками. Нуклеофільне приєднання починається з атаки нуклеофілом електронодефіцитного атома Карбону карбонільної групи.
Приєднання синильної кислоти. Синильна (ціановоднева) кислота приєднується до карбонільних сполук, утворюючи ціангідрини, або а-гідроксинітрили:
Насичені альдегіди і кетони
^_—— 265
8+і^и 8+ 8-
няс—сГ + н—ск «• н3с—сн—си
он
нітрил а-гідроксипропіонової кислоти
сн3
Н,С—СН2—£—СН3 + Н—СїЯ Н3С—СН2—С—СN
II-) І
„О нітрил а-метил- ОН
а-гідроксимасляної кислоти
Ціангідрини, що утворюються, можна легко гідролізувати до відповідних а-гідроксикислот.
Приєднання натрій гідросульфіту. Альдегіди, а також кетони, які містять угруповання СН3—СО—, реагують з натрій гідросульфітом (бісульфітом), утворюючи бісульфітні сполуки:
О /° ?Н
я—сС + =8—он «► а—с—803№+
^н \ - І 3
0-Иа+ Н
О ОН
О // Я— СҐ + :8—ОН К—С—80^а+
^сн3 \ І
о-№+ сн3
Кетони складнішої будови цієї реакції не дають. Бісульфітні сполуки малорозчинні у воді й виділяються у вигляді кристалічного осаду. Нагрівання з водним розчином мінеральної кислоти або натрій карбонату призводить до їх руйнування з утворенням вільного альдегіду або кетону.
І


267
Глава
1$
266
5+
8-
н—он
Положення
рівноваги визначається будовою
карбонільних спо-лук.
Формальдегід у воді майже повністю
гідратований, ацеталь-' дегід
— наполовину, а ацетон практично не
взаємодіє з водою. Гідрати
альдегідів існують тільки в розчині,
виділити їх неможли- ] во:
при перегонці вони розкладаються.
Існування гідратів доводять
за допомогою фізичних методів
дослідження.
У
деяких випадках, коли карбонільна
група зв'язана із сильним
електроноакцепторним замісником,
можна виділити гідрат, що
утворився. Наприклад, трихлорацетальдегід,
або хлораль, приєднуючи
молекулу води, перетворюється на
хлоральгідрат, який є
стійкою
кристалічною речовиною:
8+
6-
Н—ОН
Відокремити
воду від хлоральгідрату вдається
тільки дією сульфатної
кислоти. Хлоральгідрат застосовується
в медичній практиці
як заспокійливий та протисудомний
засіб.
Приєднання
спиртів. При
взаємодії альдегідів зі спиртами
утворюються
напівацеталі,
а
в присутності слідів мінеральних
кислот
—
ацетилі'.
О
^
К—С
Напівацеталі,
як правило, малостійкі. Ацеталі стійкі
в
лужному
середовищі, але легко гідролізуються
до вільного альдегіду в
розведених кислотах. Така властивість
ацеталів використовується
в
органічному
синтезі для захисту альдегідної групи.
8+ро
н
хлораль
+ К'—ОН
О—Н К—С—ОК'
і
напівацеталь
к-
-с
он
н
гідрат альдегіду, гем-аіол
ОН І/ОН С13С—С^
н
хлоральгідрат
О—К'
к—он(н+)
„ '1 іі«
тт
л >
К—С—ОК' + ЯгО
н
ацеталь
Насичені альдегіди і кетони
Кетони через низьку реакційну здатність і просторові перешкоди зі спиртами не взаємодіють, тому кеталі добувають іншими синтетичними методами.
Взаємодія з магнійорганічними сполуками. Альдегіди і кетони реагують з алкіл- і арилмагнійгалогенідами (реактивами Гріньяра) з утворенням продуктів приєднання по карбонільній групі, які гідролізуються в присутності розведених мінеральних кислот до спиртів:
■
8+
+ С2Н5—М§Вг
етилмагаійбромід
ацетальдегід
О—М§Вг
н3с-с-с2н5
нон, [н+і,
-Ме(ОН)Вг
ОН
і
н
бромомагнійалкоголят
_8- _ 8+_
- н3с-с-с2н5 н
о-
4
Н3С-С-СН3 + С2Н5-М8Вг
-3 8+
2-бутанол
он
8+
О—М§Вг
с—с,н, сн3
нон, [н+]^
-Мв(ОН)Вг
ацетон
н3с-
Н3С у ^21х5
-С—С2Н5
сн3
2-метил-2-бутанол
У випадку формальдегіду ^^^^^ та альдегідів дає вторинш спирти, а кетону- третШ£^ приєднання магнійорганічних сполук до альдепдш і кетонів ним з важливих способів одержання спиртів. Б. Реакції конденсації
Альдольна конденсація. Альдегіди, які м^^ГкЙкост^и при а-карбоновому атомі, у присутності ™*™™ Ши ць^му основи здатні вступати в реакцію альдольної «^ЇЇІтоїї»-
ків С—С і утворюють альооль — сполуку м шир ною групами:

268
А
ОН"
2Н3С—СҐ ^Н
он
н,с—сн—сн
р-гідроксимасляний альдегід
У слаболужному середовищі гідроксид-іон відщеплює прото від а-карбонового атома з утворенням енолят-аніона:
н2с—с:
ОН"
^ф
-н2о
н
Н2С—С^ Ті
енолят-іон •
