
- •Передмова
- •Вступ до органічної хімії
- •1.1. Предмет органічної хімії
- •1.2. Короткий огляд історії розвитку органічної хімії
- •Глава 1 6
- •1.3. Розвиток теоретичних уявлень про будову органічних сполук
- •Глава 1
- •1.4. Способи зображення органічних молекул
- •Глава 1
- •2.1. Класифікація органічних сполук
- •Глава 2
- •2.2. Номенклатура органічних сполук
- •Глава 2
- •Глава 2
- •ХїмГчний зв'язок
- •3.1. Типи хімічних зв'язків
- •3.2. Хімічний зв'язок в органічних сполуках
- •3.2.1. Гібридизація атомних орбіталей
- •3.2.2. Ковалентні о- і я-зв'язки
- •3.2.3. Основні характеристики ковалентних зв'язків
- •4.1. Індуктивний ефект
- •Глава 40
- •4.2. Мезомерний ефект (ефект спряження)*
- •Глава 4
- •Глава 4
- •4.4. Надспряження (гіперкон'югація)
- •Глава 4
- •Класифікація ізомерії ізомерія
- •48 Глава 5
- •5.2. Просторова ізомерія (стереоізомерія)
- •Глава 5
- •5.3. Способи зображення просторової будови
- •Глава 5
- •6.1. Кислотність і основність за теорією бренстеда
- •Глава 6
- •6.2. Типи органічних кислот і основ
- •Глава 6
- •6.3. Кислоти і основи льюїса
- •7.1. Поняття про типи механізмів реакцій
- •Глава 7
- •7.2. Поняття про типи органічних реакцій
- •Глава 7
- •Вуглеводні
- •8.1. Електронна та просторова будова алканів
- •8.2. Номенклатура
- •8 .3. Ізомерія
- •8.4. Способи добування
- •8.4.1. Природні джерела
- •8.4.2. Синтетичні методи добування
- •8.5. Фізичні властивості
- •8.6. Хімічні властивості
- •8.6.1. Реакції радикального заміщення (5*)
- •76 Вуглеводні. Глава 8
- •8.6.2. Крекінг
- •8.7. Окремі представники. Застосування
- •1. Напишіть структурні формули наведених вуглеводнів і назвіть їх за раціональною номенклатурою:
- •2. Напишіть структурні формули таких вуглеводнів і назвіть їх за но менклатурою шрас:
- •Ц иклоалкани
- •9.1. Класифікація та номенклатура
- •9.2. Ізомерія
- •9.3. Способи добування. Фізичні властивості
- •9.4. Будова циклоалканів
- •9.5. Хімічні властивості
- •9.6. Окремі представники. Застосування
- •4 Органічна хімія
- •10.1. Номенклатура
- •Перші члени гомологічного ряду алкенів
- •100 Ненасичені вуглеводні. Глава іо
- •10.2. Ізомерія
- •10.3. Електронна і просторова будова алкенів
- •10.4. Способи добування
- •10.5. Фізичні властивості
- •10.6. Хімічні властивості
- •109 Ненасичені вуглеводні. Глава 10 108
- •1 0.6.1. Реакції електрофільного приєднання (ае)
- •10.6.2. Реакції відновлення та окиснення
- •10.6.3. Полімеризація алкенів
- •10.6.4. Алільне галогенування алкенів
- •118 Ненасичені вуглеводні. Глава ю
- •10.7. Окремі представники. Застосування. Ідентифікація
- •0 Контрольні питання та вправи
- •Алкадієни
- •11.2. Будова алкадієнів
- •11.1. Номенклатура
- •11.3. Алкадієни зі спряженими зв'язками 11.3.1. Способи добування
- •11.3.2. Хімічні властивості
- •11.3.3. Натуральний і синтетичний каучук
- •11.4 Окремі представники. Застосування
- •12.1. Номенклатура та ізомерія
- •12.2. Електронна та просторова будова молекул алкінів
- •12.3. Способи добування
- •138 Ненасичені вуглеводні. Глава т2
- •12.4. Фізичні властивості
- •12.5. Хімічні властивості
- •12.5.1. Реакції електрофільного приєднання (ае)
- •12.5.2. Реакції заміщення
- •12.6. Окремі представники. Застосування
- •Одноядерні арени
- •13.1. Будова бензену. Ароматичність
- •13.2. Номенклатура та ізомерія
- •13.3. Способи добування 13.3.1. Природні джерела
- •13.3.2. Синтетичні методи добування
- •13.4. Фізичні властивості
- •13.5. Хімічні властивості
- •13.5.1. Реакції електрофільного заміщення (5£)
- •0/1Ноядєрні аРени
- •13.5.2. Реакції приєднання
- •13.5.3. Реакції окиснення
- •13.5.4. Галогенування гомологів бензену з участю бокового ланцюга
- •165 0ДнояДерн[арени
- •13.6. Вплив замісників у бензеновому кільці на напрямок та швидкість реакцій
- •Електрофільного заміщення
- •13.7. Орієнтація в дизаміщеному бензені
- •1 3.8. Окремі представники. Застосування
- •13.9. Представники багатоядерних аренів
- •13.9.1. Нафтален
- •13.9.2. Антрацен
- •14.1. Природний та попутний нафтовий гази
- •Глава 14
- •14.2. Нафта. Нафтопродукти
- •14.3. Коксування вугілля
- •Глава 1і0у глава Глава 14 186 !
- •15.1. Класифікація та номенклатура
- •15.2. Ароматичність гетероциклів
- •Глава 15
- •15.3. Кислотно-осНбВні властивості гетероциклів
- •15.4. П'ятичленні гетероциклічні сполуки з одним гетероатомом
- •15.4.1. Способи добування
- •15.4.2. Фізичні властивості
- •15.4.3. Хімічні властивості
- •Глава 15
- •15.4.4. Найважливіші похідні піролу
- •Глава 15
- •15.5. Шестичленні гетероциклічні сполуки з одним гетероатомом
- •Глава 15
- •Глава 15
- •В. Реакції відновлення і окиснення
- •15.6. П'яти-1 шестичленні гетероцикли з двома гетероатомами
- •208 Глава 15
- •15.7. Представники конденсованих систем гетероциклів
- •16.1. Одноатомні спирти
- •16.1.1. Номенклатура
- •Глава 16
- •16.1.2. Ізомерія
- •16.1.3. Фізичні властивості
- •Глава 1
- •16.1.4. Способи добування
- •16.1.5. Хімічні властивості
- •16.1.6. Ідентифікація спиртів
- •16.1.7. Окремі представники
- •230 Глава 16
- •16.2.1. Способи добування дво- і триатомних спиртів
- •16.2.2. Фізичні властивості
- •16.2.3. Хімічні властивості
- •16.2.4. Окремі представники
- •16.3.2. Способи добування
- •16.3. Одноатомні феноли 16.3.1. Номенклатура та ізомерія
- •16.3.4. Хімічні властивості
- •16.3.3. Фізичні властивості
- •249 Гідроксильні похідні вуглеводнів
- •В. Реакції відновлення і окиснення
- •255 Гідроксильні похідні вуглеводнів
- •17.1. Номенклатура та ізомерія
- •17.2. Способи добування
- •17.3. Фізичні властивості
- •263 Цясимені альдегіди і кетони
- •269 Насичені альдегіди і кетони
- •271 ИаСйчені альдегіди і кетони
- •17.5. Окремі представники
- •Монокарбонові кислоти
- •18.1. Насичені монокарбонові кислоти
- •18.1.1. Номенклатура та ізомерія
- •18.1.3. Фізичні властивості
- •18.1.4. Хімічні властивості
- •А. Кислотні властивості
- •Г. Окиснення та відновлення
- •18.1.5. Окремі представники
- •18.2. Ненасичені монокарбонові кислоти
- •18.2.1. Номенклатура та ізомерія
- •18.2.2. Способи добування
- •18.2.4. Хімічні властивості
- •18.2.3. Фізичні властивості
- •18.2.5. Окремі представники
- •299 Монокарбонові кислоти
- •18.3. Ароматичні монокарбонові кислоти
- •18.3.1. Способи добування
- •18.3.2. Фізичні властивості
- •18.3.3. Хімічні властивості
- •18.3.4. Окремі представники. Ідентифікація
- •303 Монокарбонові кислоти
- •18.4.1. Номенклатура та ізомерія
- •Назви деяких дикарбонових кислот
- •18.4.2. Способи добування
- •18.4.3. Фізичні властивості
- •18.4.4. Хімічні властивості
- •18.4.5. Окремі представники
- •309 Мриокар6онові кислоти
- •18.5. Ароматичні дикарбонові кислоти
- •310 Карбонові кислоти. Глава и
- •313 Монокарбонові кислоти
- •19.1.2. Способи добування
- •19.1. Галогенангідриди карбонових кислот (ацилгалогеніди)
- •19.1.1. Номенклатура
- •19.1.3. Фізичні властивості
- •19.1.4. Хімічні властивості
- •19.1.5. Окремі представники
- •19.2. Ангідриди карбонових кислот
- •19.2.1. Номенклатура
- •19.2.2. Способи добування
- •19.2.3. Фізичні властивості
- •19.2.4. Хімічні властивості
- •19.2.5. Окремі представники
- •19.3. Естери карбонових кислот
- •19.3.1. Номенклатура
- •19.3.3. Фізичні властивості
- •19.3.4. Хімічні властивості
- •19.3.5. Окремі представники
- •19.4. Жири
- •19.4.1. Номенклатура та ізомерія
- •19.4.2. Способи добування
- •19.4.3. Фізичні властивості
- •19.4.4. Хімічні властивості
- •19.4.5. Воски. Твіни
- •19.5. Аміди карбонових кислот
- •19.5.1. Номенклатура
- •Ацетамщ,
- •19.5.2. Способи добування
- •19.5.3. Фізичні властивості
- •19.5.4. Хімічні властивості
- •19.5.5. Окремі представники
- •19.6. Нітрили (ціаніди)
- •19.6.1. Номенклатура
- •19.6.2. Способи добування
- •19.6.3. Хімічні властивості
- •19.6.4. Окремі представники
- •20.1. Галогенокарбонові кислоти
- •20.1.1. Номенклатура
- •20.1.2. Способи добування
- •20.1.3. Фізичні та хімічні властивості
- •20.2. Гідроксикислоти
- •20.2.2. Оптична ізомерія
- •20.2.3. Аліфатичні пдроксикислоти
- •359 Гетерофункціональні карбонові кислоти
- •Фізичні та хімічні властивості
- •361 Гетерофункціональні карбонові кислоти
- •20.3. Амінокислоти
- •II Амінокислотами називаються похідні карбонових кислот, у вуглеводневому радикалі яких один або кілька атомів Гідрогену замінені аміногрупою.
- •20.3.1. Номенклатура та ізомерія
- •20.3.2. Способи добування
- •20.3.3. Фізичні та хімічні властивості
- •367 Гетерофункціональні карбонові кислоти
- •20.3.4. Окремі представники
- •0 Контрольні питання та вправи
- •21.1. Номенклатура та ізомерія
- •Глава 21
- •Глава 21
- •21.2.1. Способи добування
- •21.2.2. Фізичні властивості. Просторова будова
- •21.2.3. Хімічні властивості
- •Глава 21 378 — —
- •21.3. Ариламіни
- •Глава 21
- •21.3.2. Фізичні та хімічні властивості
- •А. Реакції за участю атома Нітрогену
- •Глава 21
- •Глава 21
- •21.4. Окремі представники. Застосування
- •В. Окислення ариламінів
- •Глава 21
- •Глава 21
- •22.1. Моносахариди
- •22.1.1. Класифікація та номенклатура
- •Глава 22
- •22.1.2. Стереоізомерія
- •Глава 22
- •22.1.3. Будова моносахаридів
- •Глава 22
- •Глава 22 402
- •Глава 22
- •22.1.4. Способи добування
- •22.1.5. Фізичні властивості
- •22.1.6. Хімічні властивості
- •Глава 22
- •Глава 22
- •Б. Реакції за участю циклічних форм
- •Глава 22
- •22.1.7. Окремі представники
- •Глава 22 412
- •Глава 22
- •22.2. Дисахариди
- •22.2.1. Відновні дисахариди
- •Глава 22
- •22.2.2. Невідновні дисахариди
- •14 Органічна хімія
- •Глава 22 418
- •22.3. Полісахариди
- •Глава 22 н он н он н он н он
- •Глава 22 422
- •Глава 22 424
- •425 Вуглеводи
- •Глава 23
- •Глава 23
- •23.1.1. Стереоізомерія
- •23.1.2. Фізичні властивості
- •23.1.3. Способи добування
- •23.1.4. Хімічні властивості
- •Глава 23
- •23.2. Будова пептидів і білків
- •Глава 23
- •23.3. Синтез пептидів та їх властивості
- •440 Глава 23
- •23.4. Функції білків в організмі
- •Нуклеїнові кислоти
- •24.1. Будова нуклеїнових кислот
- •Глава 24
- •Глава 24
- •24.2. Рибонуклеїнові (рнк) і дезоксирибонуклеїнові (днк) кислоти
- •Глава 24
- •Глава 24
- •Глава 25
- •Неомилювані ліпіди
- •Глава 25
- •Глава 9. Циклоалкани 86
- •Глава 10. Алкени 98
- •Глава 11. Алкадієни 122
- •Глава 12. Алкіни 135
- •Глава 13. Одноядерні арени 147
- •Глава 14. Природні джерела вуглеводнів 179
- •Глава 15. Гетероциклічні сполуки 187
- •Глава 16. Гідроксильні похідні вуглеводнів 212
- •Глава 17. Насичені альдегіди і кетони 256
- •Глава 18. Монокарбонові кислоти 280
- •Глава 19. Функціональні похідні карбонових кислот 314
- •Глава 20. Гетерофункціональні карбонові кислоти 346
- •Глава 21. Аміни 371
- •Глава 22. Вуглеводи 394 о
- •Глава 23. Білки 426 •
- •Глава 24. Нуклеїнові кислоти 444
- •Глава 25. Ліпіди 453
- •Органічна хімія
- •61002, Харків, вул. Пушкінська, 53.
- •61022, Харків, пл. Свободи, 5, Держпром, 6-й під'їзд, 6-й поверх.
- •61012, Харків, вул. Енгельса, 11.
249 Гідроксильні похідні вуглеводнів
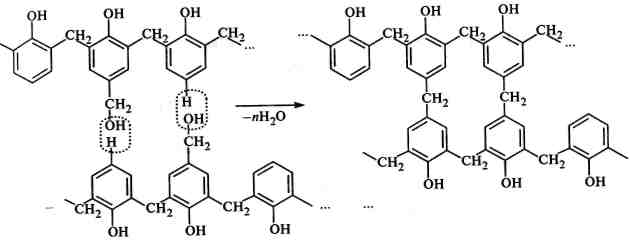
Молекулярна маса фенолоформальдегідних смол відносно невелика і становить 1500—2000. Полімери мають лінійну будову або розгалужену. На основі цих полімерів здобувають наповнені пластмаси — фенопласті*. Для цього додають деякі наповнювачі, пластифікатори. При підвищеній температурі та тиску лінійні макромолекули утворюють полімери просторової будови:
Фенопласт знаходять застосування в електро- та гумотехніч-ній промисловості, з них виробляють штепселі, розетки, телефонні трубки тощо.
Фенопласт — конструкційний матеріал в літако- та суднобудуванні. Вироби на основі фенолоформальдегідних пластмас відрізняються високою міцністю, тепло- і кислотостійкістю, діелектричними властивостями.
Фенолоформальдегідні смоли є також основами для іонітів (іонообмінні смоли), які необхідні для демінералізації води, очищення речовин, зокрема лікарських препаратів.
В. Реакції відновлення і окиснення
При каталітичному гідруванні, наприклад, дією водню в при сутності N1, феноли відновлюються до циклоалканолів: ОН ОН
зн,
№
І![]()
![]()
циклогексанол
Окиснення фенолів відбувається досить складно. Залежно від пРироди окисника утворюються різні продукти. Наприклад, Хром (VI) оксид у кислому середовищі окиснює фенол до л-бензо-хінону:
Г лава
}(;
лава
}(;
о
ОН
![]()
![]()
СЮ3; н+
250
+ Сг(ОН)3
![]()
О
При окисненні фенолу калій персульфатом К28208 в лужному середовищі утворюється гідрохінон:
ОН
![]()
,
ОН
![]()
![]()
К25208; ОН"
ОН 16.3.5. НАЙВАЖЛИВІШІ ПРЕДСТАВНИКИ
Фенол С6Н5ОН. Являє собою безбарвні, що рожевіють на повітрі внаслідок окиснення, кристали (т. пл. 43 °С, т. кип. 182 °С), розчиняється у воді (при 15 °С — близько 8 %). Має антисептичні властивості. У вигляді 5 %-вого водного розчину (карболова кислота) використовується як дезинфікувальний засіб. Знайшов широке застосування у виробництві пластмас, барвників, вибухових речовин, лікарських засобів. Фенол токсичний, може спричиняти опіки шкіри.

о-, м-, л-Крезоли. Необхідні для виготовлення пластмас, барвників та ін. Суміш ізомерних крезолів з милами використовується як дезинфікувальний засіб у ветеринарній практиці (лізол, креолін).

СН(СН3)2
Тимол (2-ізопропіл-5-метилфе-нол). Кристалічна речовина (т. пл. 50 °С, т. кип. 232,9 °С). Добре розчинний в етанолі, діетиловому етері, бензені. Застосовується в медицині як антисептичний та протигельмін-тний засіб. Використовується у виробництві ментолу.
гідроксильні похідні вуглеводнів ,
Для більшості фенолів характерна кольорова реакція з фе-пум (НІ) хлоридом. Унаслідок реакції утворюються комплексні сполуки, що мають інтенсивне забарвлення. Наприклад, фенол з РеС13 утворює суміш комплексних сполук С6Н5ОРеС12, (С6Н50)2РеС1, /С6Н50)3Ре, забарвлених у фіолетовий колір. Крезоли з РеС13 дають блакитне забарвлення. Феноли з вільними орто- та пара-по-ложеннями знебарвлюють бромну воду і утворюють при цьому продукти заміщення, які випадають в осад.
16.4. ДВО-1 ТРИАТОМНІ ФЕНОЛИ
Назви дво- та триатомних фенолів утворюють за загальними правилами номенклатури ШРАС. Для найпростіших сполук застосовують і тривіальні назви.
он он он
.


.![]() он *
он *
гідрохінон, 1,4-дигідроксибензен
он
пірокатехін, 1,2-дигідроксибензен
он



он
но
он
^ч^
резорцин, 1,3-дигідроксибензен
пірогалол, 1 ,2,3-тригідроксибензен
флороглюцин, оксигідрохінон,
1,3,5-тригідроксибензен 1,2,4-тригідроксибензен
Пірокатехін (о-дигідроксибензен). Кристалічна ре- ґ^^ґ човина, розчинна у воді та в спиртах (т. пл. 105 °С, | |
т. кип. 245 °С). На світлі та повітрі набуває корич- 1<^/1\он невого забарвлення внаслідок окиснення. Виявляє антисептичні властивості, використовується як вихідна речовина в синтезі лікарського препарату адреналіну; знайшов застосуванні У фотографії як проявна речовина.

Глава
і
252
Резорцин (л<-дигідроксибензен). Кристаліч, на речовина, розчинна у воді (т. пл. 110 °С-т. кип. 178 °С). Застосовується у виробництві барвників, резорциноформальдегідних смол, Ефективний антисептик при лікуванні шкірних захворювань (у складі примочок і мазей). Резорцин подразнює шкіру та слизові оболонки.
Г, Л Адреналін (а-3,4-дигідроксифе-
НО
-СН,
І 2

/ \\—ги—гн ніл-Р-метиламіноетанол). Криста-
лічна речовина, добре розчинна! в гарячій воді. Адреналін є гормоном, який виробляє внутрішня, мозкова частина надниркових залоз. Бере участь у регуляції вуглеводневого та жирового обмінів. Застосовується в медичній практиці у вигляді гідрохлориду або гідротартрату завдяки здатності звужувати дрібні кровоносні судини, підвищувати артеріальний тиск, стимулювати діяльність серця тощо.
НО
НО

П ірогалол
(1,2,3-тригідроксибензен). Біла
кристалічна
речовина, розчинна у воді, спиртах (т.
пл. 134 °С, т. кип. 309 °С). На світлі темніє.
Сильний
відновник. Надзвичайно швидко реагує
з
киснем у лужному розчині, тому
використовується для поглинання 02
в газоаналізаторах. Використовується
у виробництві барвників, як відновник
при органічному синтезі, проявник у
фотографії.
ірогалол
(1,2,3-тригідроксибензен). Біла
кристалічна
речовина, розчинна у воді, спиртах (т.
пл. 134 °С, т. кип. 309 °С). На світлі темніє.
Сильний
відновник. Надзвичайно швидко реагує
з
киснем у лужному розчині, тому
використовується для поглинання 02
в газоаналізаторах. Використовується
у виробництві барвників, як відновник
при органічному синтезі, проявник у
фотографії.
он
НО
Флороглюцин (1,3,5-тригідроксибензен). Кристалічна речовина, розчинна в спиртах і малорозчинна у воді (т. пл. 223 °С), сублімується. Використовується також в аналізі як аналітичний реагент.
КОНТРОЛЬНІ ПИТАННЯ ТА ВПРАВИ
є) етилбутил-/зо-бутилкарбінол; є) метил-втор-бутл-трет-бутилкарбінол;
ж) /зо-пропілалілкарбінол:
з) метилпропаргілкарбінол; и) етилфенілкарбінол.
а) треш -бутиловий спирт;
б) /зо-аміловий спирт;
в) диметилетилкарінол;
г) метилвінилкарбінол; ґ) аліловий спирт;
д) бензиловий спирт;
Назвіть їх за систематичною номенклатурою.
1. Наведіть структурні формули таких сполук:
Гідроксильні похідні вуглеводнів
2. Назвіть наведені сполуки за двома номенклатурами:
а) (СН3)2СНСН(ОН)СН3; ґ) СН3СНВгСН2ОН;
б) (СН3)3СОН; д) (СН3)2С(ОН)—С(ОН)(СН3)2;
в) (СН3)3ССН2ОН; є) (СН3)2СНСН(ОН)СН2СН(СН3)2.
г) СН2=СНСН2ОН;
3. Напишіть структурні формули ізомерних спиртів, які відповідають формулі С5НиОН . Назвіть їх за систематичною та раціональною номенклатурами. Для кожного ізомеру розгляньте реакцію внут- рішньомолекулярної дегідратації. Назвіть продукти.
На прикладі метанолу, метантіолу (СН35Н), метанаміну (СН3ИН2) поясніть, як наявність водневого зв'язку впливає на фізичні властивості спиртів. Яка з наведених сполук виявляє більш виражений кислотний характер і чому?
Розташуйте наведені сполуки за порядком зменшення кислотних властивостей:
а) пропін; етанол; вода; етанамін; етантіол;
б) 1-пропанол; метанол; 1-бутанол; етанол;
в) 2-метил-2-пропанол; 1-пропанол; 2-пропанол;
г) 1,2-етандиол; етанол; 1,2,3-пропантриол; ґ) ізомерні бутилові спирти.
Відповідь обґрунтуйте.
Наведіть 5—7 способів здобування 2-бутанолу та 1-пропанолу. Назвіть вихідні речовини та вкажіть умови перебігу реакцій.
Здійсніть перетворення, використовуючи тільки неорганічні сполуки:
а) ізобутиловий спирт /и/>е/п-бутиловий спирт;
б) метанол диметилкарбінол;
в) 1-пропанол діізопропіловий етер;
г) вапняк трет-аміловий спирт;
г) 1-бромопропан 2-метил-2-пентанол;
д) етилен »• 2-етоксиетанол;
є) брометан "і- 2-бутанол;
є) етанол "- 1-бутанол.
8. Здійсніть хімічні перетворення:
Н,0, Не2* СН,МвВг Н,0 РС15
а) НО=СН ■
№ 1 —5-!—
№ 2 -1-
№ 3 —~
№ОН спирт, р-н Н->0(Н+) [О)
►
№ 4 —^—
№
5 2 •
№
6 *
№
7
СН,С1(А1СЦ) С1,(Лу) N304(420) „ [О]
б) бензен ———Ч— № 1 — № 2 -~ № 3 № 4
№5
|сн3соон, н+
Г
 лава
16
254
лава
16
254
, ~„„ 1500 °С • ■'' Н-,0, Щ2+ , [Н] ■„ N3
в) 2СН4 г
№ 1 2 >
№ 2 р-і* № 3
СНЛ НС1
► № 4 3-~ № 5 № 6
СІ, (Ік) N304, Н,0 ЗІ,(ОН-)
г) СН3—СН2—СН3 ——- № 1 -±~ № 2 —
-
№
З №ОН-
№ 4 + № 5
С12(Ау) хг №ОН(Н20) С12 №ОН (Н20)
г) пропен —-—- № 1 *•* № 2 —-* № 3 —
КН50,, / °С НВг
№ 4 ► № 5 ► № 6
9. Напишіть структурні формули сполук і назвіть їх за систематичною номенклатурою:
а) л-етилфенол; д) и-бромофенол;
б) .м-крезол; є) р-фенілпропіловий спирт;
в) о-окситолуен; є) я-бромобензиловий спирт;
г) ош-триоксибензен; ж) етил-о-толілкарбінол. ґ) етилфенілбензилкарбінол;
10. Розташуйте наведені сполуки за порядком зменшення кислотних властивостей:
а) фенол; вода; карбонатна кислота; етанол;
б) тіофенол; етанол; фенол;
в) л-нітрофенол; бензиловий спирт; 2,4-динітрофенол; 2,4,6- тринітрофенол;
г) я-крезол; л-хлорофенол; я-метоксифенол; фенол; и-нітрофенол. Відповідь обгрунтуйте.
11. Порівняйте відношення фенолу і бензилового спирту до дії таких реагентів:
а) N3; б) №ОН (Н20); в) НАс (Н2804); г) РС15; ґ) Н>ТОз (к);
д) Вг2 (Н20).
Напишіть рівняння відповідних реакцій, назвіть продукти.
12. Назвіть наведені сполуки за систематичною номенклатурою:
Н3С НО СН3
у7"снз б>С1-^
НО С2Н5
а![]() )
і
У-СН, б)
СІ—(ч
/)^ОН в)
)
і
У-СН, б)
СІ—(ч
/)^ОН в)
