- •Передмова
- •Вступ до органічної хімії
- •1.1. Предмет органічної хімії
- •1.2. Короткий огляд історії розвитку органічної хімії
- •Глава 1 6
- •1.3. Розвиток теоретичних уявлень про будову органічних сполук
- •Глава 1
- •1.4. Способи зображення органічних молекул
- •Глава 1
- •2.1. Класифікація органічних сполук
- •Глава 2
- •2.2. Номенклатура органічних сполук
- •Глава 2
- •Глава 2
- •ХїмГчний зв'язок
- •3.1. Типи хімічних зв'язків
- •3.2. Хімічний зв'язок в органічних сполуках
- •3.2.1. Гібридизація атомних орбіталей
- •3.2.2. Ковалентні о- і я-зв'язки
- •3.2.3. Основні характеристики ковалентних зв'язків
- •4.1. Індуктивний ефект
- •Глава 40
- •4.2. Мезомерний ефект (ефект спряження)*
- •Глава 4
- •Глава 4
- •4.4. Надспряження (гіперкон'югація)
- •Глава 4
- •Класифікація ізомерії ізомерія
- •48 Глава 5
- •5.2. Просторова ізомерія (стереоізомерія)
- •Глава 5
- •5.3. Способи зображення просторової будови
- •Глава 5
- •6.1. Кислотність і основність за теорією бренстеда
- •Глава 6
- •6.2. Типи органічних кислот і основ
- •Глава 6
- •6.3. Кислоти і основи льюїса
- •7.1. Поняття про типи механізмів реакцій
- •Глава 7
- •7.2. Поняття про типи органічних реакцій
- •Глава 7
- •Вуглеводні
- •8.1. Електронна та просторова будова алканів
- •8.2. Номенклатура
- •8 .3. Ізомерія
- •8.4. Способи добування
- •8.4.1. Природні джерела
- •8.4.2. Синтетичні методи добування
- •8.5. Фізичні властивості
- •8.6. Хімічні властивості
- •8.6.1. Реакції радикального заміщення (5*)
- •76 Вуглеводні. Глава 8
- •8.6.2. Крекінг
- •8.7. Окремі представники. Застосування
- •1. Напишіть структурні формули наведених вуглеводнів і назвіть їх за раціональною номенклатурою:
- •2. Напишіть структурні формули таких вуглеводнів і назвіть їх за но менклатурою шрас:
- •Ц иклоалкани
- •9.1. Класифікація та номенклатура
- •9.2. Ізомерія
- •9.3. Способи добування. Фізичні властивості
- •9.4. Будова циклоалканів
- •9.5. Хімічні властивості
- •9.6. Окремі представники. Застосування
- •4 Органічна хімія
- •10.1. Номенклатура
- •Перші члени гомологічного ряду алкенів
- •100 Ненасичені вуглеводні. Глава іо
- •10.2. Ізомерія
- •10.3. Електронна і просторова будова алкенів
- •10.4. Способи добування
- •10.5. Фізичні властивості
- •10.6. Хімічні властивості
- •109 Ненасичені вуглеводні. Глава 10 108
- •1 0.6.1. Реакції електрофільного приєднання (ае)
- •10.6.2. Реакції відновлення та окиснення
- •10.6.3. Полімеризація алкенів
- •10.6.4. Алільне галогенування алкенів
- •118 Ненасичені вуглеводні. Глава ю
- •10.7. Окремі представники. Застосування. Ідентифікація
- •0 Контрольні питання та вправи
- •Алкадієни
- •11.2. Будова алкадієнів
- •11.1. Номенклатура
- •11.3. Алкадієни зі спряженими зв'язками 11.3.1. Способи добування
- •11.3.2. Хімічні властивості
- •11.3.3. Натуральний і синтетичний каучук
- •11.4 Окремі представники. Застосування
- •12.1. Номенклатура та ізомерія
- •12.2. Електронна та просторова будова молекул алкінів
- •12.3. Способи добування
- •138 Ненасичені вуглеводні. Глава т2
- •12.4. Фізичні властивості
- •12.5. Хімічні властивості
- •12.5.1. Реакції електрофільного приєднання (ае)
- •12.5.2. Реакції заміщення
- •12.6. Окремі представники. Застосування
- •Одноядерні арени
- •13.1. Будова бензену. Ароматичність
- •13.2. Номенклатура та ізомерія
- •13.3. Способи добування 13.3.1. Природні джерела
- •13.3.2. Синтетичні методи добування
- •13.4. Фізичні властивості
- •13.5. Хімічні властивості
- •13.5.1. Реакції електрофільного заміщення (5£)
- •0/1Ноядєрні аРени
- •13.5.2. Реакції приєднання
- •13.5.3. Реакції окиснення
- •13.5.4. Галогенування гомологів бензену з участю бокового ланцюга
- •165 0ДнояДерн[арени
- •13.6. Вплив замісників у бензеновому кільці на напрямок та швидкість реакцій
- •Електрофільного заміщення
- •13.7. Орієнтація в дизаміщеному бензені
- •1 3.8. Окремі представники. Застосування
- •13.9. Представники багатоядерних аренів
- •13.9.1. Нафтален
- •13.9.2. Антрацен
- •14.1. Природний та попутний нафтовий гази
- •Глава 14
- •14.2. Нафта. Нафтопродукти
- •14.3. Коксування вугілля
- •Глава 1і0у глава Глава 14 186 !
- •15.1. Класифікація та номенклатура
- •15.2. Ароматичність гетероциклів
- •Глава 15
- •15.3. Кислотно-осНбВні властивості гетероциклів
- •15.4. П'ятичленні гетероциклічні сполуки з одним гетероатомом
- •15.4.1. Способи добування
- •15.4.2. Фізичні властивості
- •15.4.3. Хімічні властивості
- •Глава 15
- •15.4.4. Найважливіші похідні піролу
- •Глава 15
- •15.5. Шестичленні гетероциклічні сполуки з одним гетероатомом
- •Глава 15
- •Глава 15
- •В. Реакції відновлення і окиснення
- •15.6. П'яти-1 шестичленні гетероцикли з двома гетероатомами
- •208 Глава 15
- •15.7. Представники конденсованих систем гетероциклів
- •16.1. Одноатомні спирти
- •16.1.1. Номенклатура
- •Глава 16
- •16.1.2. Ізомерія
- •16.1.3. Фізичні властивості
- •Глава 1
- •16.1.4. Способи добування
- •16.1.5. Хімічні властивості
- •16.1.6. Ідентифікація спиртів
- •16.1.7. Окремі представники
- •230 Глава 16
- •16.2.1. Способи добування дво- і триатомних спиртів
- •16.2.2. Фізичні властивості
- •16.2.3. Хімічні властивості
- •16.2.4. Окремі представники
- •16.3.2. Способи добування
- •16.3. Одноатомні феноли 16.3.1. Номенклатура та ізомерія
- •16.3.4. Хімічні властивості
- •16.3.3. Фізичні властивості
- •249 Гідроксильні похідні вуглеводнів
- •В. Реакції відновлення і окиснення
- •255 Гідроксильні похідні вуглеводнів
- •17.1. Номенклатура та ізомерія
- •17.2. Способи добування
- •17.3. Фізичні властивості
- •263 Цясимені альдегіди і кетони
- •269 Насичені альдегіди і кетони
- •271 ИаСйчені альдегіди і кетони
- •17.5. Окремі представники
- •Монокарбонові кислоти
- •18.1. Насичені монокарбонові кислоти
- •18.1.1. Номенклатура та ізомерія
- •18.1.3. Фізичні властивості
- •18.1.4. Хімічні властивості
- •А. Кислотні властивості
- •Г. Окиснення та відновлення
- •18.1.5. Окремі представники
- •18.2. Ненасичені монокарбонові кислоти
- •18.2.1. Номенклатура та ізомерія
- •18.2.2. Способи добування
- •18.2.4. Хімічні властивості
- •18.2.3. Фізичні властивості
- •18.2.5. Окремі представники
- •299 Монокарбонові кислоти
- •18.3. Ароматичні монокарбонові кислоти
- •18.3.1. Способи добування
- •18.3.2. Фізичні властивості
- •18.3.3. Хімічні властивості
- •18.3.4. Окремі представники. Ідентифікація
- •303 Монокарбонові кислоти
- •18.4.1. Номенклатура та ізомерія
- •Назви деяких дикарбонових кислот
- •18.4.2. Способи добування
- •18.4.3. Фізичні властивості
- •18.4.4. Хімічні властивості
- •18.4.5. Окремі представники
- •309 Мриокар6онові кислоти
- •18.5. Ароматичні дикарбонові кислоти
- •310 Карбонові кислоти. Глава и
- •313 Монокарбонові кислоти
- •19.1.2. Способи добування
- •19.1. Галогенангідриди карбонових кислот (ацилгалогеніди)
- •19.1.1. Номенклатура
- •19.1.3. Фізичні властивості
- •19.1.4. Хімічні властивості
- •19.1.5. Окремі представники
- •19.2. Ангідриди карбонових кислот
- •19.2.1. Номенклатура
- •19.2.2. Способи добування
- •19.2.3. Фізичні властивості
- •19.2.4. Хімічні властивості
- •19.2.5. Окремі представники
- •19.3. Естери карбонових кислот
- •19.3.1. Номенклатура
- •19.3.3. Фізичні властивості
- •19.3.4. Хімічні властивості
- •19.3.5. Окремі представники
- •19.4. Жири
- •19.4.1. Номенклатура та ізомерія
- •19.4.2. Способи добування
- •19.4.3. Фізичні властивості
- •19.4.4. Хімічні властивості
- •19.4.5. Воски. Твіни
- •19.5. Аміди карбонових кислот
- •19.5.1. Номенклатура
- •Ацетамщ,
- •19.5.2. Способи добування
- •19.5.3. Фізичні властивості
- •19.5.4. Хімічні властивості
- •19.5.5. Окремі представники
- •19.6. Нітрили (ціаніди)
- •19.6.1. Номенклатура
- •19.6.2. Способи добування
- •19.6.3. Хімічні властивості
- •19.6.4. Окремі представники
- •20.1. Галогенокарбонові кислоти
- •20.1.1. Номенклатура
- •20.1.2. Способи добування
- •20.1.3. Фізичні та хімічні властивості
- •20.2. Гідроксикислоти
- •20.2.2. Оптична ізомерія
- •20.2.3. Аліфатичні пдроксикислоти
- •359 Гетерофункціональні карбонові кислоти
- •Фізичні та хімічні властивості
- •361 Гетерофункціональні карбонові кислоти
- •20.3. Амінокислоти
- •II Амінокислотами називаються похідні карбонових кислот, у вуглеводневому радикалі яких один або кілька атомів Гідрогену замінені аміногрупою.
- •20.3.1. Номенклатура та ізомерія
- •20.3.2. Способи добування
- •20.3.3. Фізичні та хімічні властивості
- •367 Гетерофункціональні карбонові кислоти
- •20.3.4. Окремі представники
- •0 Контрольні питання та вправи
- •21.1. Номенклатура та ізомерія
- •Глава 21
- •Глава 21
- •21.2.1. Способи добування
- •21.2.2. Фізичні властивості. Просторова будова
- •21.2.3. Хімічні властивості
- •Глава 21 378 — —
- •21.3. Ариламіни
- •Глава 21
- •21.3.2. Фізичні та хімічні властивості
- •А. Реакції за участю атома Нітрогену
- •Глава 21
- •Глава 21
- •21.4. Окремі представники. Застосування
- •В. Окислення ариламінів
- •Глава 21
- •Глава 21
- •22.1. Моносахариди
- •22.1.1. Класифікація та номенклатура
- •Глава 22
- •22.1.2. Стереоізомерія
- •Глава 22
- •22.1.3. Будова моносахаридів
- •Глава 22
- •Глава 22 402
- •Глава 22
- •22.1.4. Способи добування
- •22.1.5. Фізичні властивості
- •22.1.6. Хімічні властивості
- •Глава 22
- •Глава 22
- •Б. Реакції за участю циклічних форм
- •Глава 22
- •22.1.7. Окремі представники
- •Глава 22 412
- •Глава 22
- •22.2. Дисахариди
- •22.2.1. Відновні дисахариди
- •Глава 22
- •22.2.2. Невідновні дисахариди
- •14 Органічна хімія
- •Глава 22 418
- •22.3. Полісахариди
- •Глава 22 н он н он н он н он
- •Глава 22 422
- •Глава 22 424
- •425 Вуглеводи
- •Глава 23
- •Глава 23
- •23.1.1. Стереоізомерія
- •23.1.2. Фізичні властивості
- •23.1.3. Способи добування
- •23.1.4. Хімічні властивості
- •Глава 23
- •23.2. Будова пептидів і білків
- •Глава 23
- •23.3. Синтез пептидів та їх властивості
- •440 Глава 23
- •23.4. Функції білків в організмі
- •Нуклеїнові кислоти
- •24.1. Будова нуклеїнових кислот
- •Глава 24
- •Глава 24
- •24.2. Рибонуклеїнові (рнк) і дезоксирибонуклеїнові (днк) кислоти
- •Глава 24
- •Глава 24
- •Глава 25
- •Неомилювані ліпіди
- •Глава 25
- •Глава 9. Циклоалкани 86
- •Глава 10. Алкени 98
- •Глава 11. Алкадієни 122
- •Глава 12. Алкіни 135
- •Глава 13. Одноядерні арени 147
- •Глава 14. Природні джерела вуглеводнів 179
- •Глава 15. Гетероциклічні сполуки 187
- •Глава 16. Гідроксильні похідні вуглеводнів 212
- •Глава 17. Насичені альдегіди і кетони 256
- •Глава 18. Монокарбонові кислоти 280
- •Глава 19. Функціональні похідні карбонових кислот 314
- •Глава 20. Гетерофункціональні карбонові кислоти 346
- •Глава 21. Аміни 371
- •Глава 22. Вуглеводи 394 о
- •Глава 23. Білки 426 •
- •Глава 24. Нуклеїнові кислоти 444
- •Глава 25. Ліпіди 453
- •Органічна хімія
- •61002, Харків, вул. Пушкінська, 53.
- •61022, Харків, пл. Свободи, 5, Держпром, 6-й під'їзд, 6-й поверх.
- •61012, Харків, вул. Енгельса, 11.
16.3.3. Фізичні властивості
Найпростіші феноли являють собою в'язкі рідини або низько плавкі тверді речовини з дуже специфічним стійким запахом («карболовий запах»). Фенол розчинний у воді (9 частин на 100 частий
феноксид-іон резонансні структури феноксид-іона
Кислотно-основний процес можна зобразити такою схемою:
вн![]()
спряжена кислота
кислота
феноксид-іон (спряжена основа)
244
Глава 16 \
Гідроксильні похідні вуглеводнів
245

С9Н,
+ N381
С6Н5—ОН + №ОН ^^ С6Н5—0^а+ + Н20
На відміну від фенолів, спирти як слабкі ОН-кислоти здатні утворювати алкоголяти тільки при взаємодії з лужними металами.
У водному розчині феноляти лужних металів частково гідролі-зовані (як солі слабких кислот і сильних основ), і тому їх розчини мають лужну реакцію. Під дією розчинів мінеральних кислот, карбонових кислот або карбонатної кислоти із солей здобувають вільні феноли:
С6Н5(Жа + С02 + Н20 С6Н5ОН + МаНС03
На кислотність фенолів значний вплив справляють замісники в ароматичному ядрі. Так, уведення в бензенове ядро молекули фенолу електроноакцепторних замісників (М02, СГ4, Наї та ін.) посилює кислотні властивості. Наприклад, л-нітрофенол — сильніша кислота, ніж фенол. А введення в и-положення електронодо-норних замісників (—>Ш2, —ОСН3 та інші) призводить до зниження кислотності, оскільки при цьому зменшується зміщення електронів зв'язку О—Н до атома Оксигену, що утруднює відрив протона:
о—н
н3с—о
- 2^0-^-"
2^0-^-"
Утворення етерів та естерів. При взаємодії фенолятів з галоген-алканами утворюються етери (реакція Вільямсона). Алкілування по атому Оксигену називають О-алкілуванням.
![]()
С2Н5Вг
№+
-2і х5
О
етилфеніловий етер
Аналогічно відбувається реакція утворення естерів взаємодією фенолят-іона з ацилуючими реагентами — галогенангідридами карбонових кислот:
Н3С—С
О
^
XI
ацетилхлорид
О
і ЇГ
О—С—СН3 + ИаСІ
' фенілацетат
0~№+
ЮН
Реакція з феноксидами лужних металів проходить значно легше, ніж з фенолами, оскільки феноксид-іон за рахунок негативного заряду на атомі Оксигену виявляє більшу нуклеофільність, ніж неіонізований фенол:
![]()
С![]() Т
ІР
Т
ІР
слабкий нуклеофіл сильний нуклеофіл
Б. Реакції електрофільного заміщення в ароматичному кільці
Маючи електронодонорні властивості, гідроксильна група сильно активує бензенове кільце у відношенні до реакцій електрофільного заміщення 8Е і спрямовує заміщення в о- та «-положення. Фенолят-іони в реакції 5Е ще активніші, ніж відповідні феноли. Через високу активність фенолів необхідно вживати спеціальних заходів для запобігання реакції окиснення та полізаміщенню.
Галогенування. Як відомо, для введення атома галогену в бензенове кільце потрібні каталізатори — кислоти Льюїса. Висока реакційна здатність фенолів приводить до того, що реакція галогенування для них легко відбувається за відсутності каталізатора. Вони знебарвлюють бромну воду, причому відбувається заміщення всіх атомів Гідрогену в о- та л-положеннях:
![]()
ОН
ЗВг2(Н20)
О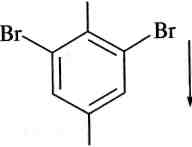 Н
Н
+ ЗНВг;
2,4,6-трибромофенол Вг (білий осад)
+
2Н,0
246
он
ОН
сн,
сн,
ЗВг2(Н20)
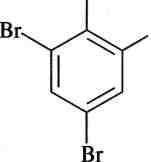 лава
1$
лава
1$
+ 2НВг
о-крезол
2,4-дибром-6-метил фенол
ОН
ОН
Для того, щоб увести один або два атоми галогену, необхідні спеціальні умови. Наприклад, якщо бромування проводити в низь-кополярному розчиннику (СС14, СНС13), утворюються здебільшого монобромофеноли з переважною кількістю иоря-ізомеру:
![]()
![]()
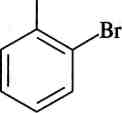
он
2Вг2, СС14 -2НВг
^^
![]()
Вг
л-бромофенол о-бромофенол
При хлоруванні утворюється переважно ор/ио-ізомер. Йод безпосередньо не йодує феноли.
Нітрування. Реакція нітрування фенолу, на відміну від бензе-ну, відбувається при обробці розведеною нітратною кислотою при кімнатній температурі. При цьому утворюється суміш о- та п -нітрофенолів:
ОН
ОН
![]()
N0
о![]() н
н
![]()
![]()
2Н>Юз(Н20), 25 °С
л-нітрофенол
о-нітрофенол
N0,
При дії концентрованої нітратної кислоти фенол перетворюється на 2,4,6-тринітрофенол (пікринову кислоту):
247
ОН
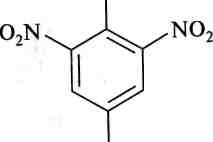
![]()
Гідроксильні похідні вуглеводнів ОН
+ ЗН20
2,4,6-тринітрофенол, пікринова кислота
N0,
знмо3
Раніше пікринову кислоту використовували як вибухову речовину.
![]()
О
II
с
II
о
С00№
0~№+
ОН
неї
Синтез фенолокарбонових кислот (реакція Кольбе). При нагріванні натрій феноляту в струмі С02 утворюється натрій саліцилат, який під дією мінеральних кислот перетворюється на саліцилову кислоту:
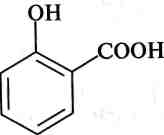
-№С1
125 °С, р
натрій саліцилат
саліцилова кислота
Карбон (IV) оксид — слабкий електрофіл, тому реакцію проводять з натрій фенолятом.
Синтез ароматичних гідроксіальдегідів (реакція Раймера—Тімана).
Реакція грунтується на взаємодії фенолу з хлороформом у водному розчині лугу і приводить до введення в бензенове ядро альдегідної групи. Як правило, заміщення відбувається в о-положенні:
ОН
о
он
О
0"Ш+
>"
![]()
![]()
![]()
>"
неї
ЧН
-№С1
саліциловий альдегід
СНС1Д; №ОН (Н20) 70°С
натрш о-формілфенолят
і

248
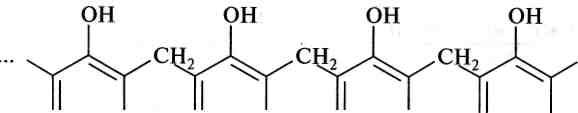
Гідроксиметилування. Реакція полягає в обробці фенолів формальдегідом у кислому або лужному середовищі. Спочатку утворюється суміш о- та л-гідроксиметилфенолів, здатних надалі реагувати з фенолом, утворюючи фенолоформальдегідні смоли. Гідроксиметилування фенолу відбувається за механізмом 5£.
Електрофілом є гідроксиметилкатіон Н2С—ОН:
н2с-
-ОН
гідроксиметилкатіон
ОН
Н2С=0
формальдегід
с
![]()
СН2ОН
<^
:![]() ОН
ОН
-нч
-сн2он
2-гідроксиметилфенол
У присутності мінеральних кислот гідроксиметилфенол вступає в реакцію конденсації з молекулою фенолу:
снн-он
Ш
![]()
он он он
н+
І І
-н,о
ч^
ОН
сн
![]()
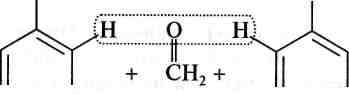
У![]() мовно
цей процес можна показати так:
ОН ОН ОН
мовно
цей процес можна показати так:
ОН ОН ОН
ч^
ч^
н+
СН,
Ч^
ч^ ч^
^^