
- •Передмова
- •Вступ до органічної хімії
- •1.1. Предмет органічної хімії
- •1.2. Короткий огляд історії розвитку органічної хімії
- •Глава 1 6
- •1.3. Розвиток теоретичних уявлень про будову органічних сполук
- •Глава 1
- •1.4. Способи зображення органічних молекул
- •Глава 1
- •2.1. Класифікація органічних сполук
- •Глава 2
- •2.2. Номенклатура органічних сполук
- •Глава 2
- •Глава 2
- •ХїмГчний зв'язок
- •3.1. Типи хімічних зв'язків
- •3.2. Хімічний зв'язок в органічних сполуках
- •3.2.1. Гібридизація атомних орбіталей
- •3.2.2. Ковалентні о- і я-зв'язки
- •3.2.3. Основні характеристики ковалентних зв'язків
- •4.1. Індуктивний ефект
- •Глава 40
- •4.2. Мезомерний ефект (ефект спряження)*
- •Глава 4
- •Глава 4
- •4.4. Надспряження (гіперкон'югація)
- •Глава 4
- •Класифікація ізомерії ізомерія
- •48 Глава 5
- •5.2. Просторова ізомерія (стереоізомерія)
- •Глава 5
- •5.3. Способи зображення просторової будови
- •Глава 5
- •6.1. Кислотність і основність за теорією бренстеда
- •Глава 6
- •6.2. Типи органічних кислот і основ
- •Глава 6
- •6.3. Кислоти і основи льюїса
- •7.1. Поняття про типи механізмів реакцій
- •Глава 7
- •7.2. Поняття про типи органічних реакцій
- •Глава 7
- •Вуглеводні
- •8.1. Електронна та просторова будова алканів
- •8.2. Номенклатура
- •8 .3. Ізомерія
- •8.4. Способи добування
- •8.4.1. Природні джерела
- •8.4.2. Синтетичні методи добування
- •8.5. Фізичні властивості
- •8.6. Хімічні властивості
- •8.6.1. Реакції радикального заміщення (5*)
- •76 Вуглеводні. Глава 8
- •8.6.2. Крекінг
- •8.7. Окремі представники. Застосування
- •1. Напишіть структурні формули наведених вуглеводнів і назвіть їх за раціональною номенклатурою:
- •2. Напишіть структурні формули таких вуглеводнів і назвіть їх за но менклатурою шрас:
- •Ц иклоалкани
- •9.1. Класифікація та номенклатура
- •9.2. Ізомерія
- •9.3. Способи добування. Фізичні властивості
- •9.4. Будова циклоалканів
- •9.5. Хімічні властивості
- •9.6. Окремі представники. Застосування
- •4 Органічна хімія
- •10.1. Номенклатура
- •Перші члени гомологічного ряду алкенів
- •100 Ненасичені вуглеводні. Глава іо
- •10.2. Ізомерія
- •10.3. Електронна і просторова будова алкенів
- •10.4. Способи добування
- •10.5. Фізичні властивості
- •10.6. Хімічні властивості
- •109 Ненасичені вуглеводні. Глава 10 108
- •1 0.6.1. Реакції електрофільного приєднання (ае)
- •10.6.2. Реакції відновлення та окиснення
- •10.6.3. Полімеризація алкенів
- •10.6.4. Алільне галогенування алкенів
- •118 Ненасичені вуглеводні. Глава ю
- •10.7. Окремі представники. Застосування. Ідентифікація
- •0 Контрольні питання та вправи
- •Алкадієни
- •11.2. Будова алкадієнів
- •11.1. Номенклатура
- •11.3. Алкадієни зі спряженими зв'язками 11.3.1. Способи добування
- •11.3.2. Хімічні властивості
- •11.3.3. Натуральний і синтетичний каучук
- •11.4 Окремі представники. Застосування
- •12.1. Номенклатура та ізомерія
- •12.2. Електронна та просторова будова молекул алкінів
- •12.3. Способи добування
- •138 Ненасичені вуглеводні. Глава т2
- •12.4. Фізичні властивості
- •12.5. Хімічні властивості
- •12.5.1. Реакції електрофільного приєднання (ае)
- •12.5.2. Реакції заміщення
- •12.6. Окремі представники. Застосування
- •Одноядерні арени
- •13.1. Будова бензену. Ароматичність
- •13.2. Номенклатура та ізомерія
- •13.3. Способи добування 13.3.1. Природні джерела
- •13.3.2. Синтетичні методи добування
- •13.4. Фізичні властивості
- •13.5. Хімічні властивості
- •13.5.1. Реакції електрофільного заміщення (5£)
- •0/1Ноядєрні аРени
- •13.5.2. Реакції приєднання
- •13.5.3. Реакції окиснення
- •13.5.4. Галогенування гомологів бензену з участю бокового ланцюга
- •165 0ДнояДерн[арени
- •13.6. Вплив замісників у бензеновому кільці на напрямок та швидкість реакцій
- •Електрофільного заміщення
- •13.7. Орієнтація в дизаміщеному бензені
- •1 3.8. Окремі представники. Застосування
- •13.9. Представники багатоядерних аренів
- •13.9.1. Нафтален
- •13.9.2. Антрацен
- •14.1. Природний та попутний нафтовий гази
- •Глава 14
- •14.2. Нафта. Нафтопродукти
- •14.3. Коксування вугілля
- •Глава 1і0у глава Глава 14 186 !
- •15.1. Класифікація та номенклатура
- •15.2. Ароматичність гетероциклів
- •Глава 15
- •15.3. Кислотно-осНбВні властивості гетероциклів
- •15.4. П'ятичленні гетероциклічні сполуки з одним гетероатомом
- •15.4.1. Способи добування
- •15.4.2. Фізичні властивості
- •15.4.3. Хімічні властивості
- •Глава 15
- •15.4.4. Найважливіші похідні піролу
- •Глава 15
- •15.5. Шестичленні гетероциклічні сполуки з одним гетероатомом
- •Глава 15
- •Глава 15
- •В. Реакції відновлення і окиснення
- •15.6. П'яти-1 шестичленні гетероцикли з двома гетероатомами
- •208 Глава 15
- •15.7. Представники конденсованих систем гетероциклів
- •16.1. Одноатомні спирти
- •16.1.1. Номенклатура
- •Глава 16
- •16.1.2. Ізомерія
- •16.1.3. Фізичні властивості
- •Глава 1
- •16.1.4. Способи добування
- •16.1.5. Хімічні властивості
- •16.1.6. Ідентифікація спиртів
- •16.1.7. Окремі представники
- •230 Глава 16
- •16.2.1. Способи добування дво- і триатомних спиртів
- •16.2.2. Фізичні властивості
- •16.2.3. Хімічні властивості
- •16.2.4. Окремі представники
- •16.3.2. Способи добування
- •16.3. Одноатомні феноли 16.3.1. Номенклатура та ізомерія
- •16.3.4. Хімічні властивості
- •16.3.3. Фізичні властивості
- •249 Гідроксильні похідні вуглеводнів
- •В. Реакції відновлення і окиснення
- •255 Гідроксильні похідні вуглеводнів
- •17.1. Номенклатура та ізомерія
- •17.2. Способи добування
- •17.3. Фізичні властивості
- •263 Цясимені альдегіди і кетони
- •269 Насичені альдегіди і кетони
- •271 ИаСйчені альдегіди і кетони
- •17.5. Окремі представники
- •Монокарбонові кислоти
- •18.1. Насичені монокарбонові кислоти
- •18.1.1. Номенклатура та ізомерія
- •18.1.3. Фізичні властивості
- •18.1.4. Хімічні властивості
- •А. Кислотні властивості
- •Г. Окиснення та відновлення
- •18.1.5. Окремі представники
- •18.2. Ненасичені монокарбонові кислоти
- •18.2.1. Номенклатура та ізомерія
- •18.2.2. Способи добування
- •18.2.4. Хімічні властивості
- •18.2.3. Фізичні властивості
- •18.2.5. Окремі представники
- •299 Монокарбонові кислоти
- •18.3. Ароматичні монокарбонові кислоти
- •18.3.1. Способи добування
- •18.3.2. Фізичні властивості
- •18.3.3. Хімічні властивості
- •18.3.4. Окремі представники. Ідентифікація
- •303 Монокарбонові кислоти
- •18.4.1. Номенклатура та ізомерія
- •Назви деяких дикарбонових кислот
- •18.4.2. Способи добування
- •18.4.3. Фізичні властивості
- •18.4.4. Хімічні властивості
- •18.4.5. Окремі представники
- •309 Мриокар6онові кислоти
- •18.5. Ароматичні дикарбонові кислоти
- •310 Карбонові кислоти. Глава и
- •313 Монокарбонові кислоти
- •19.1.2. Способи добування
- •19.1. Галогенангідриди карбонових кислот (ацилгалогеніди)
- •19.1.1. Номенклатура
- •19.1.3. Фізичні властивості
- •19.1.4. Хімічні властивості
- •19.1.5. Окремі представники
- •19.2. Ангідриди карбонових кислот
- •19.2.1. Номенклатура
- •19.2.2. Способи добування
- •19.2.3. Фізичні властивості
- •19.2.4. Хімічні властивості
- •19.2.5. Окремі представники
- •19.3. Естери карбонових кислот
- •19.3.1. Номенклатура
- •19.3.3. Фізичні властивості
- •19.3.4. Хімічні властивості
- •19.3.5. Окремі представники
- •19.4. Жири
- •19.4.1. Номенклатура та ізомерія
- •19.4.2. Способи добування
- •19.4.3. Фізичні властивості
- •19.4.4. Хімічні властивості
- •19.4.5. Воски. Твіни
- •19.5. Аміди карбонових кислот
- •19.5.1. Номенклатура
- •Ацетамщ,
- •19.5.2. Способи добування
- •19.5.3. Фізичні властивості
- •19.5.4. Хімічні властивості
- •19.5.5. Окремі представники
- •19.6. Нітрили (ціаніди)
- •19.6.1. Номенклатура
- •19.6.2. Способи добування
- •19.6.3. Хімічні властивості
- •19.6.4. Окремі представники
- •20.1. Галогенокарбонові кислоти
- •20.1.1. Номенклатура
- •20.1.2. Способи добування
- •20.1.3. Фізичні та хімічні властивості
- •20.2. Гідроксикислоти
- •20.2.2. Оптична ізомерія
- •20.2.3. Аліфатичні пдроксикислоти
- •359 Гетерофункціональні карбонові кислоти
- •Фізичні та хімічні властивості
- •361 Гетерофункціональні карбонові кислоти
- •20.3. Амінокислоти
- •II Амінокислотами називаються похідні карбонових кислот, у вуглеводневому радикалі яких один або кілька атомів Гідрогену замінені аміногрупою.
- •20.3.1. Номенклатура та ізомерія
- •20.3.2. Способи добування
- •20.3.3. Фізичні та хімічні властивості
- •367 Гетерофункціональні карбонові кислоти
- •20.3.4. Окремі представники
- •0 Контрольні питання та вправи
- •21.1. Номенклатура та ізомерія
- •Глава 21
- •Глава 21
- •21.2.1. Способи добування
- •21.2.2. Фізичні властивості. Просторова будова
- •21.2.3. Хімічні властивості
- •Глава 21 378 — —
- •21.3. Ариламіни
- •Глава 21
- •21.3.2. Фізичні та хімічні властивості
- •А. Реакції за участю атома Нітрогену
- •Глава 21
- •Глава 21
- •21.4. Окремі представники. Застосування
- •В. Окислення ариламінів
- •Глава 21
- •Глава 21
- •22.1. Моносахариди
- •22.1.1. Класифікація та номенклатура
- •Глава 22
- •22.1.2. Стереоізомерія
- •Глава 22
- •22.1.3. Будова моносахаридів
- •Глава 22
- •Глава 22 402
- •Глава 22
- •22.1.4. Способи добування
- •22.1.5. Фізичні властивості
- •22.1.6. Хімічні властивості
- •Глава 22
- •Глава 22
- •Б. Реакції за участю циклічних форм
- •Глава 22
- •22.1.7. Окремі представники
- •Глава 22 412
- •Глава 22
- •22.2. Дисахариди
- •22.2.1. Відновні дисахариди
- •Глава 22
- •22.2.2. Невідновні дисахариди
- •14 Органічна хімія
- •Глава 22 418
- •22.3. Полісахариди
- •Глава 22 н он н он н он н он
- •Глава 22 422
- •Глава 22 424
- •425 Вуглеводи
- •Глава 23
- •Глава 23
- •23.1.1. Стереоізомерія
- •23.1.2. Фізичні властивості
- •23.1.3. Способи добування
- •23.1.4. Хімічні властивості
- •Глава 23
- •23.2. Будова пептидів і білків
- •Глава 23
- •23.3. Синтез пептидів та їх властивості
- •440 Глава 23
- •23.4. Функції білків в організмі
- •Нуклеїнові кислоти
- •24.1. Будова нуклеїнових кислот
- •Глава 24
- •Глава 24
- •24.2. Рибонуклеїнові (рнк) і дезоксирибонуклеїнові (днк) кислоти
- •Глава 24
- •Глава 24
- •Глава 25
- •Неомилювані ліпіди
- •Глава 25
- •Глава 9. Циклоалкани 86
- •Глава 10. Алкени 98
- •Глава 11. Алкадієни 122
- •Глава 12. Алкіни 135
- •Глава 13. Одноядерні арени 147
- •Глава 14. Природні джерела вуглеводнів 179
- •Глава 15. Гетероциклічні сполуки 187
- •Глава 16. Гідроксильні похідні вуглеводнів 212
- •Глава 17. Насичені альдегіди і кетони 256
- •Глава 18. Монокарбонові кислоти 280
- •Глава 19. Функціональні похідні карбонових кислот 314
- •Глава 20. Гетерофункціональні карбонові кислоти 346
- •Глава 21. Аміни 371
- •Глава 22. Вуглеводи 394 о
- •Глава 23. Білки 426 •
- •Глава 24. Нуклеїнові кислоти 444
- •Глава 25. Ліпіди 453
- •Органічна хімія
- •61002, Харків, вул. Пушкінська, 53.
- •61022, Харків, пл. Свободи, 5, Держпром, 6-й під'їзд, 6-й поверх.
- •61012, Харків, вул. Енгельса, 11.
Глава 2
Р адикале-функціональна
номенклатура.
Для
деяких органічних сполук
номенклатура ШРАС, поряд із замісниковою,
передбачає радикало-функціональний
варіант утворення назв. В основі цих
назв
лежить назва функціонального класу
(спирт, етер, кетон та ін.), якому
передують назви вуглеводневих радикалів,
наприклад:
адикале-функціональна
номенклатура.
Для
деяких органічних сполук
номенклатура ШРАС, поряд із замісниковою,
передбачає радикало-функціональний
варіант утворення назв. В основі цих
назв
лежить назва функціонального класу
(спирт, етер, кетон та ін.), якому
передують назви вуглеводневих радикалів,
наприклад:
С1-СН2-СН=СН2 СН3-СН2-0-СН2-СН3
алілхлорид діетиловий етер
СН3-СН2-ОН сНз-С-СНз
етиловий спирт II
ацетон, диметилкетон
Розглянуті в цій главі основні принципи номенклатури органічних сполук є лише коротким поясненням до численних назв і номенклатурних правил, викладених у наступних розділах підручника, присвячених конкретним класам сполук.
ГЛАВА ОЦІ ГЛАВА
ХїмГчний зв'язок
Вивчення органічної хімії значно спростилося завдяки розвитку теорії хімічного зв'язку. На підставі існуючих уявлень про природу хімічного зв'язку та електронну структуру молекул стало можливим пояснити реакційну здатність органічних сполук та зрозуміти фактичний матеріал хімії.
3.1. Типи хімічних зв'язків
У 1916 році німецький вчений В. Коссель та американський вчений Дж. Льюїс запропонували електронну теорію хімічного зв'язку, яка стала важливим етапом у розвитку теорії хімічної будови. За електронною теорією хімічний зв'язок розглядається як результат взаємодії зовнішніх електронних оболонок (валентних електронів) атомів. Враховуючи хімічну інертність благородних газів, їх зовнішні електронні оболонки (для гелію — двохелектронна, для неону, аргону і т. д. — восьмиелектронна) вважають найбільш стійкими. Тому кожен атом, утворюючи хімічний зв'язок, приймає, віддає або успільнює валентні електрони таким чином, щоб його зовнішня електронна оболонка відповідала конфігурації інертних газів. Такий принцип заповнення валентних оболонок дістав назву «октетне правило».
Залежно від способу утворення розрізняють два основні типи хімічного зв'язку: іонний та ковалентний.
Іонний зв'язок утворюється між атомами, які значно відрізняються за електронегативністю. Електронна конфігурація інертного газу досягається в цьому разі шляхом перенесення електрона до більш електронегативного атома. Так утворюються протилежно заряджені іони, які електростатично взаємно притягуються. Тому іонний зв'язок називають ще електровалентним:
24
Глава З
Хімічний зв язок
25
N
 3-
+-С1:
№+С1
3-
+-С1:
№+С1
іонний зв'язок
У наведеному прикладі іон Натрію має електронну конфігурацію Неону, а іон Хлору — конфігурацію Аргону.
Сполуки з іонним зв'язком мають високі температури плавлення, добре розчиняються в полярних розчинниках, у водних розчинах дисоціюють на іони, їх розчини і розтопи проводять електричний струм.
Ковалентний зв'язок є основним типом хімічного зв'язку в органічних сполуках. Він утворюється між атомами, рівними або близькими за електронегативністю. Електронна конфігурація інертного газу в цьому разі досягається шляхом успільнення валентних електронів і формування однієї або кількох спільних електронних пар:
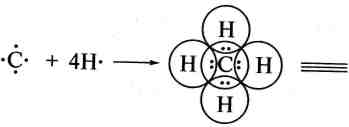
Н
І
н—с—н
І
н
ковалентний зв'язок
Унаслідок успільнення валентних електронів Карбону і Гідрогену утворюються чотири електронні пари, які є спільними для цих атомів. Атом Карбону при цьому набуває електронної конфігурації Неону, а атом Гідрогену — конфігурації Гелію. Кожна з успіль-нених пар електронів складає ковалентний зв'язок, який позначається у вигляді валентного штриху (—).
При утворенні ковалентного зв'язку між атомами з однаковою електронегативністю спільна електронна пара розташовується симетрично відносно центрів обох атомів. Такий зв'язок називається ковалентним неполярним:
Н3С га СНз ^^ Н3С СНз
Якщо в утворенні ковалентного зв'язку беруть участь атоми з різною електронегативністю, то спільна пара електронів зміщується до атома з більшою електронегативністю. Такий зв'язок називається ковалентним полярним:
У 8+ 8-
н3с|сі -н3с^сі
Полярний ковалентний зв'язок зображують у вигляді стрілки (-»), спрямованої до більш електронегативного атома. Літерою 8 (грец. «дельта») умовно позначають дробні (часткові) заряди на атомах. Символ 5+ відображає понижену, а 8" — підвищену електронну густину.
Залежно від кількості спільних електронних пар, що виникають між атомами при утворенні зв'язку, розрізняють прості й кратні ковалентні зв'язки. Прості — представлені однією, кратні — двома або трьома парами електронів:
/ \
Н0СВС0Н) ав Н—С=С—Н
простий / > кратний
ковалентний зв'язок ковалентний зв'язок
Атоми Нітрогену, Оксигену, Сульфуру, галогенів та деяких інших елементів при утворенні ковалентних зв'язків формують ок-тетну оболонку успільненням не всіх зовнішніх електронів. Частина електронів не бере участі в утворенні хімічних зв'язків. Ці електрони називають неуспільненими, неподіленими, або «-електронами:
Н Н І
:№ + ЗН-
:№Н ви Н—14—Н Н
/
неподілеш електронні пари
![]()
Донорно-акцепторний зв'язок — це різновид механізму утворення ковалентного зв'язку. Донорно-акцепторний зв'язок утворюється не шляхом успільнення пари електронів, по одному від кожного атома, а за рахунок двох електронів, які надає один з атомів. При цьому атом, що надає пару електронів у спільне користування, називають донором, а частинку, яка приймає електрони,— акцептором. Донор повинен мати пару неподілених електронів. Акцептором може бути протон або інший атом, в якого не вистачає до утворення октету двох електронів.
За донорно-акцепторним механізмом, наприклад, відбувається утворення іонів амонію, гідроксонію та ін.:
26
Глава З
Хімічний зв'язок



Н
І Н—№ + Н
Н
І
н—м—н
І
н
І
донор
н
акцептор
Н—И—Н або Н
Оскільки пара електронів атома Нітрогену пішла на утворення зв'язку із протоном і стала спільною для обох атомів, атом Нітрогену набуває позитивного заряду. Утворений в іоні амонію за до-норно-акцепторним механізмом ковалентний зв'язок нічим не відрізняється від трьох інших зв'язків.
Донорно-акцепторний зв'язок називають ще координаційним, при його утворенні відбувається процес координації неподіленої електронної пари.
Водневий зв'язок утворюється внаслідок електростатичної взаємодії між активними атомами Гідрогену в молекулі і атомами з не-поділеною електронною парою (—О—, —N—, —Р, іноді —8—) у цій же або в іншій молекулі. Активними називають атоми Гідрогену, зв'язані в молекулі сильно полярним ковалентним зв'язком, наприклад: —О—Н; =1Ч— Н; —8—-Н.
Графічно водневий зв'язок позначають трьома крапками: —О—Н- • '№^ =>4—Н- • -0=.
Енергія водневого зв'язку (10—40 кДж/моль) у порівнянні з енергією ковалентного зв'язку (340—360 кДж/моль) невелика.
Міжмолекулярні водневі зв'язки виникають між двома або кількома молекулами з утворенням димерів або асоціатів:
У
няс—с
\
•н
,о-н—о.
-о
І
н-
Н—№
„
•Н-
ч
у
:с—сн,
м—н
І
н н
Н---0—Н
димер води
'О—Н—0
розчин амоніаку у воді
н—о
димер оцтової кислоти
с2н5о—н- • -о—н- • -о—н с2н5 с2н5
асоціат етилового спирту
Наявність водневих зв'язків впливає на фізичні (температуру кипіння і плавлення, розчинність, в'язкість) та хімічні властивості органічних сполук. Міжмолекулярний водневий зв'язок сприяє підвищенню температури кипіння, а часто й температури плавлення речовини. Так, за рахунок утворення асоціатів температура кипіння етилового спирту С2Н5ОН (78 °С) значно вища, ніж ди-
метилового етеру СН3—О—СН3 (-24 °С), що має однакову з ним молекулярну масу, але не здатний утворювати водневий зв'язок.
Утворення водневого зв'язку між розчиненою речовиною і розчинником (якщо це можливо) значно збільшує розчинність речовини (вплив водневого зв'язку на розчинність амоніаку).
Водневі зв'язки відіграють важливу роль у перебігу різноманітних біохімічних процесів в організмі, вони визначають просторову структуру білків, полісахаридів, беруть участь в утворенні подвійної спіралі ДНК тощо.
