
- •Передмова
- •Вступ до органічної хімії
- •1.1. Предмет органічної хімії
- •1.2. Короткий огляд історії розвитку органічної хімії
- •Глава 1 6
- •1.3. Розвиток теоретичних уявлень про будову органічних сполук
- •Глава 1
- •1.4. Способи зображення органічних молекул
- •Глава 1
- •2.1. Класифікація органічних сполук
- •Глава 2
- •2.2. Номенклатура органічних сполук
- •Глава 2
- •Глава 2
- •ХїмГчний зв'язок
- •3.1. Типи хімічних зв'язків
- •3.2. Хімічний зв'язок в органічних сполуках
- •3.2.1. Гібридизація атомних орбіталей
- •3.2.2. Ковалентні о- і я-зв'язки
- •3.2.3. Основні характеристики ковалентних зв'язків
- •4.1. Індуктивний ефект
- •Глава 40
- •4.2. Мезомерний ефект (ефект спряження)*
- •Глава 4
- •Глава 4
- •4.4. Надспряження (гіперкон'югація)
- •Глава 4
- •Класифікація ізомерії ізомерія
- •48 Глава 5
- •5.2. Просторова ізомерія (стереоізомерія)
- •Глава 5
- •5.3. Способи зображення просторової будови
- •Глава 5
- •6.1. Кислотність і основність за теорією бренстеда
- •Глава 6
- •6.2. Типи органічних кислот і основ
- •Глава 6
- •6.3. Кислоти і основи льюїса
- •7.1. Поняття про типи механізмів реакцій
- •Глава 7
- •7.2. Поняття про типи органічних реакцій
- •Глава 7
- •Вуглеводні
- •8.1. Електронна та просторова будова алканів
- •8.2. Номенклатура
- •8 .3. Ізомерія
- •8.4. Способи добування
- •8.4.1. Природні джерела
- •8.4.2. Синтетичні методи добування
- •8.5. Фізичні властивості
- •8.6. Хімічні властивості
- •8.6.1. Реакції радикального заміщення (5*)
- •76 Вуглеводні. Глава 8
- •8.6.2. Крекінг
- •8.7. Окремі представники. Застосування
- •1. Напишіть структурні формули наведених вуглеводнів і назвіть їх за раціональною номенклатурою:
- •2. Напишіть структурні формули таких вуглеводнів і назвіть їх за но менклатурою шрас:
- •Ц иклоалкани
- •9.1. Класифікація та номенклатура
- •9.2. Ізомерія
- •9.3. Способи добування. Фізичні властивості
- •9.4. Будова циклоалканів
- •9.5. Хімічні властивості
- •9.6. Окремі представники. Застосування
- •4 Органічна хімія
- •10.1. Номенклатура
- •Перші члени гомологічного ряду алкенів
- •100 Ненасичені вуглеводні. Глава іо
- •10.2. Ізомерія
- •10.3. Електронна і просторова будова алкенів
- •10.4. Способи добування
- •10.5. Фізичні властивості
- •10.6. Хімічні властивості
- •109 Ненасичені вуглеводні. Глава 10 108
- •1 0.6.1. Реакції електрофільного приєднання (ае)
- •10.6.2. Реакції відновлення та окиснення
- •10.6.3. Полімеризація алкенів
- •10.6.4. Алільне галогенування алкенів
- •118 Ненасичені вуглеводні. Глава ю
- •10.7. Окремі представники. Застосування. Ідентифікація
- •0 Контрольні питання та вправи
- •Алкадієни
- •11.2. Будова алкадієнів
- •11.1. Номенклатура
- •11.3. Алкадієни зі спряженими зв'язками 11.3.1. Способи добування
- •11.3.2. Хімічні властивості
- •11.3.3. Натуральний і синтетичний каучук
- •11.4 Окремі представники. Застосування
- •12.1. Номенклатура та ізомерія
- •12.2. Електронна та просторова будова молекул алкінів
- •12.3. Способи добування
- •138 Ненасичені вуглеводні. Глава т2
- •12.4. Фізичні властивості
- •12.5. Хімічні властивості
- •12.5.1. Реакції електрофільного приєднання (ае)
- •12.5.2. Реакції заміщення
- •12.6. Окремі представники. Застосування
- •Одноядерні арени
- •13.1. Будова бензену. Ароматичність
- •13.2. Номенклатура та ізомерія
- •13.3. Способи добування 13.3.1. Природні джерела
- •13.3.2. Синтетичні методи добування
- •13.4. Фізичні властивості
- •13.5. Хімічні властивості
- •13.5.1. Реакції електрофільного заміщення (5£)
- •0/1Ноядєрні аРени
- •13.5.2. Реакції приєднання
- •13.5.3. Реакції окиснення
- •13.5.4. Галогенування гомологів бензену з участю бокового ланцюга
- •165 0ДнояДерн[арени
- •13.6. Вплив замісників у бензеновому кільці на напрямок та швидкість реакцій
- •Електрофільного заміщення
- •13.7. Орієнтація в дизаміщеному бензені
- •1 3.8. Окремі представники. Застосування
- •13.9. Представники багатоядерних аренів
- •13.9.1. Нафтален
- •13.9.2. Антрацен
- •14.1. Природний та попутний нафтовий гази
- •Глава 14
- •14.2. Нафта. Нафтопродукти
- •14.3. Коксування вугілля
- •Глава 1і0у глава Глава 14 186 !
- •15.1. Класифікація та номенклатура
- •15.2. Ароматичність гетероциклів
- •Глава 15
- •15.3. Кислотно-осНбВні властивості гетероциклів
- •15.4. П'ятичленні гетероциклічні сполуки з одним гетероатомом
- •15.4.1. Способи добування
- •15.4.2. Фізичні властивості
- •15.4.3. Хімічні властивості
- •Глава 15
- •15.4.4. Найважливіші похідні піролу
- •Глава 15
- •15.5. Шестичленні гетероциклічні сполуки з одним гетероатомом
- •Глава 15
- •Глава 15
- •В. Реакції відновлення і окиснення
- •15.6. П'яти-1 шестичленні гетероцикли з двома гетероатомами
- •208 Глава 15
- •15.7. Представники конденсованих систем гетероциклів
- •16.1. Одноатомні спирти
- •16.1.1. Номенклатура
- •Глава 16
- •16.1.2. Ізомерія
- •16.1.3. Фізичні властивості
- •Глава 1
- •16.1.4. Способи добування
- •16.1.5. Хімічні властивості
- •16.1.6. Ідентифікація спиртів
- •16.1.7. Окремі представники
- •230 Глава 16
- •16.2.1. Способи добування дво- і триатомних спиртів
- •16.2.2. Фізичні властивості
- •16.2.3. Хімічні властивості
- •16.2.4. Окремі представники
- •16.3.2. Способи добування
- •16.3. Одноатомні феноли 16.3.1. Номенклатура та ізомерія
- •16.3.4. Хімічні властивості
- •16.3.3. Фізичні властивості
- •249 Гідроксильні похідні вуглеводнів
- •В. Реакції відновлення і окиснення
- •255 Гідроксильні похідні вуглеводнів
- •17.1. Номенклатура та ізомерія
- •17.2. Способи добування
- •17.3. Фізичні властивості
- •263 Цясимені альдегіди і кетони
- •269 Насичені альдегіди і кетони
- •271 ИаСйчені альдегіди і кетони
- •17.5. Окремі представники
- •Монокарбонові кислоти
- •18.1. Насичені монокарбонові кислоти
- •18.1.1. Номенклатура та ізомерія
- •18.1.3. Фізичні властивості
- •18.1.4. Хімічні властивості
- •А. Кислотні властивості
- •Г. Окиснення та відновлення
- •18.1.5. Окремі представники
- •18.2. Ненасичені монокарбонові кислоти
- •18.2.1. Номенклатура та ізомерія
- •18.2.2. Способи добування
- •18.2.4. Хімічні властивості
- •18.2.3. Фізичні властивості
- •18.2.5. Окремі представники
- •299 Монокарбонові кислоти
- •18.3. Ароматичні монокарбонові кислоти
- •18.3.1. Способи добування
- •18.3.2. Фізичні властивості
- •18.3.3. Хімічні властивості
- •18.3.4. Окремі представники. Ідентифікація
- •303 Монокарбонові кислоти
- •18.4.1. Номенклатура та ізомерія
- •Назви деяких дикарбонових кислот
- •18.4.2. Способи добування
- •18.4.3. Фізичні властивості
- •18.4.4. Хімічні властивості
- •18.4.5. Окремі представники
- •309 Мриокар6онові кислоти
- •18.5. Ароматичні дикарбонові кислоти
- •310 Карбонові кислоти. Глава и
- •313 Монокарбонові кислоти
- •19.1.2. Способи добування
- •19.1. Галогенангідриди карбонових кислот (ацилгалогеніди)
- •19.1.1. Номенклатура
- •19.1.3. Фізичні властивості
- •19.1.4. Хімічні властивості
- •19.1.5. Окремі представники
- •19.2. Ангідриди карбонових кислот
- •19.2.1. Номенклатура
- •19.2.2. Способи добування
- •19.2.3. Фізичні властивості
- •19.2.4. Хімічні властивості
- •19.2.5. Окремі представники
- •19.3. Естери карбонових кислот
- •19.3.1. Номенклатура
- •19.3.3. Фізичні властивості
- •19.3.4. Хімічні властивості
- •19.3.5. Окремі представники
- •19.4. Жири
- •19.4.1. Номенклатура та ізомерія
- •19.4.2. Способи добування
- •19.4.3. Фізичні властивості
- •19.4.4. Хімічні властивості
- •19.4.5. Воски. Твіни
- •19.5. Аміди карбонових кислот
- •19.5.1. Номенклатура
- •Ацетамщ,
- •19.5.2. Способи добування
- •19.5.3. Фізичні властивості
- •19.5.4. Хімічні властивості
- •19.5.5. Окремі представники
- •19.6. Нітрили (ціаніди)
- •19.6.1. Номенклатура
- •19.6.2. Способи добування
- •19.6.3. Хімічні властивості
- •19.6.4. Окремі представники
- •20.1. Галогенокарбонові кислоти
- •20.1.1. Номенклатура
- •20.1.2. Способи добування
- •20.1.3. Фізичні та хімічні властивості
- •20.2. Гідроксикислоти
- •20.2.2. Оптична ізомерія
- •20.2.3. Аліфатичні пдроксикислоти
- •359 Гетерофункціональні карбонові кислоти
- •Фізичні та хімічні властивості
- •361 Гетерофункціональні карбонові кислоти
- •20.3. Амінокислоти
- •II Амінокислотами називаються похідні карбонових кислот, у вуглеводневому радикалі яких один або кілька атомів Гідрогену замінені аміногрупою.
- •20.3.1. Номенклатура та ізомерія
- •20.3.2. Способи добування
- •20.3.3. Фізичні та хімічні властивості
- •367 Гетерофункціональні карбонові кислоти
- •20.3.4. Окремі представники
- •0 Контрольні питання та вправи
- •21.1. Номенклатура та ізомерія
- •Глава 21
- •Глава 21
- •21.2.1. Способи добування
- •21.2.2. Фізичні властивості. Просторова будова
- •21.2.3. Хімічні властивості
- •Глава 21 378 — —
- •21.3. Ариламіни
- •Глава 21
- •21.3.2. Фізичні та хімічні властивості
- •А. Реакції за участю атома Нітрогену
- •Глава 21
- •Глава 21
- •21.4. Окремі представники. Застосування
- •В. Окислення ариламінів
- •Глава 21
- •Глава 21
- •22.1. Моносахариди
- •22.1.1. Класифікація та номенклатура
- •Глава 22
- •22.1.2. Стереоізомерія
- •Глава 22
- •22.1.3. Будова моносахаридів
- •Глава 22
- •Глава 22 402
- •Глава 22
- •22.1.4. Способи добування
- •22.1.5. Фізичні властивості
- •22.1.6. Хімічні властивості
- •Глава 22
- •Глава 22
- •Б. Реакції за участю циклічних форм
- •Глава 22
- •22.1.7. Окремі представники
- •Глава 22 412
- •Глава 22
- •22.2. Дисахариди
- •22.2.1. Відновні дисахариди
- •Глава 22
- •22.2.2. Невідновні дисахариди
- •14 Органічна хімія
- •Глава 22 418
- •22.3. Полісахариди
- •Глава 22 н он н он н он н он
- •Глава 22 422
- •Глава 22 424
- •425 Вуглеводи
- •Глава 23
- •Глава 23
- •23.1.1. Стереоізомерія
- •23.1.2. Фізичні властивості
- •23.1.3. Способи добування
- •23.1.4. Хімічні властивості
- •Глава 23
- •23.2. Будова пептидів і білків
- •Глава 23
- •23.3. Синтез пептидів та їх властивості
- •440 Глава 23
- •23.4. Функції білків в організмі
- •Нуклеїнові кислоти
- •24.1. Будова нуклеїнових кислот
- •Глава 24
- •Глава 24
- •24.2. Рибонуклеїнові (рнк) і дезоксирибонуклеїнові (днк) кислоти
- •Глава 24
- •Глава 24
- •Глава 25
- •Неомилювані ліпіди
- •Глава 25
- •Глава 9. Циклоалкани 86
- •Глава 10. Алкени 98
- •Глава 11. Алкадієни 122
- •Глава 12. Алкіни 135
- •Глава 13. Одноядерні арени 147
- •Глава 14. Природні джерела вуглеводнів 179
- •Глава 15. Гетероциклічні сполуки 187
- •Глава 16. Гідроксильні похідні вуглеводнів 212
- •Глава 17. Насичені альдегіди і кетони 256
- •Глава 18. Монокарбонові кислоти 280
- •Глава 19. Функціональні похідні карбонових кислот 314
- •Глава 20. Гетерофункціональні карбонові кислоти 346
- •Глава 21. Аміни 371
- •Глава 22. Вуглеводи 394 о
- •Глава 23. Білки 426 •
- •Глава 24. Нуклеїнові кислоти 444
- •Глава 25. Ліпіди 453
- •Органічна хімія
- •61002, Харків, вул. Пушкінська, 53.
- •61022, Харків, пл. Свободи, 5, Держпром, 6-й під'їзд, 6-й поверх.
- •61012, Харків, вул. Енгельса, 11.
Глава 15
гетероциклічні сполуки
201
Низькомолекулярний ПВП (молекулярна маса 12—13 тис.) утворює колоїдні розчини у воді й застосовується для приготування кровозамінника «Гемодезу», середньомолекулярний ПВП (м. м. 35— 40 тис.) використовують у фармацевтичній промисловості як зв'язувальний засіб у виробництві таблеток.
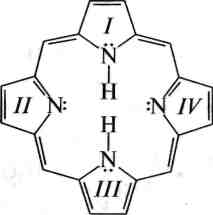
Порфін — кристалічна речовина темно-червоного кольору. За хімічною структурою являє собою макроциклічну спряжену систему, яка складається з пірольного III, піролінового / та двох ізопірольних II, IV ядер, зв'язаних між собою метиновими групами =СН—. Порфін є ароматичною сполукою. Він має площинну будову молекули, містить замкнену спряжену систему з кількістю я-електронів, яка дорівнює 26 (11 л-зв'язків і дві пари неподілених електронів при атомах Нітрогену), що відповідає правилу Хюккеля (4л + 2 при п = 6). Похідні порфіну дістали загальну назву «порфірини». У вигляді комплексів з металами порфірини входять до складу таких важливих природних сполук, як гемоглобін і хлорофіл.
Гемоглобін — це барвна речовина крові, що міститься в еритроцитах. Він являє собою складний білок — хромопротеїд, який складається з білка глобіну та забарвленої в червоний колір небіл-кової частини — гему. За хімічною структурою гем є комплексом порфірину з Ре (II). При кислотному гідролізі гемоглобіну вільний гем легко окиснюється на повітрі з утворенням геміну, який має ту ж саму структуру, що й гем, але містить Ре (III).
Будову геміну встановив 1929 року Г. Фішер, тоді ж він здійс-
нИВ і синтез геміну.
Гем, координаційно сполучений з глобіном, утворює гемоглобін.
Г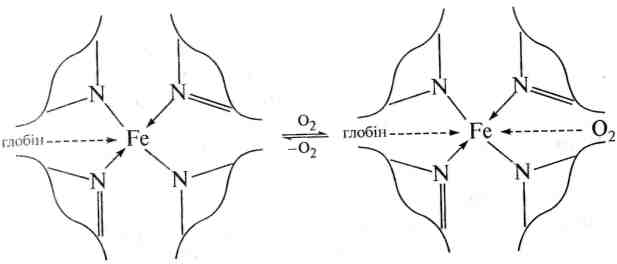 емоглобін
в організмі виконує роль носія кисню
з легенів У тканини. При цьому молекула
кисню зворотньо реагує з гемоглобіном
з утворенням оксигемоглобіну за схемою:
емоглобін
в організмі виконує роль носія кисню
з легенів У тканини. При цьому молекула
кисню зворотньо реагує з гемоглобіном
з утворенням оксигемоглобіну за схемою:
гемоглобін
оксигемоглобін
Деякі речовини, зокрема карбон (II) оксид та солі синильної кислоти, утворюють з гемоглобіном стабільніші комплекси, ніж кисень, і тим самим блокують дію гемоглобіну. Такі сполуки відносять до дихальних отрут.
Частково гідрований порфіновий цикл, координаційно зв'язаний з магнієм, входить до складу зеленого пігменту рослин — хлорофілу. Хлорофіл виконує важливу роль у процесі фотосинтезу, перетворюючи світлову енергію сонячного випромінювання на енергію хімічних зв'язків.
д
Н3С
сн2=сн
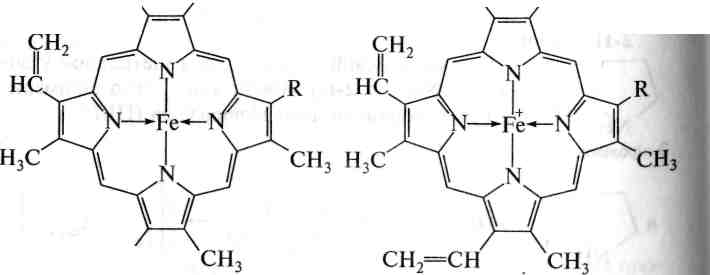
де К: -СН2СН2СООН
н3с
15.5. Шестичленні гетероциклічні сполуки з одним гетероатомом
(Р')5
3(Р)
2
(а)
Найважливішим представником цієї групи сполук є гетероцикл, в якому гетероатомом є атом Нітрогену — піридин.
За хімічною будовою піридин (азин) можна Розглядати як аналог бензену, у молекулі якого група СН заміщена атомом Нітрогену.
Для назв похідних піридину здійснюють нумерацію атомів циклу або позначають їх грецькими літерами. Положення 2,6 називають а,а', положення 3,5 - р,р', положення 4-у.


Гетероциклічні
сполуки
203
Також
піридин можна добути реакцією
ацетилену із
синільною
кислотою:
202
- |
Чг |
С2Н5 |
|
ч*< |
С2Н5 |
|
С2Н А^ |
5 |
2-е а-е |
гилпірид тилпірид |
ин, ин |
3-етилпіридин, р-етилпіридин |
4-етилпіридин, у-етилпіридин |
||||
Способи здобування. Піридин і його монометильні похідні — а-, Р- та у-піколіни містяться в невеликих кількостях у кам'яновугільній смолі (продукт сухої перегонки кам'яного вугілля), звідки їх і виділяють — кожен окремо.
Крім того, існує велика кількість методів синтезу піридину та його гомологів, найважливіші з яких грунтуються на реакції конденсації альдегідів з амоніаком.
Наприклад, з оцтового альдегіду і амоніаку при 400 °С у присутності каталізатора А1203 утворюється суміш, яка складається здебільшого з 2- та 4-метилпіридинів:
СН,
/■■♦
АЬО,
.о
6СН,
2гШ,
Ч
+ зн.о + н,
71Г- СН3 ^гГ
ацетальдегід
а-піколін у-піколін
При нагріванні акролеїну з амоніаком утворюється переважно Р-піколін:
сн,
+ 2Н20
2СН,=СН—С + ИН
Н
\
акролеїн
Р-піколін
Конденсацією ацетальдегіду та формальдегіду з амоніаком добувають незаміщений піридин:
^Х,
+ зн2о + н2
Ч^
2СН3—С + Н—С + ІЧНз ХН ХН
не
,2+
С5Н^
піридин
'
2НС=СН + НСК
Фізичні властивості. Піридин — безбарвна рідина (т. кип. 115 °С) з характерним неприємним запахом. Змішується з водою, етанолом і більшістю органічних розчинників.
Будова та хімічні властивості. За будовою піридин схожий на бензен. Як і бензен, він є ароматичною сполукою, що містить циклічну бл-електронну спряжену систему. Неподілена пара електронів піридинового атома Нітрогену не бере участі в утворенні ароматичного секстету і зумовлює основні властивості сполуки. Проте, на відміну від бензену, у молекулі піридину електронна густина розподілена нерівномірно. Внаслідок електроноакцептор-ного впливу атома Нітрогену в піридиновому циклі на всіх атомах Карбону електронна густина зменшена, причому більшою мірою — в положеннях 2, 4 та 6 (а- та у-положення), меншою — в положеннях 3 та 5 (Р-положення). Тому піридин є ті-дефіцитною ароматичною системою.
5+
+
'6++
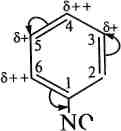
В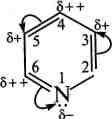 плив
атома Нітрогену на електронну густину
піридинового ядра подібний до впливу
нітрогрупи на бензенове кільце в
молекулі нітробензену:
плив
атома Нітрогену на електронну густину
піридинового ядра подібний до впливу
нітрогрупи на бензенове кільце в
молекулі нітробензену:
піридин
^2 нітробензен
Характерні реакції піридину можна умовно поділити на три
групи:
А. Реакції, що відбуваються з участю гетероатома;
Б. Реакції заміщення атомів Гідрогену піридинового циклу;
В. Реакції відновлення та окиснення.
А. Реакції, що відбуваються з участю гетероатома 1. Взаємодія з кислотами. Піридин є слабкою основою. Основність (див. розд. 6.1) піридину близька до основності аніліну (Ріі—>Ш2). Водні розчини піридину забарвлюють червоний лак-
204
