
- •Передмова
- •Вступ до органічної хімії
- •1.1. Предмет органічної хімії
- •1.2. Короткий огляд історії розвитку органічної хімії
- •Глава 1 6
- •1.3. Розвиток теоретичних уявлень про будову органічних сполук
- •Глава 1
- •1.4. Способи зображення органічних молекул
- •Глава 1
- •2.1. Класифікація органічних сполук
- •Глава 2
- •2.2. Номенклатура органічних сполук
- •Глава 2
- •Глава 2
- •ХїмГчний зв'язок
- •3.1. Типи хімічних зв'язків
- •3.2. Хімічний зв'язок в органічних сполуках
- •3.2.1. Гібридизація атомних орбіталей
- •3.2.2. Ковалентні о- і я-зв'язки
- •3.2.3. Основні характеристики ковалентних зв'язків
- •4.1. Індуктивний ефект
- •Глава 40
- •4.2. Мезомерний ефект (ефект спряження)*
- •Глава 4
- •Глава 4
- •4.4. Надспряження (гіперкон'югація)
- •Глава 4
- •Класифікація ізомерії ізомерія
- •48 Глава 5
- •5.2. Просторова ізомерія (стереоізомерія)
- •Глава 5
- •5.3. Способи зображення просторової будови
- •Глава 5
- •6.1. Кислотність і основність за теорією бренстеда
- •Глава 6
- •6.2. Типи органічних кислот і основ
- •Глава 6
- •6.3. Кислоти і основи льюїса
- •7.1. Поняття про типи механізмів реакцій
- •Глава 7
- •7.2. Поняття про типи органічних реакцій
- •Глава 7
- •Вуглеводні
- •8.1. Електронна та просторова будова алканів
- •8.2. Номенклатура
- •8 .3. Ізомерія
- •8.4. Способи добування
- •8.4.1. Природні джерела
- •8.4.2. Синтетичні методи добування
- •8.5. Фізичні властивості
- •8.6. Хімічні властивості
- •8.6.1. Реакції радикального заміщення (5*)
- •76 Вуглеводні. Глава 8
- •8.6.2. Крекінг
- •8.7. Окремі представники. Застосування
- •1. Напишіть структурні формули наведених вуглеводнів і назвіть їх за раціональною номенклатурою:
- •2. Напишіть структурні формули таких вуглеводнів і назвіть їх за но менклатурою шрас:
- •Ц иклоалкани
- •9.1. Класифікація та номенклатура
- •9.2. Ізомерія
- •9.3. Способи добування. Фізичні властивості
- •9.4. Будова циклоалканів
- •9.5. Хімічні властивості
- •9.6. Окремі представники. Застосування
- •4 Органічна хімія
- •10.1. Номенклатура
- •Перші члени гомологічного ряду алкенів
- •100 Ненасичені вуглеводні. Глава іо
- •10.2. Ізомерія
- •10.3. Електронна і просторова будова алкенів
- •10.4. Способи добування
- •10.5. Фізичні властивості
- •10.6. Хімічні властивості
- •109 Ненасичені вуглеводні. Глава 10 108
- •1 0.6.1. Реакції електрофільного приєднання (ае)
- •10.6.2. Реакції відновлення та окиснення
- •10.6.3. Полімеризація алкенів
- •10.6.4. Алільне галогенування алкенів
- •118 Ненасичені вуглеводні. Глава ю
- •10.7. Окремі представники. Застосування. Ідентифікація
- •0 Контрольні питання та вправи
- •Алкадієни
- •11.2. Будова алкадієнів
- •11.1. Номенклатура
- •11.3. Алкадієни зі спряженими зв'язками 11.3.1. Способи добування
- •11.3.2. Хімічні властивості
- •11.3.3. Натуральний і синтетичний каучук
- •11.4 Окремі представники. Застосування
- •12.1. Номенклатура та ізомерія
- •12.2. Електронна та просторова будова молекул алкінів
- •12.3. Способи добування
- •138 Ненасичені вуглеводні. Глава т2
- •12.4. Фізичні властивості
- •12.5. Хімічні властивості
- •12.5.1. Реакції електрофільного приєднання (ае)
- •12.5.2. Реакції заміщення
- •12.6. Окремі представники. Застосування
- •Одноядерні арени
- •13.1. Будова бензену. Ароматичність
- •13.2. Номенклатура та ізомерія
- •13.3. Способи добування 13.3.1. Природні джерела
- •13.3.2. Синтетичні методи добування
- •13.4. Фізичні властивості
- •13.5. Хімічні властивості
- •13.5.1. Реакції електрофільного заміщення (5£)
- •0/1Ноядєрні аРени
- •13.5.2. Реакції приєднання
- •13.5.3. Реакції окиснення
- •13.5.4. Галогенування гомологів бензену з участю бокового ланцюга
- •165 0ДнояДерн[арени
- •13.6. Вплив замісників у бензеновому кільці на напрямок та швидкість реакцій
- •Електрофільного заміщення
- •13.7. Орієнтація в дизаміщеному бензені
- •1 3.8. Окремі представники. Застосування
- •13.9. Представники багатоядерних аренів
- •13.9.1. Нафтален
- •13.9.2. Антрацен
- •14.1. Природний та попутний нафтовий гази
- •Глава 14
- •14.2. Нафта. Нафтопродукти
- •14.3. Коксування вугілля
- •Глава 1і0у глава Глава 14 186 !
- •15.1. Класифікація та номенклатура
- •15.2. Ароматичність гетероциклів
- •Глава 15
- •15.3. Кислотно-осНбВні властивості гетероциклів
- •15.4. П'ятичленні гетероциклічні сполуки з одним гетероатомом
- •15.4.1. Способи добування
- •15.4.2. Фізичні властивості
- •15.4.3. Хімічні властивості
- •Глава 15
- •15.4.4. Найважливіші похідні піролу
- •Глава 15
- •15.5. Шестичленні гетероциклічні сполуки з одним гетероатомом
- •Глава 15
- •Глава 15
- •В. Реакції відновлення і окиснення
- •15.6. П'яти-1 шестичленні гетероцикли з двома гетероатомами
- •208 Глава 15
- •15.7. Представники конденсованих систем гетероциклів
- •16.1. Одноатомні спирти
- •16.1.1. Номенклатура
- •Глава 16
- •16.1.2. Ізомерія
- •16.1.3. Фізичні властивості
- •Глава 1
- •16.1.4. Способи добування
- •16.1.5. Хімічні властивості
- •16.1.6. Ідентифікація спиртів
- •16.1.7. Окремі представники
- •230 Глава 16
- •16.2.1. Способи добування дво- і триатомних спиртів
- •16.2.2. Фізичні властивості
- •16.2.3. Хімічні властивості
- •16.2.4. Окремі представники
- •16.3.2. Способи добування
- •16.3. Одноатомні феноли 16.3.1. Номенклатура та ізомерія
- •16.3.4. Хімічні властивості
- •16.3.3. Фізичні властивості
- •249 Гідроксильні похідні вуглеводнів
- •В. Реакції відновлення і окиснення
- •255 Гідроксильні похідні вуглеводнів
- •17.1. Номенклатура та ізомерія
- •17.2. Способи добування
- •17.3. Фізичні властивості
- •263 Цясимені альдегіди і кетони
- •269 Насичені альдегіди і кетони
- •271 ИаСйчені альдегіди і кетони
- •17.5. Окремі представники
- •Монокарбонові кислоти
- •18.1. Насичені монокарбонові кислоти
- •18.1.1. Номенклатура та ізомерія
- •18.1.3. Фізичні властивості
- •18.1.4. Хімічні властивості
- •А. Кислотні властивості
- •Г. Окиснення та відновлення
- •18.1.5. Окремі представники
- •18.2. Ненасичені монокарбонові кислоти
- •18.2.1. Номенклатура та ізомерія
- •18.2.2. Способи добування
- •18.2.4. Хімічні властивості
- •18.2.3. Фізичні властивості
- •18.2.5. Окремі представники
- •299 Монокарбонові кислоти
- •18.3. Ароматичні монокарбонові кислоти
- •18.3.1. Способи добування
- •18.3.2. Фізичні властивості
- •18.3.3. Хімічні властивості
- •18.3.4. Окремі представники. Ідентифікація
- •303 Монокарбонові кислоти
- •18.4.1. Номенклатура та ізомерія
- •Назви деяких дикарбонових кислот
- •18.4.2. Способи добування
- •18.4.3. Фізичні властивості
- •18.4.4. Хімічні властивості
- •18.4.5. Окремі представники
- •309 Мриокар6онові кислоти
- •18.5. Ароматичні дикарбонові кислоти
- •310 Карбонові кислоти. Глава и
- •313 Монокарбонові кислоти
- •19.1.2. Способи добування
- •19.1. Галогенангідриди карбонових кислот (ацилгалогеніди)
- •19.1.1. Номенклатура
- •19.1.3. Фізичні властивості
- •19.1.4. Хімічні властивості
- •19.1.5. Окремі представники
- •19.2. Ангідриди карбонових кислот
- •19.2.1. Номенклатура
- •19.2.2. Способи добування
- •19.2.3. Фізичні властивості
- •19.2.4. Хімічні властивості
- •19.2.5. Окремі представники
- •19.3. Естери карбонових кислот
- •19.3.1. Номенклатура
- •19.3.3. Фізичні властивості
- •19.3.4. Хімічні властивості
- •19.3.5. Окремі представники
- •19.4. Жири
- •19.4.1. Номенклатура та ізомерія
- •19.4.2. Способи добування
- •19.4.3. Фізичні властивості
- •19.4.4. Хімічні властивості
- •19.4.5. Воски. Твіни
- •19.5. Аміди карбонових кислот
- •19.5.1. Номенклатура
- •Ацетамщ,
- •19.5.2. Способи добування
- •19.5.3. Фізичні властивості
- •19.5.4. Хімічні властивості
- •19.5.5. Окремі представники
- •19.6. Нітрили (ціаніди)
- •19.6.1. Номенклатура
- •19.6.2. Способи добування
- •19.6.3. Хімічні властивості
- •19.6.4. Окремі представники
- •20.1. Галогенокарбонові кислоти
- •20.1.1. Номенклатура
- •20.1.2. Способи добування
- •20.1.3. Фізичні та хімічні властивості
- •20.2. Гідроксикислоти
- •20.2.2. Оптична ізомерія
- •20.2.3. Аліфатичні пдроксикислоти
- •359 Гетерофункціональні карбонові кислоти
- •Фізичні та хімічні властивості
- •361 Гетерофункціональні карбонові кислоти
- •20.3. Амінокислоти
- •II Амінокислотами називаються похідні карбонових кислот, у вуглеводневому радикалі яких один або кілька атомів Гідрогену замінені аміногрупою.
- •20.3.1. Номенклатура та ізомерія
- •20.3.2. Способи добування
- •20.3.3. Фізичні та хімічні властивості
- •367 Гетерофункціональні карбонові кислоти
- •20.3.4. Окремі представники
- •0 Контрольні питання та вправи
- •21.1. Номенклатура та ізомерія
- •Глава 21
- •Глава 21
- •21.2.1. Способи добування
- •21.2.2. Фізичні властивості. Просторова будова
- •21.2.3. Хімічні властивості
- •Глава 21 378 — —
- •21.3. Ариламіни
- •Глава 21
- •21.3.2. Фізичні та хімічні властивості
- •А. Реакції за участю атома Нітрогену
- •Глава 21
- •Глава 21
- •21.4. Окремі представники. Застосування
- •В. Окислення ариламінів
- •Глава 21
- •Глава 21
- •22.1. Моносахариди
- •22.1.1. Класифікація та номенклатура
- •Глава 22
- •22.1.2. Стереоізомерія
- •Глава 22
- •22.1.3. Будова моносахаридів
- •Глава 22
- •Глава 22 402
- •Глава 22
- •22.1.4. Способи добування
- •22.1.5. Фізичні властивості
- •22.1.6. Хімічні властивості
- •Глава 22
- •Глава 22
- •Б. Реакції за участю циклічних форм
- •Глава 22
- •22.1.7. Окремі представники
- •Глава 22 412
- •Глава 22
- •22.2. Дисахариди
- •22.2.1. Відновні дисахариди
- •Глава 22
- •22.2.2. Невідновні дисахариди
- •14 Органічна хімія
- •Глава 22 418
- •22.3. Полісахариди
- •Глава 22 н он н он н он н он
- •Глава 22 422
- •Глава 22 424
- •425 Вуглеводи
- •Глава 23
- •Глава 23
- •23.1.1. Стереоізомерія
- •23.1.2. Фізичні властивості
- •23.1.3. Способи добування
- •23.1.4. Хімічні властивості
- •Глава 23
- •23.2. Будова пептидів і білків
- •Глава 23
- •23.3. Синтез пептидів та їх властивості
- •440 Глава 23
- •23.4. Функції білків в організмі
- •Нуклеїнові кислоти
- •24.1. Будова нуклеїнових кислот
- •Глава 24
- •Глава 24
- •24.2. Рибонуклеїнові (рнк) і дезоксирибонуклеїнові (днк) кислоти
- •Глава 24
- •Глава 24
- •Глава 25
- •Неомилювані ліпіди
- •Глава 25
- •Глава 9. Циклоалкани 86
- •Глава 10. Алкени 98
- •Глава 11. Алкадієни 122
- •Глава 12. Алкіни 135
- •Глава 13. Одноядерні арени 147
- •Глава 14. Природні джерела вуглеводнів 179
- •Глава 15. Гетероциклічні сполуки 187
- •Глава 16. Гідроксильні похідні вуглеводнів 212
- •Глава 17. Насичені альдегіди і кетони 256
- •Глава 18. Монокарбонові кислоти 280
- •Глава 19. Функціональні похідні карбонових кислот 314
- •Глава 20. Гетерофункціональні карбонові кислоти 346
- •Глава 21. Аміни 371
- •Глава 22. Вуглеводи 394 о
- •Глава 23. Білки 426 •
- •Глава 24. Нуклеїнові кислоти 444
- •Глава 25. Ліпіди 453
- •Органічна хімія
- •61002, Харків, вул. Пушкінська, 53.
- •61022, Харків, пл. Свободи, 5, Держпром, 6-й під'їзд, 6-й поверх.
- •61012, Харків, вул. Енгельса, 11.
14.1. Природний та попутний нафтовий гази
Склад природного газу неоднаковий і залежить від середовища. Крім метану, у ньому присутні тільки найближчі гомологи — етан, пропан, бутан. Природний газ має переваги перед твердим та рідким паливом, а саме: теплота згорання його значно вища,
Таблиця 14.1 Склад і застосування природного та попутного нафтового газів
Природний газ
Попутний нафтовий газ
Склад
Метан - 80...98 %,
гомологи метану
та інші гази — 2...20 %
Метан - 30...40 %,
гомологи метану
та інші гази — 60...70 %
Галузі застосування
Паливо для мартенівських, доменних, скловарних печей, побутових потреб; вихідна сировина для добування ацетилену, водню, сажі, галогенопохідних
Газовий бензин (пентан,
гексан) — добавка до
бензинів;
пропан-бутанова суміш —
паливо;
сухий газ (метан) — паливо;
для органічного синтезу
180
Глава 14
рриродні джерела вуглеводнів
181
Кількість
атомів Карбону в молекулах вуглеводнів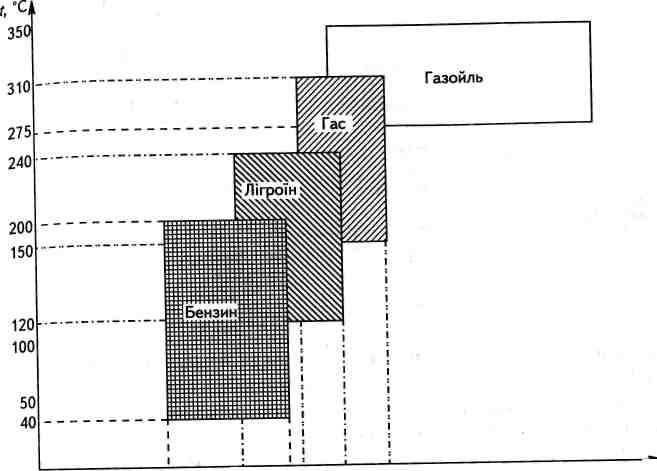
він не залишає попелу, продукти згорання досить чисті в екологічному відношенні.
Попутний нафтовий газ за своїм походженням теж є природним газом. Свою назву він отримав завдяки тому, що розташований над покладами нафти, утворюючи газову «шапку». Раніше попутний газ не знаходив застосування, тому його спалювали, а тепер використовують як паливо та як хімічну сировину. Шляхом хімічної переробки попутного газу можна здобути багато речовин. Склад природного та попутного нафтового газів наведено в табл. 14.1.
14.2. Нафта. Нафтопродукти
Властивості нафти були відомі ще за 400 років до нової ери шумерам, які використовували її як паливо; римляни користувалися нею у воєнних походах; вона входила до складу запалювальних сумішей («грецький вогонь»); а в Стародавньому Єгипті прислужилася для бальзамування. На території нашої країни нафта була відома за п'ять століть до нової ери — в Криму. Добували нафту різними способами і використовували її у «сирому» вигляді.
Перший в Російській імперії нафтопереробний завод, на якому виробляли гас, з'явився 1823 року поблизу міста Моздок.
Великий внесок у розвиток нафтохімії зробив Д. І. Менделєєв. Протягом 40 років свого життя він займався цим питанням. Завдяки його працям з нафти навчилися виділяти понад 10 нафтопродуктів. Питаннями нафтохімії інтенсивно займалися Шухов, Зелинський, Густавсон та інші вчені.
Нафта — масляниста рідина темного кольору з характерним запахом, легша за воду і у воді практично нерозчинна.
Нафта — це суміш парафінів (переважно нормальної будови), циклопарафінів (нафтенів), ароматичних вуглеводнів. Склад нафти змінюється залежно від родовищ. Окрім вуглеводнів, до складу нафти можуть входити гетероциклічні сполуки Оксигену, Суль-фуру, Нітрогену та інших. Загалом нафта містить сотні різних сполук. Сиру нафту тепер не використовують, а піддають переробці. Оскільки нафта — суміш вуглеводнів з різною молекулярною масою, які мають різні температури кипіння, то її первинна переробка полягає в перегонці (дистиляції), за допомогою якої нафту розділяють на окремі фракції (дистиляти) у ректифікаційній колоні (рис. 14.1). Це так звані світлі нафтопродукти.
С5С6 СвСюСцС^ С14С16С18
Рис. 14.1. Продукти перегонки нафти
Бензин — застосовується як пальне для автомашин, літаків, як розчинник тощо.
Лігроїн — пальне для тракторів.
Гас — пальне для тракторних та реактивних двигунів.
Газойль — пальне для дизелів.
Після відгонки світлих нафтопродуктів залишається в'язка чорна рідина — мазут, що підлягає подальшій переробці. З нього виготовляють мастила: тракторні, авіаційні, дизельні та ін. Мазут використовують як рідке пальне в котельних установках. Із деяких видів нафти виділяють суміш твердих вуглеводнів — парафіни; суміш твердих та рідких вуглеводнів — вазелін.
Залишок мазуту після відгонки мастил називається нафтовим пеком, або гудроном, який необхідний для виготовлення асфальту.
Установки для перегонки нафти й мазуту звичайно будують Поруч як атмосферно-вакуумні установки: на атмосферній частині переганяють нафту, на вакуумній — мазут (рис. 14.2).
Мазут не можна переганяти при атмосферному тиску, тому що Молекули вуглеводнів при високій температурі починають розкла-
182
Глава
Природн[ДЖерела вуглеводнів
183

ректифікаційна колона (нормальний тиск)
перегінна колона (вакуум)
А
-легкий бензин ■ лігроїн -гас - газойль
а
газойль
. веретенне мастило
. машинне мастило
г
Ж
сира нафта
. циліндричн мастило
■ кубовий -залишок (мазут)
*3
*&
- кубовий залишок (гудрон)
трубчаста піч
трубчаста піч
Рис. 14.2. Схема переробки нафти методом ректифікації
датися, це явище (крекінг) було застосоване для вторинної переробки нафти з метою підвищення виходу бензину.
Промисловий крекінг-процес був розроблений російським інженером В. Г. Шуховим у 1891 році.
Існує два основні види крекінгу — термічний і каталітичний.
СвН18
С4Н10
Термічний крекінг проводять при нагріванні мазуту до 470— 550 °С під тиском 2—7 МПа. Відбувається розщеплення молекул вуглеводнів на дрібніші, насичені та ненасичені:
С4Н10 + С4Н8 С2Н6 + С2Н4 С3Н6 + СН4
Продути крекінгу розділяють в ректифікаційних колонах.
Бензин термічного крекінгу істотно відрізняється від бензину прямої перегонки: він містить ненасичені вуглеводні, які мають більш високі октанові числа, ніж насичені, тому крекінг-бензин має більшу детонаційну стійкість. Але такий бензин погано зберігається, бо ненасичені вуглеводні здатні до полімеризації, смоло-подібні продукти якої засмічують бензопровід. Для того, щоб крекінг-бензин був більш стійким при зберіганні, до нього додають речовини-антиокисники (антиоксиданти), які заважають його осмоленню.
Каталітичний крекінг проводять у присутності каталізаторів (переважно алюмосилікатів). Застосування каталізаторів дає можливість проводити процес при атмосферному тиску й температурі 450—500 °С з більшою швидкістю і одержувати бензин вищої якості-
В умовах каталітичного крекінгу разом з реакціями розщеплення вуглеводнів відбуваються реакції ізомеризації, тобто перетворення нормальної будови вуглеводнів у розгалужену, що підвищує октанове число. Ненасичених вуглеводнів утворюється в цьому випадку менш, ніж під час термічного крекінгу.
До вторинної переробки відносять також риформінг — процес ароматизації бензинів, який супроводжується перетворенням парафінів, циклопарафінів на ароматичні вуглеводні, що підвищує октанове число бензинів.
Детонаційна стійкість бензину є його важливою характеристикою (згадайте з курсу фізики, як працює двигун внутрішнього згорання). Вибухове згорання бензину називають детонацією. Найменшу стійкість до детонації мають парафіни нормальної будови. Вуглеводні розгалуженої будови, ненасичені та ароматичні — більш стійкі до детонації і зазнають більшого стиснення в потужних двигунах. Кількісною характеристикою детонаційної стійкості бензинів є октанове число. Кожний сорт бензину характеризується певним значенням октанового числа. Октанове число ізооктану (2,2,4-три-метилпентану), який має високу детонаційну стійкість, прийнято за 100. Октанове число н-гептану, який м'яко детонує, прийнято за 0. Суміші н-гептану та ізооктану мають певні октанові числа. Приміром, бензин-76 зазнає такого ж стиснення в циліндрі без детонації, як суміш 76 % ізооктану і 24 % н-гептану.
Бензини прямої перегонки мають низькі октанові числа, їх підвищують за допомогою крекінг-процесу та риформінгу.
.
