
- •Передмова
- •Вступ до органічної хімії
- •1.1. Предмет органічної хімії
- •1.2. Короткий огляд історії розвитку органічної хімії
- •Глава 1 6
- •1.3. Розвиток теоретичних уявлень про будову органічних сполук
- •Глава 1
- •1.4. Способи зображення органічних молекул
- •Глава 1
- •2.1. Класифікація органічних сполук
- •Глава 2
- •2.2. Номенклатура органічних сполук
- •Глава 2
- •Глава 2
- •ХїмГчний зв'язок
- •3.1. Типи хімічних зв'язків
- •3.2. Хімічний зв'язок в органічних сполуках
- •3.2.1. Гібридизація атомних орбіталей
- •3.2.2. Ковалентні о- і я-зв'язки
- •3.2.3. Основні характеристики ковалентних зв'язків
- •4.1. Індуктивний ефект
- •Глава 40
- •4.2. Мезомерний ефект (ефект спряження)*
- •Глава 4
- •Глава 4
- •4.4. Надспряження (гіперкон'югація)
- •Глава 4
- •Класифікація ізомерії ізомерія
- •48 Глава 5
- •5.2. Просторова ізомерія (стереоізомерія)
- •Глава 5
- •5.3. Способи зображення просторової будови
- •Глава 5
- •6.1. Кислотність і основність за теорією бренстеда
- •Глава 6
- •6.2. Типи органічних кислот і основ
- •Глава 6
- •6.3. Кислоти і основи льюїса
- •7.1. Поняття про типи механізмів реакцій
- •Глава 7
- •7.2. Поняття про типи органічних реакцій
- •Глава 7
- •Вуглеводні
- •8.1. Електронна та просторова будова алканів
- •8.2. Номенклатура
- •8 .3. Ізомерія
- •8.4. Способи добування
- •8.4.1. Природні джерела
- •8.4.2. Синтетичні методи добування
- •8.5. Фізичні властивості
- •8.6. Хімічні властивості
- •8.6.1. Реакції радикального заміщення (5*)
- •76 Вуглеводні. Глава 8
- •8.6.2. Крекінг
- •8.7. Окремі представники. Застосування
- •1. Напишіть структурні формули наведених вуглеводнів і назвіть їх за раціональною номенклатурою:
- •2. Напишіть структурні формули таких вуглеводнів і назвіть їх за но менклатурою шрас:
- •Ц иклоалкани
- •9.1. Класифікація та номенклатура
- •9.2. Ізомерія
- •9.3. Способи добування. Фізичні властивості
- •9.4. Будова циклоалканів
- •9.5. Хімічні властивості
- •9.6. Окремі представники. Застосування
- •4 Органічна хімія
- •10.1. Номенклатура
- •Перші члени гомологічного ряду алкенів
- •100 Ненасичені вуглеводні. Глава іо
- •10.2. Ізомерія
- •10.3. Електронна і просторова будова алкенів
- •10.4. Способи добування
- •10.5. Фізичні властивості
- •10.6. Хімічні властивості
- •109 Ненасичені вуглеводні. Глава 10 108
- •1 0.6.1. Реакції електрофільного приєднання (ае)
- •10.6.2. Реакції відновлення та окиснення
- •10.6.3. Полімеризація алкенів
- •10.6.4. Алільне галогенування алкенів
- •118 Ненасичені вуглеводні. Глава ю
- •10.7. Окремі представники. Застосування. Ідентифікація
- •0 Контрольні питання та вправи
- •Алкадієни
- •11.2. Будова алкадієнів
- •11.1. Номенклатура
- •11.3. Алкадієни зі спряженими зв'язками 11.3.1. Способи добування
- •11.3.2. Хімічні властивості
- •11.3.3. Натуральний і синтетичний каучук
- •11.4 Окремі представники. Застосування
- •12.1. Номенклатура та ізомерія
- •12.2. Електронна та просторова будова молекул алкінів
- •12.3. Способи добування
- •138 Ненасичені вуглеводні. Глава т2
- •12.4. Фізичні властивості
- •12.5. Хімічні властивості
- •12.5.1. Реакції електрофільного приєднання (ае)
- •12.5.2. Реакції заміщення
- •12.6. Окремі представники. Застосування
- •Одноядерні арени
- •13.1. Будова бензену. Ароматичність
- •13.2. Номенклатура та ізомерія
- •13.3. Способи добування 13.3.1. Природні джерела
- •13.3.2. Синтетичні методи добування
- •13.4. Фізичні властивості
- •13.5. Хімічні властивості
- •13.5.1. Реакції електрофільного заміщення (5£)
- •0/1Ноядєрні аРени
- •13.5.2. Реакції приєднання
- •13.5.3. Реакції окиснення
- •13.5.4. Галогенування гомологів бензену з участю бокового ланцюга
- •165 0ДнояДерн[арени
- •13.6. Вплив замісників у бензеновому кільці на напрямок та швидкість реакцій
- •Електрофільного заміщення
- •13.7. Орієнтація в дизаміщеному бензені
- •1 3.8. Окремі представники. Застосування
- •13.9. Представники багатоядерних аренів
- •13.9.1. Нафтален
- •13.9.2. Антрацен
- •14.1. Природний та попутний нафтовий гази
- •Глава 14
- •14.2. Нафта. Нафтопродукти
- •14.3. Коксування вугілля
- •Глава 1і0у глава Глава 14 186 !
- •15.1. Класифікація та номенклатура
- •15.2. Ароматичність гетероциклів
- •Глава 15
- •15.3. Кислотно-осНбВні властивості гетероциклів
- •15.4. П'ятичленні гетероциклічні сполуки з одним гетероатомом
- •15.4.1. Способи добування
- •15.4.2. Фізичні властивості
- •15.4.3. Хімічні властивості
- •Глава 15
- •15.4.4. Найважливіші похідні піролу
- •Глава 15
- •15.5. Шестичленні гетероциклічні сполуки з одним гетероатомом
- •Глава 15
- •Глава 15
- •В. Реакції відновлення і окиснення
- •15.6. П'яти-1 шестичленні гетероцикли з двома гетероатомами
- •208 Глава 15
- •15.7. Представники конденсованих систем гетероциклів
- •16.1. Одноатомні спирти
- •16.1.1. Номенклатура
- •Глава 16
- •16.1.2. Ізомерія
- •16.1.3. Фізичні властивості
- •Глава 1
- •16.1.4. Способи добування
- •16.1.5. Хімічні властивості
- •16.1.6. Ідентифікація спиртів
- •16.1.7. Окремі представники
- •230 Глава 16
- •16.2.1. Способи добування дво- і триатомних спиртів
- •16.2.2. Фізичні властивості
- •16.2.3. Хімічні властивості
- •16.2.4. Окремі представники
- •16.3.2. Способи добування
- •16.3. Одноатомні феноли 16.3.1. Номенклатура та ізомерія
- •16.3.4. Хімічні властивості
- •16.3.3. Фізичні властивості
- •249 Гідроксильні похідні вуглеводнів
- •В. Реакції відновлення і окиснення
- •255 Гідроксильні похідні вуглеводнів
- •17.1. Номенклатура та ізомерія
- •17.2. Способи добування
- •17.3. Фізичні властивості
- •263 Цясимені альдегіди і кетони
- •269 Насичені альдегіди і кетони
- •271 ИаСйчені альдегіди і кетони
- •17.5. Окремі представники
- •Монокарбонові кислоти
- •18.1. Насичені монокарбонові кислоти
- •18.1.1. Номенклатура та ізомерія
- •18.1.3. Фізичні властивості
- •18.1.4. Хімічні властивості
- •А. Кислотні властивості
- •Г. Окиснення та відновлення
- •18.1.5. Окремі представники
- •18.2. Ненасичені монокарбонові кислоти
- •18.2.1. Номенклатура та ізомерія
- •18.2.2. Способи добування
- •18.2.4. Хімічні властивості
- •18.2.3. Фізичні властивості
- •18.2.5. Окремі представники
- •299 Монокарбонові кислоти
- •18.3. Ароматичні монокарбонові кислоти
- •18.3.1. Способи добування
- •18.3.2. Фізичні властивості
- •18.3.3. Хімічні властивості
- •18.3.4. Окремі представники. Ідентифікація
- •303 Монокарбонові кислоти
- •18.4.1. Номенклатура та ізомерія
- •Назви деяких дикарбонових кислот
- •18.4.2. Способи добування
- •18.4.3. Фізичні властивості
- •18.4.4. Хімічні властивості
- •18.4.5. Окремі представники
- •309 Мриокар6онові кислоти
- •18.5. Ароматичні дикарбонові кислоти
- •310 Карбонові кислоти. Глава и
- •313 Монокарбонові кислоти
- •19.1.2. Способи добування
- •19.1. Галогенангідриди карбонових кислот (ацилгалогеніди)
- •19.1.1. Номенклатура
- •19.1.3. Фізичні властивості
- •19.1.4. Хімічні властивості
- •19.1.5. Окремі представники
- •19.2. Ангідриди карбонових кислот
- •19.2.1. Номенклатура
- •19.2.2. Способи добування
- •19.2.3. Фізичні властивості
- •19.2.4. Хімічні властивості
- •19.2.5. Окремі представники
- •19.3. Естери карбонових кислот
- •19.3.1. Номенклатура
- •19.3.3. Фізичні властивості
- •19.3.4. Хімічні властивості
- •19.3.5. Окремі представники
- •19.4. Жири
- •19.4.1. Номенклатура та ізомерія
- •19.4.2. Способи добування
- •19.4.3. Фізичні властивості
- •19.4.4. Хімічні властивості
- •19.4.5. Воски. Твіни
- •19.5. Аміди карбонових кислот
- •19.5.1. Номенклатура
- •Ацетамщ,
- •19.5.2. Способи добування
- •19.5.3. Фізичні властивості
- •19.5.4. Хімічні властивості
- •19.5.5. Окремі представники
- •19.6. Нітрили (ціаніди)
- •19.6.1. Номенклатура
- •19.6.2. Способи добування
- •19.6.3. Хімічні властивості
- •19.6.4. Окремі представники
- •20.1. Галогенокарбонові кислоти
- •20.1.1. Номенклатура
- •20.1.2. Способи добування
- •20.1.3. Фізичні та хімічні властивості
- •20.2. Гідроксикислоти
- •20.2.2. Оптична ізомерія
- •20.2.3. Аліфатичні пдроксикислоти
- •359 Гетерофункціональні карбонові кислоти
- •Фізичні та хімічні властивості
- •361 Гетерофункціональні карбонові кислоти
- •20.3. Амінокислоти
- •II Амінокислотами називаються похідні карбонових кислот, у вуглеводневому радикалі яких один або кілька атомів Гідрогену замінені аміногрупою.
- •20.3.1. Номенклатура та ізомерія
- •20.3.2. Способи добування
- •20.3.3. Фізичні та хімічні властивості
- •367 Гетерофункціональні карбонові кислоти
- •20.3.4. Окремі представники
- •0 Контрольні питання та вправи
- •21.1. Номенклатура та ізомерія
- •Глава 21
- •Глава 21
- •21.2.1. Способи добування
- •21.2.2. Фізичні властивості. Просторова будова
- •21.2.3. Хімічні властивості
- •Глава 21 378 — —
- •21.3. Ариламіни
- •Глава 21
- •21.3.2. Фізичні та хімічні властивості
- •А. Реакції за участю атома Нітрогену
- •Глава 21
- •Глава 21
- •21.4. Окремі представники. Застосування
- •В. Окислення ариламінів
- •Глава 21
- •Глава 21
- •22.1. Моносахариди
- •22.1.1. Класифікація та номенклатура
- •Глава 22
- •22.1.2. Стереоізомерія
- •Глава 22
- •22.1.3. Будова моносахаридів
- •Глава 22
- •Глава 22 402
- •Глава 22
- •22.1.4. Способи добування
- •22.1.5. Фізичні властивості
- •22.1.6. Хімічні властивості
- •Глава 22
- •Глава 22
- •Б. Реакції за участю циклічних форм
- •Глава 22
- •22.1.7. Окремі представники
- •Глава 22 412
- •Глава 22
- •22.2. Дисахариди
- •22.2.1. Відновні дисахариди
- •Глава 22
- •22.2.2. Невідновні дисахариди
- •14 Органічна хімія
- •Глава 22 418
- •22.3. Полісахариди
- •Глава 22 н он н он н он н он
- •Глава 22 422
- •Глава 22 424
- •425 Вуглеводи
- •Глава 23
- •Глава 23
- •23.1.1. Стереоізомерія
- •23.1.2. Фізичні властивості
- •23.1.3. Способи добування
- •23.1.4. Хімічні властивості
- •Глава 23
- •23.2. Будова пептидів і білків
- •Глава 23
- •23.3. Синтез пептидів та їх властивості
- •440 Глава 23
- •23.4. Функції білків в організмі
- •Нуклеїнові кислоти
- •24.1. Будова нуклеїнових кислот
- •Глава 24
- •Глава 24
- •24.2. Рибонуклеїнові (рнк) і дезоксирибонуклеїнові (днк) кислоти
- •Глава 24
- •Глава 24
- •Глава 25
- •Неомилювані ліпіди
- •Глава 25
- •Глава 9. Циклоалкани 86
- •Глава 10. Алкени 98
- •Глава 11. Алкадієни 122
- •Глава 12. Алкіни 135
- •Глава 13. Одноядерні арени 147
- •Глава 14. Природні джерела вуглеводнів 179
- •Глава 15. Гетероциклічні сполуки 187
- •Глава 16. Гідроксильні похідні вуглеводнів 212
- •Глава 17. Насичені альдегіди і кетони 256
- •Глава 18. Монокарбонові кислоти 280
- •Глава 19. Функціональні похідні карбонових кислот 314
- •Глава 20. Гетерофункціональні карбонові кислоти 346
- •Глава 21. Аміни 371
- •Глава 22. Вуглеводи 394 о
- •Глава 23. Білки 426 •
- •Глава 24. Нуклеїнові кислоти 444
- •Глава 25. Ліпіди 453
- •Органічна хімія
- •61002, Харків, вул. Пушкінська, 53.
- •61022, Харків, пл. Свободи, 5, Держпром, 6-й під'їзд, 6-й поверх.
- •61012, Харків, вул. Енгельса, 11.
Одноядерні арени
13.1. Будова бензену. Ароматичність
Найпростішим представником одноядерних ароматичних вуглеводнів є бензол С6Н6 (або бензен).
Уперше бензен був здобутий М. Фарадеєм 1825 року з конденсованих залишків світильного газу, який утворюється в процесі переробки кам'яного вугілля. Проте будова його молекули тривалий час залишалася для хіміків загадкою. Незважаючи на те, що формула С6Н6 передбачає досить виражений ненасичений характер, бензен, на відміну від ненасичених сполук, виявився порівняно інертною сполукою. Так, він відносно стійкий до нагрівання та дії окисників, практично не вступає в характерні для ненасичених сполук реакції приєднання. Навпаки, для бензену більш характерними виявилися не властиві ненасиченим сполукам реакції заміщення.
Будові С6Н6 приписувалися різні структурні формули, але всі вони не пояснювали повною мірою хімічні властивості бензену.
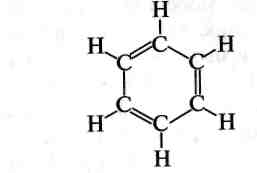
Важливий етап у з'ясуванні будови бензену започаткувала висловлена німецьким хіміком А. Кекуле ідея про циклічну будову його молекули. У 1865 році вчений запропонував формулу у вигляді циклу з шести атомів Карбону з розташованими почергово простими та подвійними зв'язками. Ця формула увійшла в органічну хімію як формула Кекуле:
148
Ненасичені вуглеводні. Глава 13
рдноядерні арени
Ф ормула
Кекуле передбачає рівноцінність усіх
атомів Карбону та Гідрогену в молекулі,
що пізніше було підтверджено дослідженнями
А. Ладенбурга (1874 р.) і Е. А. Вроблевського
(1878 р.).
ормула
Кекуле передбачає рівноцінність усіх
атомів Карбону та Гідрогену в молекулі,
що пізніше було підтверджено дослідженнями
А. Ладенбурга (1874 р.) і Е. А. Вроблевського
(1878 р.).
Проте за формулою Кекуле бензен повинен мати два 1,2-диза-міщені ізомери:
X

Але експериментально було встановлено, що 1,2-дизаміщені бензени не мають ізомерів положення, тобто вони існують у вигляді однієї речовини.
![]()
і
На пояснення цього протиріччя в 1872 році Кекуле висунув осциляційну гіпотезу, за якою три подвійні зв'язки в молекулі бен,-зену не фіксовані, а безперервно переміщуються (осцилюють) між двома можливими положеннями:
Правильно відображаючи деякі властивості бензену, формула Кекуле все ж таки не узгоджувалася з низкою встановлених фактів. Як і раніше, залишалося незрозумілим, чому за наявності в молекулі трьох подвійних зв'язків бензен виявляє значну інертність у реакціях приєднання і набагато більше схильний до реакцій заміщення, чому він стійкий до нагрівання та дії окисників. Усе це змушувало хіміків переглядати структуру бензену.
Розгляньмо електронно-точкову схему утворення молекули бензену у відповідності з теорією Льюїса (рис. 13.1, а).
За сучасними уявленнями, що грунтуються на даних квантової хімії та фізико-хімічних досліджень, молекула бензену являє собою правильний плоский шестикутник. Усі атоми Карбону знаходяться в стані ^-гібридизації. При цьому кожний атом Карбону утворює три а-зв'язки (один С—Н і два С—С), які лежать в одній площині під кутом 120° один до одного (рис. 13.1, б), і надає одну /7-орбіталь для утворення замкненої спряженої л-електронної системи. Електронна густина я-системи розподілена рівномірно (де-
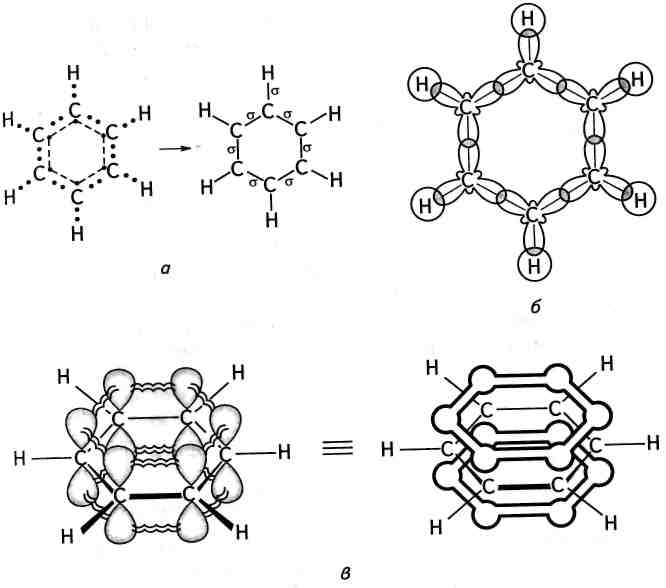
Рис. 13.1. Будова молекули бензену:
а — о-скелет молекули; б — схема утворення о-зв'язків; в — схема утворення
замкненої я-електронної системи
локалізована) між атомами Карбону та сконцентрована переважно над і під площиною о-скелета молекули (рис. 13.1, в).
Обов'язковою умовою повної делокалізації я-електронів, умовою повноти спряження є плоска будова молекули. Утворення замкненої спряженої системи (ароматичного секстету) є для молекули енергетично вигідним процесом. За квантово-механічними Розрахунками Полінга встановлено, що спряження в циклі бензену приводить до зменшення енергії на 150,7 кДж/моль, тобто реально бензен виявився на 150,7 кДж/моль стабільнішим, ніж можна було припустити, виходячи з формули Кекуле. Різниця енергій реального стану молекули бензену і розрахованої для гіпотетичної структури — 1,3,5-циклогексатриєну утворює енергію спряження, або енергію резонансу, і є причиною високої стійкості молекули.
Унаслідок спряження всі карбон-карбонові зв'язки в молекулі бензену вирівняні.
150
Ненасичені вуглеводні. Глава 1
рдноядерні арени
151
фенантрен
14 я-електронів (л=3)
г
,н
Н
І(
> Н^^С°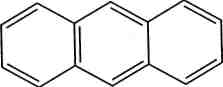
Н в
Рис. 13.2. Геометрія молекули бензену
140 нм
н
Отже, у бензеновому кільці немає простих! і подвійних зв'язків. На кожний карбон-кар-боновий зв'язок, окрім двох а-електронів, при- і падає електронна густина одного л-електро-на. Такий зв'язок називають ароматичним. Якщо довжина простого зв'язку С—С в алка-нах становить 0,154 нм, довжина подвійного зв'язку в алкенах — 0,134 нм, то довжина кар-бон-карбонового зв'язку в молекулі бензену дорівнює 0,140 нм, тобто є проміжною між довжинами одинарного та подвійного зв'язків (рис. 13.2). Делокалізацію я-електронної густини і вирівняність зв'язків у бензеновому кільці графічно зображують у вигляді кола всередині правильного шестикутника:
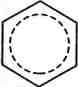
и і
О
або
мезомерні (граничні) структури
Однак поряд з таким зображенням у хімії широко послуговуються і формулою Кекуле, яка особливо зручна для опису механізмів реакцій. Але, застосовуючи формулу Кекуле, необхідно пам'ятати, що я-електронна густина в бензеновому кільці делокалізована, а зв'язки між атомами Карбону вирівняні.
Сукупність специфічних властивостей бензену, а саме висока стабільність, інертність у реакціях приєднання та схильність до реакцій заміщення, одержала назву ароматичність, або ароматичні властивості.
У 1931 році німецький вчений Е. Хюккель на підставі квантово-механічних розрахунків сформулював правило стабільності циклічних спряжених систем, що являє собою теоретично обгрунтований метод, який дозволяє передбачити, буде циклічна спряжена система ароматичною чи ні. За правилом Хюккеля критерієм ароматичності органічної сполуки є наявність в його структурі плоского циклу, який має замкнену спряжену систему із (4л + 2) я-елект-ронів, де п = 1, 2, 3 і т. д. До найбільш поширених ароматичних систем, які містять 6 я-електронів (п = 1), належать бензен і його похідні. Правило Хюккеля застосовують і до систем з конденсованими ядрами, такими, як нафтален, антрацен і фенатрен:
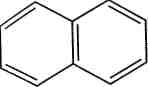
антрацен 14 л-електронів (и=3)
нафтален Ю я-електронів (л=2)
