
- •Передмова
- •Вступ до органічної хімії
- •1.1. Предмет органічної хімії
- •1.2. Короткий огляд історії розвитку органічної хімії
- •Глава 1 6
- •1.3. Розвиток теоретичних уявлень про будову органічних сполук
- •Глава 1
- •1.4. Способи зображення органічних молекул
- •Глава 1
- •2.1. Класифікація органічних сполук
- •Глава 2
- •2.2. Номенклатура органічних сполук
- •Глава 2
- •Глава 2
- •ХїмГчний зв'язок
- •3.1. Типи хімічних зв'язків
- •3.2. Хімічний зв'язок в органічних сполуках
- •3.2.1. Гібридизація атомних орбіталей
- •3.2.2. Ковалентні о- і я-зв'язки
- •3.2.3. Основні характеристики ковалентних зв'язків
- •4.1. Індуктивний ефект
- •Глава 40
- •4.2. Мезомерний ефект (ефект спряження)*
- •Глава 4
- •Глава 4
- •4.4. Надспряження (гіперкон'югація)
- •Глава 4
- •Класифікація ізомерії ізомерія
- •48 Глава 5
- •5.2. Просторова ізомерія (стереоізомерія)
- •Глава 5
- •5.3. Способи зображення просторової будови
- •Глава 5
- •6.1. Кислотність і основність за теорією бренстеда
- •Глава 6
- •6.2. Типи органічних кислот і основ
- •Глава 6
- •6.3. Кислоти і основи льюїса
- •7.1. Поняття про типи механізмів реакцій
- •Глава 7
- •7.2. Поняття про типи органічних реакцій
- •Глава 7
- •Вуглеводні
- •8.1. Електронна та просторова будова алканів
- •8.2. Номенклатура
- •8 .3. Ізомерія
- •8.4. Способи добування
- •8.4.1. Природні джерела
- •8.4.2. Синтетичні методи добування
- •8.5. Фізичні властивості
- •8.6. Хімічні властивості
- •8.6.1. Реакції радикального заміщення (5*)
- •76 Вуглеводні. Глава 8
- •8.6.2. Крекінг
- •8.7. Окремі представники. Застосування
- •1. Напишіть структурні формули наведених вуглеводнів і назвіть їх за раціональною номенклатурою:
- •2. Напишіть структурні формули таких вуглеводнів і назвіть їх за но менклатурою шрас:
- •Ц иклоалкани
- •9.1. Класифікація та номенклатура
- •9.2. Ізомерія
- •9.3. Способи добування. Фізичні властивості
- •9.4. Будова циклоалканів
- •9.5. Хімічні властивості
- •9.6. Окремі представники. Застосування
- •4 Органічна хімія
- •10.1. Номенклатура
- •Перші члени гомологічного ряду алкенів
- •100 Ненасичені вуглеводні. Глава іо
- •10.2. Ізомерія
- •10.3. Електронна і просторова будова алкенів
- •10.4. Способи добування
- •10.5. Фізичні властивості
- •10.6. Хімічні властивості
- •109 Ненасичені вуглеводні. Глава 10 108
- •1 0.6.1. Реакції електрофільного приєднання (ае)
- •10.6.2. Реакції відновлення та окиснення
- •10.6.3. Полімеризація алкенів
- •10.6.4. Алільне галогенування алкенів
- •118 Ненасичені вуглеводні. Глава ю
- •10.7. Окремі представники. Застосування. Ідентифікація
- •0 Контрольні питання та вправи
- •Алкадієни
- •11.2. Будова алкадієнів
- •11.1. Номенклатура
- •11.3. Алкадієни зі спряженими зв'язками 11.3.1. Способи добування
- •11.3.2. Хімічні властивості
- •11.3.3. Натуральний і синтетичний каучук
- •11.4 Окремі представники. Застосування
- •12.1. Номенклатура та ізомерія
- •12.2. Електронна та просторова будова молекул алкінів
- •12.3. Способи добування
- •138 Ненасичені вуглеводні. Глава т2
- •12.4. Фізичні властивості
- •12.5. Хімічні властивості
- •12.5.1. Реакції електрофільного приєднання (ае)
- •12.5.2. Реакції заміщення
- •12.6. Окремі представники. Застосування
- •Одноядерні арени
- •13.1. Будова бензену. Ароматичність
- •13.2. Номенклатура та ізомерія
- •13.3. Способи добування 13.3.1. Природні джерела
- •13.3.2. Синтетичні методи добування
- •13.4. Фізичні властивості
- •13.5. Хімічні властивості
- •13.5.1. Реакції електрофільного заміщення (5£)
- •0/1Ноядєрні аРени
- •13.5.2. Реакції приєднання
- •13.5.3. Реакції окиснення
- •13.5.4. Галогенування гомологів бензену з участю бокового ланцюга
- •165 0ДнояДерн[арени
- •13.6. Вплив замісників у бензеновому кільці на напрямок та швидкість реакцій
- •Електрофільного заміщення
- •13.7. Орієнтація в дизаміщеному бензені
- •1 3.8. Окремі представники. Застосування
- •13.9. Представники багатоядерних аренів
- •13.9.1. Нафтален
- •13.9.2. Антрацен
- •14.1. Природний та попутний нафтовий гази
- •Глава 14
- •14.2. Нафта. Нафтопродукти
- •14.3. Коксування вугілля
- •Глава 1і0у глава Глава 14 186 !
- •15.1. Класифікація та номенклатура
- •15.2. Ароматичність гетероциклів
- •Глава 15
- •15.3. Кислотно-осНбВні властивості гетероциклів
- •15.4. П'ятичленні гетероциклічні сполуки з одним гетероатомом
- •15.4.1. Способи добування
- •15.4.2. Фізичні властивості
- •15.4.3. Хімічні властивості
- •Глава 15
- •15.4.4. Найважливіші похідні піролу
- •Глава 15
- •15.5. Шестичленні гетероциклічні сполуки з одним гетероатомом
- •Глава 15
- •Глава 15
- •В. Реакції відновлення і окиснення
- •15.6. П'яти-1 шестичленні гетероцикли з двома гетероатомами
- •208 Глава 15
- •15.7. Представники конденсованих систем гетероциклів
- •16.1. Одноатомні спирти
- •16.1.1. Номенклатура
- •Глава 16
- •16.1.2. Ізомерія
- •16.1.3. Фізичні властивості
- •Глава 1
- •16.1.4. Способи добування
- •16.1.5. Хімічні властивості
- •16.1.6. Ідентифікація спиртів
- •16.1.7. Окремі представники
- •230 Глава 16
- •16.2.1. Способи добування дво- і триатомних спиртів
- •16.2.2. Фізичні властивості
- •16.2.3. Хімічні властивості
- •16.2.4. Окремі представники
- •16.3.2. Способи добування
- •16.3. Одноатомні феноли 16.3.1. Номенклатура та ізомерія
- •16.3.4. Хімічні властивості
- •16.3.3. Фізичні властивості
- •249 Гідроксильні похідні вуглеводнів
- •В. Реакції відновлення і окиснення
- •255 Гідроксильні похідні вуглеводнів
- •17.1. Номенклатура та ізомерія
- •17.2. Способи добування
- •17.3. Фізичні властивості
- •263 Цясимені альдегіди і кетони
- •269 Насичені альдегіди і кетони
- •271 ИаСйчені альдегіди і кетони
- •17.5. Окремі представники
- •Монокарбонові кислоти
- •18.1. Насичені монокарбонові кислоти
- •18.1.1. Номенклатура та ізомерія
- •18.1.3. Фізичні властивості
- •18.1.4. Хімічні властивості
- •А. Кислотні властивості
- •Г. Окиснення та відновлення
- •18.1.5. Окремі представники
- •18.2. Ненасичені монокарбонові кислоти
- •18.2.1. Номенклатура та ізомерія
- •18.2.2. Способи добування
- •18.2.4. Хімічні властивості
- •18.2.3. Фізичні властивості
- •18.2.5. Окремі представники
- •299 Монокарбонові кислоти
- •18.3. Ароматичні монокарбонові кислоти
- •18.3.1. Способи добування
- •18.3.2. Фізичні властивості
- •18.3.3. Хімічні властивості
- •18.3.4. Окремі представники. Ідентифікація
- •303 Монокарбонові кислоти
- •18.4.1. Номенклатура та ізомерія
- •Назви деяких дикарбонових кислот
- •18.4.2. Способи добування
- •18.4.3. Фізичні властивості
- •18.4.4. Хімічні властивості
- •18.4.5. Окремі представники
- •309 Мриокар6онові кислоти
- •18.5. Ароматичні дикарбонові кислоти
- •310 Карбонові кислоти. Глава и
- •313 Монокарбонові кислоти
- •19.1.2. Способи добування
- •19.1. Галогенангідриди карбонових кислот (ацилгалогеніди)
- •19.1.1. Номенклатура
- •19.1.3. Фізичні властивості
- •19.1.4. Хімічні властивості
- •19.1.5. Окремі представники
- •19.2. Ангідриди карбонових кислот
- •19.2.1. Номенклатура
- •19.2.2. Способи добування
- •19.2.3. Фізичні властивості
- •19.2.4. Хімічні властивості
- •19.2.5. Окремі представники
- •19.3. Естери карбонових кислот
- •19.3.1. Номенклатура
- •19.3.3. Фізичні властивості
- •19.3.4. Хімічні властивості
- •19.3.5. Окремі представники
- •19.4. Жири
- •19.4.1. Номенклатура та ізомерія
- •19.4.2. Способи добування
- •19.4.3. Фізичні властивості
- •19.4.4. Хімічні властивості
- •19.4.5. Воски. Твіни
- •19.5. Аміди карбонових кислот
- •19.5.1. Номенклатура
- •Ацетамщ,
- •19.5.2. Способи добування
- •19.5.3. Фізичні властивості
- •19.5.4. Хімічні властивості
- •19.5.5. Окремі представники
- •19.6. Нітрили (ціаніди)
- •19.6.1. Номенклатура
- •19.6.2. Способи добування
- •19.6.3. Хімічні властивості
- •19.6.4. Окремі представники
- •20.1. Галогенокарбонові кислоти
- •20.1.1. Номенклатура
- •20.1.2. Способи добування
- •20.1.3. Фізичні та хімічні властивості
- •20.2. Гідроксикислоти
- •20.2.2. Оптична ізомерія
- •20.2.3. Аліфатичні пдроксикислоти
- •359 Гетерофункціональні карбонові кислоти
- •Фізичні та хімічні властивості
- •361 Гетерофункціональні карбонові кислоти
- •20.3. Амінокислоти
- •II Амінокислотами називаються похідні карбонових кислот, у вуглеводневому радикалі яких один або кілька атомів Гідрогену замінені аміногрупою.
- •20.3.1. Номенклатура та ізомерія
- •20.3.2. Способи добування
- •20.3.3. Фізичні та хімічні властивості
- •367 Гетерофункціональні карбонові кислоти
- •20.3.4. Окремі представники
- •0 Контрольні питання та вправи
- •21.1. Номенклатура та ізомерія
- •Глава 21
- •Глава 21
- •21.2.1. Способи добування
- •21.2.2. Фізичні властивості. Просторова будова
- •21.2.3. Хімічні властивості
- •Глава 21 378 — —
- •21.3. Ариламіни
- •Глава 21
- •21.3.2. Фізичні та хімічні властивості
- •А. Реакції за участю атома Нітрогену
- •Глава 21
- •Глава 21
- •21.4. Окремі представники. Застосування
- •В. Окислення ариламінів
- •Глава 21
- •Глава 21
- •22.1. Моносахариди
- •22.1.1. Класифікація та номенклатура
- •Глава 22
- •22.1.2. Стереоізомерія
- •Глава 22
- •22.1.3. Будова моносахаридів
- •Глава 22
- •Глава 22 402
- •Глава 22
- •22.1.4. Способи добування
- •22.1.5. Фізичні властивості
- •22.1.6. Хімічні властивості
- •Глава 22
- •Глава 22
- •Б. Реакції за участю циклічних форм
- •Глава 22
- •22.1.7. Окремі представники
- •Глава 22 412
- •Глава 22
- •22.2. Дисахариди
- •22.2.1. Відновні дисахариди
- •Глава 22
- •22.2.2. Невідновні дисахариди
- •14 Органічна хімія
- •Глава 22 418
- •22.3. Полісахариди
- •Глава 22 н он н он н он н он
- •Глава 22 422
- •Глава 22 424
- •425 Вуглеводи
- •Глава 23
- •Глава 23
- •23.1.1. Стереоізомерія
- •23.1.2. Фізичні властивості
- •23.1.3. Способи добування
- •23.1.4. Хімічні властивості
- •Глава 23
- •23.2. Будова пептидів і білків
- •Глава 23
- •23.3. Синтез пептидів та їх властивості
- •440 Глава 23
- •23.4. Функції білків в організмі
- •Нуклеїнові кислоти
- •24.1. Будова нуклеїнових кислот
- •Глава 24
- •Глава 24
- •24.2. Рибонуклеїнові (рнк) і дезоксирибонуклеїнові (днк) кислоти
- •Глава 24
- •Глава 24
- •Глава 25
- •Неомилювані ліпіди
- •Глава 25
- •Глава 9. Циклоалкани 86
- •Глава 10. Алкени 98
- •Глава 11. Алкадієни 122
- •Глава 12. Алкіни 135
- •Глава 13. Одноядерні арени 147
- •Глава 14. Природні джерела вуглеводнів 179
- •Глава 15. Гетероциклічні сполуки 187
- •Глава 16. Гідроксильні похідні вуглеводнів 212
- •Глава 17. Насичені альдегіди і кетони 256
- •Глава 18. Монокарбонові кислоти 280
- •Глава 19. Функціональні похідні карбонових кислот 314
- •Глава 20. Гетерофункціональні карбонові кислоти 346
- •Глава 21. Аміни 371
- •Глава 22. Вуглеводи 394 о
- •Глава 23. Білки 426 •
- •Глава 24. Нуклеїнові кислоти 444
- •Глава 25. Ліпіди 453
- •Органічна хімія
- •61002, Харків, вул. Пушкінська, 53.
- •61022, Харків, пл. Свободи, 5, Держпром, 6-й під'їзд, 6-й поверх.
- •61012, Харків, вул. Енгельса, 11.
12.5.1. Реакції електрофільного приєднання (ае)
Найважливішими реакціями електрофільного приєднання в ряду алшнів є галогенування, гідрогалогенування та гідратація.
Галогенування. Алкіни досить легко приєднують за місцем розриву потрійного зв'язку хлор і бром. У реакцію можуть вступати одна або дві молекули галогену. Унаслідок приєднання однієї мо-
140
Ненасичені вуглеводні. Глава 12
Алкіни
141
л екули
галогену утворюється переважно
от/»о«с-дигалогеналкен. Приєднання
другої молекули галогену відбувається
важче. При цьому
утворюється тетразаміщений алкан й
спостерігається знебарвлення бромної
води (що є якісною реакцією на кратний
зв'язок):
екули
галогену утворюється переважно
от/»о«с-дигалогеналкен. Приєднання
другої молекули галогену відбувається
важче. При цьому
утворюється тетразаміщений алкан й
спостерігається знебарвлення бромної
води (що є якісною реакцією на кратний
зв'язок):
но^сн
Вг2, вод. р-н
Вг2, вод. р-к
- СНВг,—СНВг,
СНВг=СНВг
етш
1,1,2,2-тетраброметан
1,2-диброметен
Вг Вг Н,С—С—СН
?г
\
н3с
н,с—с=сн
Вг2, вод. р-н
Вг2, вод. р-н
г \
Вг Вг
1,1,2,2-тетрабромопропан
Вг Н
1,2-дибромопропен
пропін
Механізм реакції аналогічний галогенуванню алкенів (див. розд. 10.6.1).
неї
н2о
Гідрогалогенування. Алкіни можуть приєднувати одну або дві молекули галогеноводню (НС1, НВг) з утворенням відповідно моногалогенозаміщених алкенів або гемінальних дигалогеналка-нів (обидва атоми галогену знаходяться при одному атомі Карбону). Приєднання до гомологів ацетилену відбувається за правило Марковникова:
СНС1
вінілхлорид
Н3С—СНС12
1,1-дихлоретан
Вг
І Н -> С С С Н -і
3 І
Вг
2,2-дибромопропан
НВг
н,с—с=сн
нс^сн + неї
НВг
н3с—с=сн2
Вг
2-бромопропен
пропін
За механізмом реакція аналогічна гідрогалогенуванню алкенів.
Гідратація (реакція Кучерова). У присутності солей Меркурію (II) як каталізатора алкіни приєднують воду. Приєднання відбувається за правилом Марковникова. При цьому з ацетилену утворюється оцтовий альдегід, інші алкіни утворюють кетони.
Гідратація алкінів проходить стадію утворення ненасичених спиртів, які містять гідроксильну групу при атомі Карбону з подвійним зв'язком. Такі спирти (еноли) є нестійкими сполуками внаслідок відштовхування неподілених електронних пар Оксигену
та я-електронів подвійного зв'язку. У процесі утворення вони ізомеризуються в карбонільні сполуки — альдегіди або кетони. Ця закономірність для ненасичених спиртів була встановлена 1877 року вітчизняним хіміком О. П. Ельтековим і дістала назву правила Ель-щекова:
=с—н
І
он
оцтовий альдегід, етаналь
н,с=
-н
н3о
-с-о
вініловий спирт
но=сн + нон ^£
н3с-с-сн3
н3с—сн=сн2 он
о
нс-о=сн + нон 38-
ацетон, " диметилкетон
Реакцію гідратації алкінів відкрив 1881 року російський хімік М. Г. Кучеров. Цією реакцією в промисловості з ацетилену одержують оцтовий альдегід.
12.5.2. Реакції заміщення
Ці реакції характерні для ацетилену і алкінів з кінцевим потрійним зв'язком К—С^СН, які мають назву термінальні алкіни.
Утворення ацетиленідів. Ацетилен та інші алкіни з кінцевим потрійним зв'язком вступають у реакцію з деякими основами, такими, як натрій амід Наг>ІН2 у рідкому амоніаку, солі Купру-му (І) і Аргентуму у водно-аміачному розчині [Си(Т\ІН3)2ОН, А§(]ЧН3)2ОН]. При цьому Гідроген при атомі Карбону з потрійним зв'язком заміщується на метал, унаслідок чого утворюються солі — ацетиленіди:
НЄ=СН + 2[А§(г<Н3)2]ОН
- Аз—с==с—А§| + 4>Ш3 + 2Н20
аргентум ацетиленід
К-С-СН + [Си(МН3)2]ОН — К-С^С-Си* + 2КН3 + 2Н20
купрум ацетиленід
К-С=СН + ИагШ2 К—С^С—N3 + ІЧН3
натрій ацетиленід
142
Ненасичені вуглеводні. Глава 12 і
Алкіни
143

Аналогічно відбувається реакція з магнійорганічними сполуками (реактивами Гріньяра):
к—о=сн + с2н5—меі —- к—с^с—м§і + с2н6
Металічні похідні алкінів є вельми реакційноздатними сполуками. (Ще раз пригадайте, з чим пов'язані слабкі кислотні властивості ацетилену та іншіх термінальних алкінів).
Під дією хлоридної кислоти ацетиленіди розкладаються з виділенням вихідного алкіну:
К— О^С—N3 + НС1 К—С^С—Н + N30
Цю реакцію застосовують для виділення алкінів у чистому вигляді із сумішей з іншими вуглеводнями.
12.5.3. РЕАКЦІЇ ОКИСНЕННЯ ТА ВІДНОВЛЕННЯ
Окиснення алкінів. Алкіни подібно до алкенів легко окиснюють-ся. Як окисник використовують калій перманганат в нейтральному або лужному середовищі, озон. При окисненні калій перманганатом у лужному середовищі або озоном відбувається розщеплення молекули алкіну за місцем розриву потрійного зв'язку і утворюються карбонові кислоти:
НС=СН+4[0]
КМп04,Н20
* НООС—СООН
щавлева, етандіова кислота
КМп04, ОН"
Н3С СН2 С=С—СН-і
2-пентин
Н3С—СН2—СООН + СН3—СООН
пропанова кислота етанова кислота
Алкіни з кінцевим потрійним зв'язком при окисненні за цих умов утворюють карбонову кислоту і карбон (IV) оксид:
Н3С—СН2—О^СН
1-бутин
Н3С—СН2—СООН + С02
пропанова кислота
Відновлення алкінів. У присутності каталізаторів Реї, Рі або № алкіни відновлюються з утворенням алканів. Приєднання водню здійснюється ступінчасто:
нс^сн + н2 -=*« н2с=сн2 -^^ н3с-сн3 НзС_с^сн &=± н3с-сн=сн2 ^^ н3с-сн2-сн3
с„н2п+2
Н2, кат. Н2, кат.
с„н2„_2 -1— с„н2п -
Утворений як проміжний продукт алкен не вдається виділити через його швидке перетворення на алкан.
12.5.4. ДИМЕРИЗАЦІЯ І ТРИМЕРИЗАЦІЯ АЛКІНІВ
У присутності купрум (І) хлориду і амоній хлориду ацетилен димеризується з утворенням вінілацетилену:
ц—о=с—н + нс=сн
♦ нс^с—сн=сн2
вінілацетилен
Ця реакція має важливе промислове значення, бо вінілацетилен є проміжним продуктом у виробництві синтетичних каучуків.
При нагріванні в присутності каталізаторів, наприклад активованого вугілля, алкіни піддаються циклотримеризації з утворенням бензену і заміщених бензенів:
зне^сн
800 °С
бензен
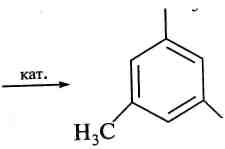
сн,
з н3с—о^сн
сн3
1,3,5-триметил бензен
