
- •Передмова
- •Вступ до органічної хімії
- •1.1. Предмет органічної хімії
- •1.2. Короткий огляд історії розвитку органічної хімії
- •Глава 1 6
- •1.3. Розвиток теоретичних уявлень про будову органічних сполук
- •Глава 1
- •1.4. Способи зображення органічних молекул
- •Глава 1
- •2.1. Класифікація органічних сполук
- •Глава 2
- •2.2. Номенклатура органічних сполук
- •Глава 2
- •Глава 2
- •ХїмГчний зв'язок
- •3.1. Типи хімічних зв'язків
- •3.2. Хімічний зв'язок в органічних сполуках
- •3.2.1. Гібридизація атомних орбіталей
- •3.2.2. Ковалентні о- і я-зв'язки
- •3.2.3. Основні характеристики ковалентних зв'язків
- •4.1. Індуктивний ефект
- •Глава 40
- •4.2. Мезомерний ефект (ефект спряження)*
- •Глава 4
- •Глава 4
- •4.4. Надспряження (гіперкон'югація)
- •Глава 4
- •Класифікація ізомерії ізомерія
- •48 Глава 5
- •5.2. Просторова ізомерія (стереоізомерія)
- •Глава 5
- •5.3. Способи зображення просторової будови
- •Глава 5
- •6.1. Кислотність і основність за теорією бренстеда
- •Глава 6
- •6.2. Типи органічних кислот і основ
- •Глава 6
- •6.3. Кислоти і основи льюїса
- •7.1. Поняття про типи механізмів реакцій
- •Глава 7
- •7.2. Поняття про типи органічних реакцій
- •Глава 7
- •Вуглеводні
- •8.1. Електронна та просторова будова алканів
- •8.2. Номенклатура
- •8 .3. Ізомерія
- •8.4. Способи добування
- •8.4.1. Природні джерела
- •8.4.2. Синтетичні методи добування
- •8.5. Фізичні властивості
- •8.6. Хімічні властивості
- •8.6.1. Реакції радикального заміщення (5*)
- •76 Вуглеводні. Глава 8
- •8.6.2. Крекінг
- •8.7. Окремі представники. Застосування
- •1. Напишіть структурні формули наведених вуглеводнів і назвіть їх за раціональною номенклатурою:
- •2. Напишіть структурні формули таких вуглеводнів і назвіть їх за но менклатурою шрас:
- •Ц иклоалкани
- •9.1. Класифікація та номенклатура
- •9.2. Ізомерія
- •9.3. Способи добування. Фізичні властивості
- •9.4. Будова циклоалканів
- •9.5. Хімічні властивості
- •9.6. Окремі представники. Застосування
- •4 Органічна хімія
- •10.1. Номенклатура
- •Перші члени гомологічного ряду алкенів
- •100 Ненасичені вуглеводні. Глава іо
- •10.2. Ізомерія
- •10.3. Електронна і просторова будова алкенів
- •10.4. Способи добування
- •10.5. Фізичні властивості
- •10.6. Хімічні властивості
- •109 Ненасичені вуглеводні. Глава 10 108
- •1 0.6.1. Реакції електрофільного приєднання (ае)
- •10.6.2. Реакції відновлення та окиснення
- •10.6.3. Полімеризація алкенів
- •10.6.4. Алільне галогенування алкенів
- •118 Ненасичені вуглеводні. Глава ю
- •10.7. Окремі представники. Застосування. Ідентифікація
- •0 Контрольні питання та вправи
- •Алкадієни
- •11.2. Будова алкадієнів
- •11.1. Номенклатура
- •11.3. Алкадієни зі спряженими зв'язками 11.3.1. Способи добування
- •11.3.2. Хімічні властивості
- •11.3.3. Натуральний і синтетичний каучук
- •11.4 Окремі представники. Застосування
- •12.1. Номенклатура та ізомерія
- •12.2. Електронна та просторова будова молекул алкінів
- •12.3. Способи добування
- •138 Ненасичені вуглеводні. Глава т2
- •12.4. Фізичні властивості
- •12.5. Хімічні властивості
- •12.5.1. Реакції електрофільного приєднання (ае)
- •12.5.2. Реакції заміщення
- •12.6. Окремі представники. Застосування
- •Одноядерні арени
- •13.1. Будова бензену. Ароматичність
- •13.2. Номенклатура та ізомерія
- •13.3. Способи добування 13.3.1. Природні джерела
- •13.3.2. Синтетичні методи добування
- •13.4. Фізичні властивості
- •13.5. Хімічні властивості
- •13.5.1. Реакції електрофільного заміщення (5£)
- •0/1Ноядєрні аРени
- •13.5.2. Реакції приєднання
- •13.5.3. Реакції окиснення
- •13.5.4. Галогенування гомологів бензену з участю бокового ланцюга
- •165 0ДнояДерн[арени
- •13.6. Вплив замісників у бензеновому кільці на напрямок та швидкість реакцій
- •Електрофільного заміщення
- •13.7. Орієнтація в дизаміщеному бензені
- •1 3.8. Окремі представники. Застосування
- •13.9. Представники багатоядерних аренів
- •13.9.1. Нафтален
- •13.9.2. Антрацен
- •14.1. Природний та попутний нафтовий гази
- •Глава 14
- •14.2. Нафта. Нафтопродукти
- •14.3. Коксування вугілля
- •Глава 1і0у глава Глава 14 186 !
- •15.1. Класифікація та номенклатура
- •15.2. Ароматичність гетероциклів
- •Глава 15
- •15.3. Кислотно-осНбВні властивості гетероциклів
- •15.4. П'ятичленні гетероциклічні сполуки з одним гетероатомом
- •15.4.1. Способи добування
- •15.4.2. Фізичні властивості
- •15.4.3. Хімічні властивості
- •Глава 15
- •15.4.4. Найважливіші похідні піролу
- •Глава 15
- •15.5. Шестичленні гетероциклічні сполуки з одним гетероатомом
- •Глава 15
- •Глава 15
- •В. Реакції відновлення і окиснення
- •15.6. П'яти-1 шестичленні гетероцикли з двома гетероатомами
- •208 Глава 15
- •15.7. Представники конденсованих систем гетероциклів
- •16.1. Одноатомні спирти
- •16.1.1. Номенклатура
- •Глава 16
- •16.1.2. Ізомерія
- •16.1.3. Фізичні властивості
- •Глава 1
- •16.1.4. Способи добування
- •16.1.5. Хімічні властивості
- •16.1.6. Ідентифікація спиртів
- •16.1.7. Окремі представники
- •230 Глава 16
- •16.2.1. Способи добування дво- і триатомних спиртів
- •16.2.2. Фізичні властивості
- •16.2.3. Хімічні властивості
- •16.2.4. Окремі представники
- •16.3.2. Способи добування
- •16.3. Одноатомні феноли 16.3.1. Номенклатура та ізомерія
- •16.3.4. Хімічні властивості
- •16.3.3. Фізичні властивості
- •249 Гідроксильні похідні вуглеводнів
- •В. Реакції відновлення і окиснення
- •255 Гідроксильні похідні вуглеводнів
- •17.1. Номенклатура та ізомерія
- •17.2. Способи добування
- •17.3. Фізичні властивості
- •263 Цясимені альдегіди і кетони
- •269 Насичені альдегіди і кетони
- •271 ИаСйчені альдегіди і кетони
- •17.5. Окремі представники
- •Монокарбонові кислоти
- •18.1. Насичені монокарбонові кислоти
- •18.1.1. Номенклатура та ізомерія
- •18.1.3. Фізичні властивості
- •18.1.4. Хімічні властивості
- •А. Кислотні властивості
- •Г. Окиснення та відновлення
- •18.1.5. Окремі представники
- •18.2. Ненасичені монокарбонові кислоти
- •18.2.1. Номенклатура та ізомерія
- •18.2.2. Способи добування
- •18.2.4. Хімічні властивості
- •18.2.3. Фізичні властивості
- •18.2.5. Окремі представники
- •299 Монокарбонові кислоти
- •18.3. Ароматичні монокарбонові кислоти
- •18.3.1. Способи добування
- •18.3.2. Фізичні властивості
- •18.3.3. Хімічні властивості
- •18.3.4. Окремі представники. Ідентифікація
- •303 Монокарбонові кислоти
- •18.4.1. Номенклатура та ізомерія
- •Назви деяких дикарбонових кислот
- •18.4.2. Способи добування
- •18.4.3. Фізичні властивості
- •18.4.4. Хімічні властивості
- •18.4.5. Окремі представники
- •309 Мриокар6онові кислоти
- •18.5. Ароматичні дикарбонові кислоти
- •310 Карбонові кислоти. Глава и
- •313 Монокарбонові кислоти
- •19.1.2. Способи добування
- •19.1. Галогенангідриди карбонових кислот (ацилгалогеніди)
- •19.1.1. Номенклатура
- •19.1.3. Фізичні властивості
- •19.1.4. Хімічні властивості
- •19.1.5. Окремі представники
- •19.2. Ангідриди карбонових кислот
- •19.2.1. Номенклатура
- •19.2.2. Способи добування
- •19.2.3. Фізичні властивості
- •19.2.4. Хімічні властивості
- •19.2.5. Окремі представники
- •19.3. Естери карбонових кислот
- •19.3.1. Номенклатура
- •19.3.3. Фізичні властивості
- •19.3.4. Хімічні властивості
- •19.3.5. Окремі представники
- •19.4. Жири
- •19.4.1. Номенклатура та ізомерія
- •19.4.2. Способи добування
- •19.4.3. Фізичні властивості
- •19.4.4. Хімічні властивості
- •19.4.5. Воски. Твіни
- •19.5. Аміди карбонових кислот
- •19.5.1. Номенклатура
- •Ацетамщ,
- •19.5.2. Способи добування
- •19.5.3. Фізичні властивості
- •19.5.4. Хімічні властивості
- •19.5.5. Окремі представники
- •19.6. Нітрили (ціаніди)
- •19.6.1. Номенклатура
- •19.6.2. Способи добування
- •19.6.3. Хімічні властивості
- •19.6.4. Окремі представники
- •20.1. Галогенокарбонові кислоти
- •20.1.1. Номенклатура
- •20.1.2. Способи добування
- •20.1.3. Фізичні та хімічні властивості
- •20.2. Гідроксикислоти
- •20.2.2. Оптична ізомерія
- •20.2.3. Аліфатичні пдроксикислоти
- •359 Гетерофункціональні карбонові кислоти
- •Фізичні та хімічні властивості
- •361 Гетерофункціональні карбонові кислоти
- •20.3. Амінокислоти
- •II Амінокислотами називаються похідні карбонових кислот, у вуглеводневому радикалі яких один або кілька атомів Гідрогену замінені аміногрупою.
- •20.3.1. Номенклатура та ізомерія
- •20.3.2. Способи добування
- •20.3.3. Фізичні та хімічні властивості
- •367 Гетерофункціональні карбонові кислоти
- •20.3.4. Окремі представники
- •0 Контрольні питання та вправи
- •21.1. Номенклатура та ізомерія
- •Глава 21
- •Глава 21
- •21.2.1. Способи добування
- •21.2.2. Фізичні властивості. Просторова будова
- •21.2.3. Хімічні властивості
- •Глава 21 378 — —
- •21.3. Ариламіни
- •Глава 21
- •21.3.2. Фізичні та хімічні властивості
- •А. Реакції за участю атома Нітрогену
- •Глава 21
- •Глава 21
- •21.4. Окремі представники. Застосування
- •В. Окислення ариламінів
- •Глава 21
- •Глава 21
- •22.1. Моносахариди
- •22.1.1. Класифікація та номенклатура
- •Глава 22
- •22.1.2. Стереоізомерія
- •Глава 22
- •22.1.3. Будова моносахаридів
- •Глава 22
- •Глава 22 402
- •Глава 22
- •22.1.4. Способи добування
- •22.1.5. Фізичні властивості
- •22.1.6. Хімічні властивості
- •Глава 22
- •Глава 22
- •Б. Реакції за участю циклічних форм
- •Глава 22
- •22.1.7. Окремі представники
- •Глава 22 412
- •Глава 22
- •22.2. Дисахариди
- •22.2.1. Відновні дисахариди
- •Глава 22
- •22.2.2. Невідновні дисахариди
- •14 Органічна хімія
- •Глава 22 418
- •22.3. Полісахариди
- •Глава 22 н он н он н он н он
- •Глава 22 422
- •Глава 22 424
- •425 Вуглеводи
- •Глава 23
- •Глава 23
- •23.1.1. Стереоізомерія
- •23.1.2. Фізичні властивості
- •23.1.3. Способи добування
- •23.1.4. Хімічні властивості
- •Глава 23
- •23.2. Будова пептидів і білків
- •Глава 23
- •23.3. Синтез пептидів та їх властивості
- •440 Глава 23
- •23.4. Функції білків в організмі
- •Нуклеїнові кислоти
- •24.1. Будова нуклеїнових кислот
- •Глава 24
- •Глава 24
- •24.2. Рибонуклеїнові (рнк) і дезоксирибонуклеїнові (днк) кислоти
- •Глава 24
- •Глава 24
- •Глава 25
- •Неомилювані ліпіди
- •Глава 25
- •Глава 9. Циклоалкани 86
- •Глава 10. Алкени 98
- •Глава 11. Алкадієни 122
- •Глава 12. Алкіни 135
- •Глава 13. Одноядерні арени 147
- •Глава 14. Природні джерела вуглеводнів 179
- •Глава 15. Гетероциклічні сполуки 187
- •Глава 16. Гідроксильні похідні вуглеводнів 212
- •Глава 17. Насичені альдегіди і кетони 256
- •Глава 18. Монокарбонові кислоти 280
- •Глава 19. Функціональні похідні карбонових кислот 314
- •Глава 20. Гетерофункціональні карбонові кислоти 346
- •Глава 21. Аміни 371
- •Глава 22. Вуглеводи 394 о
- •Глава 23. Білки 426 •
- •Глава 24. Нуклеїнові кислоти 444
- •Глава 25. Ліпіди 453
- •Органічна хімія
- •61002, Харків, вул. Пушкінська, 53.
- •61022, Харків, пл. Свободи, 5, Держпром, 6-й під'їзд, 6-й поверх.
- •61012, Харків, вул. Енгельса, 11.
1.3. Розвиток теоретичних уявлень про будову органічних сполук
Поява перших теорій про будову органічних сполук припадає на аналітичний період історії органічної хімії. На початку XIX століття, під час дослідження органічних сполук, хіміки звернули увагу на те, що в низці хімічних перетворень окремі групи атомів, так звані радикали, у незміненому вигляді переходять з однієї речовини в іншу (Ж. Гей-Люссак, 1815 р., Ф. Велер і Ю. Лі-біх, 1832 р.). На підставі створеної в 1812 році Й. Берцеліусом електрохімічної теорії, яка стверджувала, що всі хімічні сполуки побудовані з електропозитивних і електронегативних атомів або атомних груп, які утримуються за рахунок електростатичних сил, кілька вчених створили першу теорію в органічній хімії — теорію радикалів (Ю. Лібіх, Ф. Велер, Й. Берцеліус).
Автори цієї теорії вважали, що оскільки радикали не змінюються при хімічних перетвореннях, то подібно до того, як неорганічні речовини складаються з атомів, органічні — з радикалів.
У 1833—1834 роки французький хімік Ж. Дюма, вивчаючи дію хлору на органічні сполуки, встановив, що в органічних радикалах атоми Гідрогену можуть заміщуватися на Хлор, тобто радикал може змінюватись. Ці дослідження завдали нищівного удару по теорії радикалів.
8
Глава 1
Вступ до органічної хімії
9
У 40-ві роки XIX століття теорію радикалів змінила досконаліша теорія типів, засновником якої є французький хімік ПІ. Жерар. На відміну від теорії радикалів, яка акцентує увагу на хімічних перетвореннях у незмінній частині молекули — радикалі, теорія типів з'явилася в результаті узагальнення спостережень за змінною частиною молекули (сьогодні ми називаємо її функціональною групою). Ці спостереження лягли в основу класифікації органічних сполук за типами хімічних перетворень. Спочатку були виділені аналоги (типи) води, хлороводню, амоніаку, водню, потім з'явився тип метану.
Нл
н}°
сп;
}
:>
діетиловий етер
с2н5і
СІ /
етилхлорид СН3)
сн3[к
Н і
диметиламін
етиловий спирт
сн,
метилхлорид
сн,
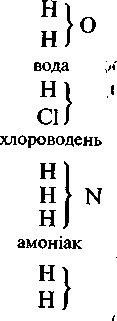
Тип води
Тип хлороводню
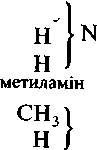
Тип амоніаку
С2Н
н5і н /
Тип водню
етан
водень
Наведені типові формули показують, наприклад, що при заміщенні в молекулі-води одного атома Гідрогену на залишок С2Н5 утворюється етиловий спирт, а при заміщенні двох — діетиловий етер і т. д.
До середини XIX століття внаслідок появи великого експериментального матеріалу теорія типів уже не була спроможною пояснити багато фактів. Намагаючись врятувати теорію, її прихильники вводили нові типи. Часто ту ж саму сполуку доводилось відносити до кількох типів і позначати різними типовими формулами.
Для подальшого розвитку органічної хімії потрібна була нова, досконаліша теорія. Заслуга створення такої теорії, що заклала наукові підвалини органічної хімії, належить видатному російському вченому О. М. Бутлерову. Спираючись на відкриття німецького хіміка Ф. Кекуле про чотиривалентність атома Карбону (1857 р.) та шотландського хіміка А. Купера про здатність атомів Карбону з'єднуватись у довгі ланцюги (1858 р.), О. М. Бутлеров створив теорію хімічної будови органічних сполук, основні принципи якої виклав у доповіді «Про теорію хімічної будови» на міжнародному з'їзді природознавців та лікарів у Шпейєрі 19 вересня 1861 року.
Основні положення теорії хімічної будови такі:
Атоми, що входять до складу молекул органічних сполук, зв'язані між собою в суворо визначеному порядку, згідно з їх валентністю. Послідовність зв'язування атомів у молекулі називається хімічною будовою.
Властивості речовини залежать не лише від того, які атоми і в якій кількості входять до складу її молекули, але й від того, в якій послідовності вони зв'язані між собою, тобто від хімічної будови молекули.
Атоми або групи атомів, які утворюють молекулу, зв'язані як безпосередньо, так і через інші атоми, взаємно впливають один на одного, від чого залежить реакційна здатність молекули.
За реакційною здатністю речовини можна встановити її будову і навпаки, за будовою речовини можна робити висновок про її властивості.
Теорія хімічної будови О. М. Бутлерова дозволила не лише систематизувати зібраний на той час в органічній хімії величезний матеріал, але й передбачити існування нових сполук, а також указати шляхи їх одержання. За важливістю її можна порівняти з періодичною системою Д. І. Менделєєва. Блискучим підтвердженням теорії було одержання в 1867 році ізобутану, передбаченого О. М. Бут-леровим.
Теорія хімічної будови О. М. Бутлерова є найважливішою частиною теоретичного фундаменту органічної хімії. Подальшого розвитку вона набула в працях учня О. М. Бутлерова — В. В. Марков-никова, який установив закономірності взаємного впливу атомів у молекулах.
У 1874 році теорію хімічної будови доповнила теорія просторового розташування атомів у молекулах (стереохімічна теорія). Автори цієї теорії голландський хімік Я. Вант-Гофф та французький Ж. Ле-Бель незалежно один від одного дійшли висновку про тетраедричну напрямленість зв'язків атома Карбону в просторі (чотири валентності атома Карбону направлені до кутів тетраедра, у центрі якого знаходиться атом Карбону).
Подальшому розвитку теорії хімічної будови сприяло впровадження в органічну хімію електронних уявлень. У 1916 році американським ученим Дж. Льюїсом була запропонована електронна теорія хімічного зв'язку (так звана теорія електронних пар), за якою хімічний зв'язок в органічних сполуках представлено парою елек-

11
Для
зручності записування часто обирають
скорочену
структурну
формулу, в
якій частина зв'язків не позначається,
а наводяться лише
ті, які необхідні для однозначного
опису структури молекули:
Н3С—СН—СН3
або (СН3)2СНСН3
Н3С—СН—СН3
або СН3СОСН3
II 3
** ацетон
Існує
також спрощений спосіб написання
структурних формул, який полягає в
тому, що карбоновий скелет молекули
зображують тільки за допомогою
валентних зв'язків, без позначення
атомів Карбону та зв'язків С—Н :
тронів, виділених по одному кожним з атомів, що зв'язуються. Окрім цього, Г. Льюїс висловив припущення, що електронна пара, яка бере участь в утворенні хімічного зв'язку, може зміщуватись до одного з атомів. Ця думка виявилася надзвичайно важливою і була покладена в основу теорії електронних зміщень. У працях Р. Робін-сона (1922 р.), а пізніше К. Інгольда (1926—1934 рр.) було впроваджено і розвинуто уявлення про зміщення електронів у простих (індуктивний ефект) та кратних зв'язках (мезомерний ефект). Теорія електронних зміщень набула досить значного поширення в органічній хімії, оскільки вона дозволяла встановити залежність між електронною будовою та реакційною здатністю органічних сполук.
Новим етапом у розвитку теорії хімічної будови стало застосування в 30-ті роки XX століття в органічній хімії квантової механіки. У цей час були розроблені квантово-механічні методи опису структури молекул — метод молекулярних орбіталей (Дж. Ленард-Джонсон, Р. Маллікен, Ф. Хунд, 1928—1932 рр.) та метод валентних зв'язків (Л. Полінг, Дж. Слейтер, 1931—1934 рр.). На підставі методу валентних зв'язків Л. Полінг розробив теорію резонансу, яка дозволила пояснити властивості ароматичних систем. За допомогою методу молекулярних орбіталей Е. Хюккель дав пояснення стійкості ароматичних систем і сформулював теоретично обґрунтоване правило, що дозволяє передбачити, буде система ароматичною чи ні (правило Хюккеля). Інтенсивного розвитку квантово-механічні дослідження набули з появою в 60-ті роки XX століття електронно-обчислювальної техніки.
Вступ до органічної хімії
1
СН3
ізобутан
бутан
V
циклопропан
Н2С—СН2 або СН2СН2СН2 СНч
Ч*^
циклопропан
![]()
