
- •Передмова
- •Вступ до органічної хімії
- •1.1. Предмет органічної хімії
- •1.2. Короткий огляд історії розвитку органічної хімії
- •Глава 1 6
- •1.3. Розвиток теоретичних уявлень про будову органічних сполук
- •Глава 1
- •1.4. Способи зображення органічних молекул
- •Глава 1
- •2.1. Класифікація органічних сполук
- •Глава 2
- •2.2. Номенклатура органічних сполук
- •Глава 2
- •Глава 2
- •ХїмГчний зв'язок
- •3.1. Типи хімічних зв'язків
- •3.2. Хімічний зв'язок в органічних сполуках
- •3.2.1. Гібридизація атомних орбіталей
- •3.2.2. Ковалентні о- і я-зв'язки
- •3.2.3. Основні характеристики ковалентних зв'язків
- •4.1. Індуктивний ефект
- •Глава 40
- •4.2. Мезомерний ефект (ефект спряження)*
- •Глава 4
- •Глава 4
- •4.4. Надспряження (гіперкон'югація)
- •Глава 4
- •Класифікація ізомерії ізомерія
- •48 Глава 5
- •5.2. Просторова ізомерія (стереоізомерія)
- •Глава 5
- •5.3. Способи зображення просторової будови
- •Глава 5
- •6.1. Кислотність і основність за теорією бренстеда
- •Глава 6
- •6.2. Типи органічних кислот і основ
- •Глава 6
- •6.3. Кислоти і основи льюїса
- •7.1. Поняття про типи механізмів реакцій
- •Глава 7
- •7.2. Поняття про типи органічних реакцій
- •Глава 7
- •Вуглеводні
- •8.1. Електронна та просторова будова алканів
- •8.2. Номенклатура
- •8 .3. Ізомерія
- •8.4. Способи добування
- •8.4.1. Природні джерела
- •8.4.2. Синтетичні методи добування
- •8.5. Фізичні властивості
- •8.6. Хімічні властивості
- •8.6.1. Реакції радикального заміщення (5*)
- •76 Вуглеводні. Глава 8
- •8.6.2. Крекінг
- •8.7. Окремі представники. Застосування
- •1. Напишіть структурні формули наведених вуглеводнів і назвіть їх за раціональною номенклатурою:
- •2. Напишіть структурні формули таких вуглеводнів і назвіть їх за но менклатурою шрас:
- •Ц иклоалкани
- •9.1. Класифікація та номенклатура
- •9.2. Ізомерія
- •9.3. Способи добування. Фізичні властивості
- •9.4. Будова циклоалканів
- •9.5. Хімічні властивості
- •9.6. Окремі представники. Застосування
- •4 Органічна хімія
- •10.1. Номенклатура
- •Перші члени гомологічного ряду алкенів
- •100 Ненасичені вуглеводні. Глава іо
- •10.2. Ізомерія
- •10.3. Електронна і просторова будова алкенів
- •10.4. Способи добування
- •10.5. Фізичні властивості
- •10.6. Хімічні властивості
- •109 Ненасичені вуглеводні. Глава 10 108
- •1 0.6.1. Реакції електрофільного приєднання (ае)
- •10.6.2. Реакції відновлення та окиснення
- •10.6.3. Полімеризація алкенів
- •10.6.4. Алільне галогенування алкенів
- •118 Ненасичені вуглеводні. Глава ю
- •10.7. Окремі представники. Застосування. Ідентифікація
- •0 Контрольні питання та вправи
- •Алкадієни
- •11.2. Будова алкадієнів
- •11.1. Номенклатура
- •11.3. Алкадієни зі спряженими зв'язками 11.3.1. Способи добування
- •11.3.2. Хімічні властивості
- •11.3.3. Натуральний і синтетичний каучук
- •11.4 Окремі представники. Застосування
- •12.1. Номенклатура та ізомерія
- •12.2. Електронна та просторова будова молекул алкінів
- •12.3. Способи добування
- •138 Ненасичені вуглеводні. Глава т2
- •12.4. Фізичні властивості
- •12.5. Хімічні властивості
- •12.5.1. Реакції електрофільного приєднання (ае)
- •12.5.2. Реакції заміщення
- •12.6. Окремі представники. Застосування
- •Одноядерні арени
- •13.1. Будова бензену. Ароматичність
- •13.2. Номенклатура та ізомерія
- •13.3. Способи добування 13.3.1. Природні джерела
- •13.3.2. Синтетичні методи добування
- •13.4. Фізичні властивості
- •13.5. Хімічні властивості
- •13.5.1. Реакції електрофільного заміщення (5£)
- •0/1Ноядєрні аРени
- •13.5.2. Реакції приєднання
- •13.5.3. Реакції окиснення
- •13.5.4. Галогенування гомологів бензену з участю бокового ланцюга
- •165 0ДнояДерн[арени
- •13.6. Вплив замісників у бензеновому кільці на напрямок та швидкість реакцій
- •Електрофільного заміщення
- •13.7. Орієнтація в дизаміщеному бензені
- •1 3.8. Окремі представники. Застосування
- •13.9. Представники багатоядерних аренів
- •13.9.1. Нафтален
- •13.9.2. Антрацен
- •14.1. Природний та попутний нафтовий гази
- •Глава 14
- •14.2. Нафта. Нафтопродукти
- •14.3. Коксування вугілля
- •Глава 1і0у глава Глава 14 186 !
- •15.1. Класифікація та номенклатура
- •15.2. Ароматичність гетероциклів
- •Глава 15
- •15.3. Кислотно-осНбВні властивості гетероциклів
- •15.4. П'ятичленні гетероциклічні сполуки з одним гетероатомом
- •15.4.1. Способи добування
- •15.4.2. Фізичні властивості
- •15.4.3. Хімічні властивості
- •Глава 15
- •15.4.4. Найважливіші похідні піролу
- •Глава 15
- •15.5. Шестичленні гетероциклічні сполуки з одним гетероатомом
- •Глава 15
- •Глава 15
- •В. Реакції відновлення і окиснення
- •15.6. П'яти-1 шестичленні гетероцикли з двома гетероатомами
- •208 Глава 15
- •15.7. Представники конденсованих систем гетероциклів
- •16.1. Одноатомні спирти
- •16.1.1. Номенклатура
- •Глава 16
- •16.1.2. Ізомерія
- •16.1.3. Фізичні властивості
- •Глава 1
- •16.1.4. Способи добування
- •16.1.5. Хімічні властивості
- •16.1.6. Ідентифікація спиртів
- •16.1.7. Окремі представники
- •230 Глава 16
- •16.2.1. Способи добування дво- і триатомних спиртів
- •16.2.2. Фізичні властивості
- •16.2.3. Хімічні властивості
- •16.2.4. Окремі представники
- •16.3.2. Способи добування
- •16.3. Одноатомні феноли 16.3.1. Номенклатура та ізомерія
- •16.3.4. Хімічні властивості
- •16.3.3. Фізичні властивості
- •249 Гідроксильні похідні вуглеводнів
- •В. Реакції відновлення і окиснення
- •255 Гідроксильні похідні вуглеводнів
- •17.1. Номенклатура та ізомерія
- •17.2. Способи добування
- •17.3. Фізичні властивості
- •263 Цясимені альдегіди і кетони
- •269 Насичені альдегіди і кетони
- •271 ИаСйчені альдегіди і кетони
- •17.5. Окремі представники
- •Монокарбонові кислоти
- •18.1. Насичені монокарбонові кислоти
- •18.1.1. Номенклатура та ізомерія
- •18.1.3. Фізичні властивості
- •18.1.4. Хімічні властивості
- •А. Кислотні властивості
- •Г. Окиснення та відновлення
- •18.1.5. Окремі представники
- •18.2. Ненасичені монокарбонові кислоти
- •18.2.1. Номенклатура та ізомерія
- •18.2.2. Способи добування
- •18.2.4. Хімічні властивості
- •18.2.3. Фізичні властивості
- •18.2.5. Окремі представники
- •299 Монокарбонові кислоти
- •18.3. Ароматичні монокарбонові кислоти
- •18.3.1. Способи добування
- •18.3.2. Фізичні властивості
- •18.3.3. Хімічні властивості
- •18.3.4. Окремі представники. Ідентифікація
- •303 Монокарбонові кислоти
- •18.4.1. Номенклатура та ізомерія
- •Назви деяких дикарбонових кислот
- •18.4.2. Способи добування
- •18.4.3. Фізичні властивості
- •18.4.4. Хімічні властивості
- •18.4.5. Окремі представники
- •309 Мриокар6онові кислоти
- •18.5. Ароматичні дикарбонові кислоти
- •310 Карбонові кислоти. Глава и
- •313 Монокарбонові кислоти
- •19.1.2. Способи добування
- •19.1. Галогенангідриди карбонових кислот (ацилгалогеніди)
- •19.1.1. Номенклатура
- •19.1.3. Фізичні властивості
- •19.1.4. Хімічні властивості
- •19.1.5. Окремі представники
- •19.2. Ангідриди карбонових кислот
- •19.2.1. Номенклатура
- •19.2.2. Способи добування
- •19.2.3. Фізичні властивості
- •19.2.4. Хімічні властивості
- •19.2.5. Окремі представники
- •19.3. Естери карбонових кислот
- •19.3.1. Номенклатура
- •19.3.3. Фізичні властивості
- •19.3.4. Хімічні властивості
- •19.3.5. Окремі представники
- •19.4. Жири
- •19.4.1. Номенклатура та ізомерія
- •19.4.2. Способи добування
- •19.4.3. Фізичні властивості
- •19.4.4. Хімічні властивості
- •19.4.5. Воски. Твіни
- •19.5. Аміди карбонових кислот
- •19.5.1. Номенклатура
- •Ацетамщ,
- •19.5.2. Способи добування
- •19.5.3. Фізичні властивості
- •19.5.4. Хімічні властивості
- •19.5.5. Окремі представники
- •19.6. Нітрили (ціаніди)
- •19.6.1. Номенклатура
- •19.6.2. Способи добування
- •19.6.3. Хімічні властивості
- •19.6.4. Окремі представники
- •20.1. Галогенокарбонові кислоти
- •20.1.1. Номенклатура
- •20.1.2. Способи добування
- •20.1.3. Фізичні та хімічні властивості
- •20.2. Гідроксикислоти
- •20.2.2. Оптична ізомерія
- •20.2.3. Аліфатичні пдроксикислоти
- •359 Гетерофункціональні карбонові кислоти
- •Фізичні та хімічні властивості
- •361 Гетерофункціональні карбонові кислоти
- •20.3. Амінокислоти
- •II Амінокислотами називаються похідні карбонових кислот, у вуглеводневому радикалі яких один або кілька атомів Гідрогену замінені аміногрупою.
- •20.3.1. Номенклатура та ізомерія
- •20.3.2. Способи добування
- •20.3.3. Фізичні та хімічні властивості
- •367 Гетерофункціональні карбонові кислоти
- •20.3.4. Окремі представники
- •0 Контрольні питання та вправи
- •21.1. Номенклатура та ізомерія
- •Глава 21
- •Глава 21
- •21.2.1. Способи добування
- •21.2.2. Фізичні властивості. Просторова будова
- •21.2.3. Хімічні властивості
- •Глава 21 378 — —
- •21.3. Ариламіни
- •Глава 21
- •21.3.2. Фізичні та хімічні властивості
- •А. Реакції за участю атома Нітрогену
- •Глава 21
- •Глава 21
- •21.4. Окремі представники. Застосування
- •В. Окислення ариламінів
- •Глава 21
- •Глава 21
- •22.1. Моносахариди
- •22.1.1. Класифікація та номенклатура
- •Глава 22
- •22.1.2. Стереоізомерія
- •Глава 22
- •22.1.3. Будова моносахаридів
- •Глава 22
- •Глава 22 402
- •Глава 22
- •22.1.4. Способи добування
- •22.1.5. Фізичні властивості
- •22.1.6. Хімічні властивості
- •Глава 22
- •Глава 22
- •Б. Реакції за участю циклічних форм
- •Глава 22
- •22.1.7. Окремі представники
- •Глава 22 412
- •Глава 22
- •22.2. Дисахариди
- •22.2.1. Відновні дисахариди
- •Глава 22
- •22.2.2. Невідновні дисахариди
- •14 Органічна хімія
- •Глава 22 418
- •22.3. Полісахариди
- •Глава 22 н он н он н он н он
- •Глава 22 422
- •Глава 22 424
- •425 Вуглеводи
- •Глава 23
- •Глава 23
- •23.1.1. Стереоізомерія
- •23.1.2. Фізичні властивості
- •23.1.3. Способи добування
- •23.1.4. Хімічні властивості
- •Глава 23
- •23.2. Будова пептидів і білків
- •Глава 23
- •23.3. Синтез пептидів та їх властивості
- •440 Глава 23
- •23.4. Функції білків в організмі
- •Нуклеїнові кислоти
- •24.1. Будова нуклеїнових кислот
- •Глава 24
- •Глава 24
- •24.2. Рибонуклеїнові (рнк) і дезоксирибонуклеїнові (днк) кислоти
- •Глава 24
- •Глава 24
- •Глава 25
- •Неомилювані ліпіди
- •Глава 25
- •Глава 9. Циклоалкани 86
- •Глава 10. Алкени 98
- •Глава 11. Алкадієни 122
- •Глава 12. Алкіни 135
- •Глава 13. Одноядерні арени 147
- •Глава 14. Природні джерела вуглеводнів 179
- •Глава 15. Гетероциклічні сполуки 187
- •Глава 16. Гідроксильні похідні вуглеводнів 212
- •Глава 17. Насичені альдегіди і кетони 256
- •Глава 18. Монокарбонові кислоти 280
- •Глава 19. Функціональні похідні карбонових кислот 314
- •Глава 20. Гетерофункціональні карбонові кислоти 346
- •Глава 21. Аміни 371
- •Глава 22. Вуглеводи 394 о
- •Глава 23. Білки 426 •
- •Глава 24. Нуклеїнові кислоти 444
- •Глава 25. Ліпіди 453
- •Органічна хімія
- •61002, Харків, вул. Пушкінська, 53.
- •61022, Харків, пл. Свободи, 5, Держпром, 6-й під'їзд, 6-й поверх.
- •61012, Харків, вул. Енгельса, 11.
9.4. Будова циклоалканів
Аналогічно алканам у молекулах циклоалканів атоми Карбону знаходяться в .^-гібридному стані. Але якщо молекули алканів мають значну гнучкість завдяки вільному обертанню навколо кар-бон-карбонових зв'язків, то у циклоалканів, незважаючи на можливі конформаційні повороти, молекули являють собою досить жорсткі утворення.
Для молекул циклоалканів, як і для алканів, характерні тор-сійне (пітцерівське) напруження, пов'язане із взаємодією хімічних зв'язків у заслоненій або частково заслоненій конформаціях, і напруження Ван-дер-Ваальса, зумовлене взаємним відштовхуванням замісників при зближенні на відстань, близьку до суми їх ван-дер-ваальсівських радіусів. Крім того, для деяких циклоалканів характерне напруження, пов'язане з відхиленням валентних кутів між атомами Карбону в циклі від нормального (тетраедричного) значення. Це напруження дістало назву кутового напруження. Його називають ще байєрівським напруженням, за ім'ям німецького хі-міка-органіка А. Байєра, який запропонував 1885 року теорію напруження циклів.
За цією теорією циклоалкани розглядалися як плоскі багатокутники. Єдиним фактором, який визначає міцність циклів, вва-
хсалося напруження, викликане відхиленням (у порівнянні з тетраедричним) внутрішніх валентних кутів між атомами Карбону в циклі. Чим більше таке відхилення, тим більше напруження і менш стійкий цикл. У відповідності з цим тричленний цикл, внутрішні валентні кути якого становлять 60°, менш стійкий, ніж чотиричленний (внутрішні кути якого дорівнюють 90°), а той, у свою чергу, менш стійкий, ніж п'ятичленний (кути 108°). (Розрахуйте цей кут для п'ятичленного та шестичленного циклів). Це підтверджувалося наявним на той час експериментальним матеріалом. Але вже для шестичленного циклу експериментальні дані суперечили теорії. Шестичленні цикли (внутрішній кут 120°), які мають значне відхилення валентних кутів від тетраедричного, виявилися стійкішими за п'ятичленні, в яких внутрішні кути найближчі до
тетраедричних.
Причиною невідповідності теорії Байєра експериментальному матеріалові було помилкове уявлення автора про плоску будову циклів. Насправді єдиним циклом, який має плоску будову, є тричленний. Решта циклів не має плоскої будови.
Просторова будова циклоалканів визначається різною конфор-маційною рухливістю атомів Карбону, що залежить від кількості ланок у циклі. Молекула будь-якого циклоалкану прагне набути в просторі такої форми (конформації), в якій сума кутового, тор-сійного та ван-дер-ваальсівського напружень була б мінімальною.
З усіх циклоалканів найжорсткішу структуру мають сполуки, які містять тричленний цикл. Оскільки за правилами геометрії три точки завжди лежать в одній площині, тричленний цикл може мати тільки плоску будову. Усі атоми Гідрогену в такому циклі знаходяться в заслоненій конформації, що створює сильне торсій-не напруження (рис. 9.1).
а
б
П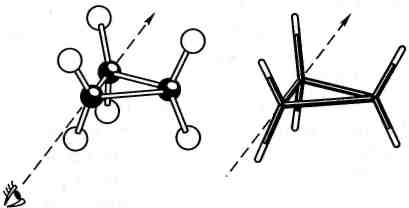 оворот
навколо карбон-карбонових зв'язків
неможливий. Внутрішні валентні кути
між атомами Карбону
в тричленному циклі
дуже відхилені від тетраедричного
значення,
що викликає велике кутове напруження.
оворот
навколо карбон-карбонових зв'язків
неможливий. Внутрішні валентні кути
між атомами Карбону
в тричленному циклі
дуже відхилені від тетраедричного
значення,
що викликає велике кутове напруження.
Розрахуємо його ве- Рис. 9.1. Моделі молекули циклопропану: ЛИЧИНу: а — кульостержньова; б — модель Драйдінга

Вуглеводні.
Глава
92
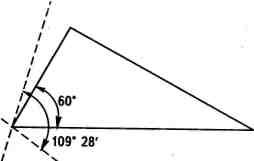
109°28'
- 60°
а
=
_
= 24°44',
Унаслідок взаємного відштовхування електронних хмар карбон-карбонових зв'язків максимальна електронна густина орбіталей атомів Карбону, що перекриваються в тричленному циклі, розміщена не вздовж прямої, що з'єднує центри зв'язуваних атомів, а за її межами (рис. 9.2).
Рис.
9.2. Схема
утворення зв'язків у молекулі
циклопропану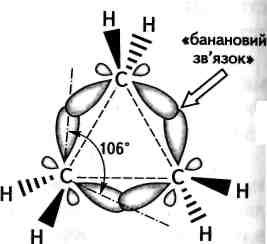
«Банановий» зв'язок. Одинарні зв'язки, що утворюються при цьому, відрізняються від звичайних а-зв'яз-ків. Вони посідають проміжне положення між а- та л-зв'язками і дістали назву т-зв'язків (грец. «тау»), або «бананових» зв'язків. Незважаючи на те, що перекривання за межами трикутника менш ефективне, утворення «бананових» зв'язків для молекули є вигідним процесом, оскільки внаслідок цього кути між зв'язками, які теоретично мають становити 60°, збільшуються до 106°, що відповідно знижує кутове напруження молекули.
Чотиричленний цикл, на відміну від тричленного, має все ж таки незначну гнучкість. Внутрішні валентні кути в ньому менш напружені, ніж у тричленному. Намагаючись зменшити торсійне напруження в чотиричленному циклі, один з атомів Карбону виступає з площини останніх трьох атомів на кут 25—30°. Тому чотиричленний цикл не є плоским (його просторову форму зображено на рис. 9.3, а).
Ще більша гнучкість характерна для п'ятичленного циклу. На відміну від тричленного і чотиричленного, у п'ятичленному циклі практично відсутнє кутове напруження (відхилення внутрішніх валентних кутів від тетраедричного становить менше 1°). Однак у плоскому п'ятичленному циклі зв'язки С—Н знаходяться в заслоненій конформації, що створює значне торсійне напруження в молекулі. Намагаючись зменшити торсійне напруження в п'ятичленному циклі, кожний з п'яти атомів Карбону по черзі виступає
циклоалкани
з площини, в якій розміщені чотири інші атоми Карбону. При цьому кільце начебто перебуває в безперервному хвильоподібно-му русі. Ця неплоска структура дістала назву «конверт» (рис. 9.3, б). Незважаючи на те, що в конформації конверта дещо зростає кутове напруження, це певною мірою компенсується за рахунок зниження торсійного напруження молекули.
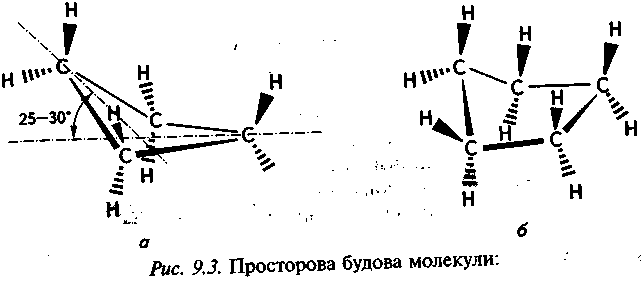
а — циклобутану; б — циклопентану
У шестичленному циклі, якщо уявити його плоским, внутрішні валентні кути мають становити 120°, що призвело б до значного кутового напруження. Крім того, у плоскій структурі виявляються взаємодії, пов'язані із заслоненням С—Н-зв'язків (торсійне напруження). Уникнути кутового напруження шестичленний цикл може за умови існування в неплоских конформаціях. Так, молекула циклогексану існує у вигляді двох крайніх конформацій — крісла та ванни (човна), які легко переходять одна в одну (рис. 9.4).
а б
Рис. 9.4. Конформації циклогексану: а — конформація крісла; б — конформація човна (ванни) У вказаних конформаціях усі валентні кути тетраедричні, тому відсутнє кутове напруження. Стійкішою є конформація крісла, оскільки в ній усі атоми Гідрогену та Карбону знаходяться в загальмованій конформації (рис. 9.5, а), що виключає торсійне напруження.
У конформації ванни при атомах Карбону, розміщених в «основі» ванни, атоми Гідрогену знаходяться в заслоненій конформа-
94
Вуглеводні. Глава 9
циклоалкани
95
д
СН
та;
Н
+ С12 циклопропан
+ Вг,
Ну
/IV
А + неї
^С1
хлороциклопропан
+ НВг
Р
 ис.
9.5. Проекції
Ньюмена конформацій циклогексану: а
— конформація
крісла; б
—
конформація ванни
ис.
9.5. Проекції
Ньюмена конформацій циклогексану: а
— конформація
крісла; б
—
конформація ванни
ції (рис. 9.5, б), що створює певне торсійне напруження. Ця конформація, будучи гнучкою структурою, може перетворюватися на стійкішу форму (з меншим заслоненням), яку називають твіст-конформацією (спотвореною ванною):
Енергія конформації крісла приблизно на 33 кДж/моль нижча
за енергію конформації ванни та К > на 21 кДж/моль — за енергію
І ^-—-^Л V /І ягв/с/я-конформації. Тому за зви-
і^^ 7~^ \Чз^^^/ чайних умов переважна частина
^^^г і^^^~-~Ц молекул циклогексану (99,9 %)
конформація ванни
твіст -конформація
існує в конформації крісла, причому кільце зазнає безперервної інверсії, тобто внаслідок обертання навколо карбон-карбонових зв'язків одна конформація крісла переходить в іншу з проміжним утворенням конформації ванни і /ш/с/я-конформації:
конформація крісла
конформація ванни
конформація крісла
твіст-конформація ванни
Дві конформації крісла можуть також взаємоперетворюватися без проходження через конформацію ванни.
