
- •Передмова
- •Вступ до органічної хімії
- •1.1. Предмет органічної хімії
- •1.2. Короткий огляд історії розвитку органічної хімії
- •Глава 1 6
- •1.3. Розвиток теоретичних уявлень про будову органічних сполук
- •Глава 1
- •1.4. Способи зображення органічних молекул
- •Глава 1
- •2.1. Класифікація органічних сполук
- •Глава 2
- •2.2. Номенклатура органічних сполук
- •Глава 2
- •Глава 2
- •ХїмГчний зв'язок
- •3.1. Типи хімічних зв'язків
- •3.2. Хімічний зв'язок в органічних сполуках
- •3.2.1. Гібридизація атомних орбіталей
- •3.2.2. Ковалентні о- і я-зв'язки
- •3.2.3. Основні характеристики ковалентних зв'язків
- •4.1. Індуктивний ефект
- •Глава 40
- •4.2. Мезомерний ефект (ефект спряження)*
- •Глава 4
- •Глава 4
- •4.4. Надспряження (гіперкон'югація)
- •Глава 4
- •Класифікація ізомерії ізомерія
- •48 Глава 5
- •5.2. Просторова ізомерія (стереоізомерія)
- •Глава 5
- •5.3. Способи зображення просторової будови
- •Глава 5
- •6.1. Кислотність і основність за теорією бренстеда
- •Глава 6
- •6.2. Типи органічних кислот і основ
- •Глава 6
- •6.3. Кислоти і основи льюїса
- •7.1. Поняття про типи механізмів реакцій
- •Глава 7
- •7.2. Поняття про типи органічних реакцій
- •Глава 7
- •Вуглеводні
- •8.1. Електронна та просторова будова алканів
- •8.2. Номенклатура
- •8 .3. Ізомерія
- •8.4. Способи добування
- •8.4.1. Природні джерела
- •8.4.2. Синтетичні методи добування
- •8.5. Фізичні властивості
- •8.6. Хімічні властивості
- •8.6.1. Реакції радикального заміщення (5*)
- •76 Вуглеводні. Глава 8
- •8.6.2. Крекінг
- •8.7. Окремі представники. Застосування
- •1. Напишіть структурні формули наведених вуглеводнів і назвіть їх за раціональною номенклатурою:
- •2. Напишіть структурні формули таких вуглеводнів і назвіть їх за но менклатурою шрас:
- •Ц иклоалкани
- •9.1. Класифікація та номенклатура
- •9.2. Ізомерія
- •9.3. Способи добування. Фізичні властивості
- •9.4. Будова циклоалканів
- •9.5. Хімічні властивості
- •9.6. Окремі представники. Застосування
- •4 Органічна хімія
- •10.1. Номенклатура
- •Перші члени гомологічного ряду алкенів
- •100 Ненасичені вуглеводні. Глава іо
- •10.2. Ізомерія
- •10.3. Електронна і просторова будова алкенів
- •10.4. Способи добування
- •10.5. Фізичні властивості
- •10.6. Хімічні властивості
- •109 Ненасичені вуглеводні. Глава 10 108
- •1 0.6.1. Реакції електрофільного приєднання (ае)
- •10.6.2. Реакції відновлення та окиснення
- •10.6.3. Полімеризація алкенів
- •10.6.4. Алільне галогенування алкенів
- •118 Ненасичені вуглеводні. Глава ю
- •10.7. Окремі представники. Застосування. Ідентифікація
- •0 Контрольні питання та вправи
- •Алкадієни
- •11.2. Будова алкадієнів
- •11.1. Номенклатура
- •11.3. Алкадієни зі спряженими зв'язками 11.3.1. Способи добування
- •11.3.2. Хімічні властивості
- •11.3.3. Натуральний і синтетичний каучук
- •11.4 Окремі представники. Застосування
- •12.1. Номенклатура та ізомерія
- •12.2. Електронна та просторова будова молекул алкінів
- •12.3. Способи добування
- •138 Ненасичені вуглеводні. Глава т2
- •12.4. Фізичні властивості
- •12.5. Хімічні властивості
- •12.5.1. Реакції електрофільного приєднання (ае)
- •12.5.2. Реакції заміщення
- •12.6. Окремі представники. Застосування
- •Одноядерні арени
- •13.1. Будова бензену. Ароматичність
- •13.2. Номенклатура та ізомерія
- •13.3. Способи добування 13.3.1. Природні джерела
- •13.3.2. Синтетичні методи добування
- •13.4. Фізичні властивості
- •13.5. Хімічні властивості
- •13.5.1. Реакції електрофільного заміщення (5£)
- •0/1Ноядєрні аРени
- •13.5.2. Реакції приєднання
- •13.5.3. Реакції окиснення
- •13.5.4. Галогенування гомологів бензену з участю бокового ланцюга
- •165 0ДнояДерн[арени
- •13.6. Вплив замісників у бензеновому кільці на напрямок та швидкість реакцій
- •Електрофільного заміщення
- •13.7. Орієнтація в дизаміщеному бензені
- •1 3.8. Окремі представники. Застосування
- •13.9. Представники багатоядерних аренів
- •13.9.1. Нафтален
- •13.9.2. Антрацен
- •14.1. Природний та попутний нафтовий гази
- •Глава 14
- •14.2. Нафта. Нафтопродукти
- •14.3. Коксування вугілля
- •Глава 1і0у глава Глава 14 186 !
- •15.1. Класифікація та номенклатура
- •15.2. Ароматичність гетероциклів
- •Глава 15
- •15.3. Кислотно-осНбВні властивості гетероциклів
- •15.4. П'ятичленні гетероциклічні сполуки з одним гетероатомом
- •15.4.1. Способи добування
- •15.4.2. Фізичні властивості
- •15.4.3. Хімічні властивості
- •Глава 15
- •15.4.4. Найважливіші похідні піролу
- •Глава 15
- •15.5. Шестичленні гетероциклічні сполуки з одним гетероатомом
- •Глава 15
- •Глава 15
- •В. Реакції відновлення і окиснення
- •15.6. П'яти-1 шестичленні гетероцикли з двома гетероатомами
- •208 Глава 15
- •15.7. Представники конденсованих систем гетероциклів
- •16.1. Одноатомні спирти
- •16.1.1. Номенклатура
- •Глава 16
- •16.1.2. Ізомерія
- •16.1.3. Фізичні властивості
- •Глава 1
- •16.1.4. Способи добування
- •16.1.5. Хімічні властивості
- •16.1.6. Ідентифікація спиртів
- •16.1.7. Окремі представники
- •230 Глава 16
- •16.2.1. Способи добування дво- і триатомних спиртів
- •16.2.2. Фізичні властивості
- •16.2.3. Хімічні властивості
- •16.2.4. Окремі представники
- •16.3.2. Способи добування
- •16.3. Одноатомні феноли 16.3.1. Номенклатура та ізомерія
- •16.3.4. Хімічні властивості
- •16.3.3. Фізичні властивості
- •249 Гідроксильні похідні вуглеводнів
- •В. Реакції відновлення і окиснення
- •255 Гідроксильні похідні вуглеводнів
- •17.1. Номенклатура та ізомерія
- •17.2. Способи добування
- •17.3. Фізичні властивості
- •263 Цясимені альдегіди і кетони
- •269 Насичені альдегіди і кетони
- •271 ИаСйчені альдегіди і кетони
- •17.5. Окремі представники
- •Монокарбонові кислоти
- •18.1. Насичені монокарбонові кислоти
- •18.1.1. Номенклатура та ізомерія
- •18.1.3. Фізичні властивості
- •18.1.4. Хімічні властивості
- •А. Кислотні властивості
- •Г. Окиснення та відновлення
- •18.1.5. Окремі представники
- •18.2. Ненасичені монокарбонові кислоти
- •18.2.1. Номенклатура та ізомерія
- •18.2.2. Способи добування
- •18.2.4. Хімічні властивості
- •18.2.3. Фізичні властивості
- •18.2.5. Окремі представники
- •299 Монокарбонові кислоти
- •18.3. Ароматичні монокарбонові кислоти
- •18.3.1. Способи добування
- •18.3.2. Фізичні властивості
- •18.3.3. Хімічні властивості
- •18.3.4. Окремі представники. Ідентифікація
- •303 Монокарбонові кислоти
- •18.4.1. Номенклатура та ізомерія
- •Назви деяких дикарбонових кислот
- •18.4.2. Способи добування
- •18.4.3. Фізичні властивості
- •18.4.4. Хімічні властивості
- •18.4.5. Окремі представники
- •309 Мриокар6онові кислоти
- •18.5. Ароматичні дикарбонові кислоти
- •310 Карбонові кислоти. Глава и
- •313 Монокарбонові кислоти
- •19.1.2. Способи добування
- •19.1. Галогенангідриди карбонових кислот (ацилгалогеніди)
- •19.1.1. Номенклатура
- •19.1.3. Фізичні властивості
- •19.1.4. Хімічні властивості
- •19.1.5. Окремі представники
- •19.2. Ангідриди карбонових кислот
- •19.2.1. Номенклатура
- •19.2.2. Способи добування
- •19.2.3. Фізичні властивості
- •19.2.4. Хімічні властивості
- •19.2.5. Окремі представники
- •19.3. Естери карбонових кислот
- •19.3.1. Номенклатура
- •19.3.3. Фізичні властивості
- •19.3.4. Хімічні властивості
- •19.3.5. Окремі представники
- •19.4. Жири
- •19.4.1. Номенклатура та ізомерія
- •19.4.2. Способи добування
- •19.4.3. Фізичні властивості
- •19.4.4. Хімічні властивості
- •19.4.5. Воски. Твіни
- •19.5. Аміди карбонових кислот
- •19.5.1. Номенклатура
- •Ацетамщ,
- •19.5.2. Способи добування
- •19.5.3. Фізичні властивості
- •19.5.4. Хімічні властивості
- •19.5.5. Окремі представники
- •19.6. Нітрили (ціаніди)
- •19.6.1. Номенклатура
- •19.6.2. Способи добування
- •19.6.3. Хімічні властивості
- •19.6.4. Окремі представники
- •20.1. Галогенокарбонові кислоти
- •20.1.1. Номенклатура
- •20.1.2. Способи добування
- •20.1.3. Фізичні та хімічні властивості
- •20.2. Гідроксикислоти
- •20.2.2. Оптична ізомерія
- •20.2.3. Аліфатичні пдроксикислоти
- •359 Гетерофункціональні карбонові кислоти
- •Фізичні та хімічні властивості
- •361 Гетерофункціональні карбонові кислоти
- •20.3. Амінокислоти
- •II Амінокислотами називаються похідні карбонових кислот, у вуглеводневому радикалі яких один або кілька атомів Гідрогену замінені аміногрупою.
- •20.3.1. Номенклатура та ізомерія
- •20.3.2. Способи добування
- •20.3.3. Фізичні та хімічні властивості
- •367 Гетерофункціональні карбонові кислоти
- •20.3.4. Окремі представники
- •0 Контрольні питання та вправи
- •21.1. Номенклатура та ізомерія
- •Глава 21
- •Глава 21
- •21.2.1. Способи добування
- •21.2.2. Фізичні властивості. Просторова будова
- •21.2.3. Хімічні властивості
- •Глава 21 378 — —
- •21.3. Ариламіни
- •Глава 21
- •21.3.2. Фізичні та хімічні властивості
- •А. Реакції за участю атома Нітрогену
- •Глава 21
- •Глава 21
- •21.4. Окремі представники. Застосування
- •В. Окислення ариламінів
- •Глава 21
- •Глава 21
- •22.1. Моносахариди
- •22.1.1. Класифікація та номенклатура
- •Глава 22
- •22.1.2. Стереоізомерія
- •Глава 22
- •22.1.3. Будова моносахаридів
- •Глава 22
- •Глава 22 402
- •Глава 22
- •22.1.4. Способи добування
- •22.1.5. Фізичні властивості
- •22.1.6. Хімічні властивості
- •Глава 22
- •Глава 22
- •Б. Реакції за участю циклічних форм
- •Глава 22
- •22.1.7. Окремі представники
- •Глава 22 412
- •Глава 22
- •22.2. Дисахариди
- •22.2.1. Відновні дисахариди
- •Глава 22
- •22.2.2. Невідновні дисахариди
- •14 Органічна хімія
- •Глава 22 418
- •22.3. Полісахариди
- •Глава 22 н он н он н он н он
- •Глава 22 422
- •Глава 22 424
- •425 Вуглеводи
- •Глава 23
- •Глава 23
- •23.1.1. Стереоізомерія
- •23.1.2. Фізичні властивості
- •23.1.3. Способи добування
- •23.1.4. Хімічні властивості
- •Глава 23
- •23.2. Будова пептидів і білків
- •Глава 23
- •23.3. Синтез пептидів та їх властивості
- •440 Глава 23
- •23.4. Функції білків в організмі
- •Нуклеїнові кислоти
- •24.1. Будова нуклеїнових кислот
- •Глава 24
- •Глава 24
- •24.2. Рибонуклеїнові (рнк) і дезоксирибонуклеїнові (днк) кислоти
- •Глава 24
- •Глава 24
- •Глава 25
- •Неомилювані ліпіди
- •Глава 25
- •Глава 9. Циклоалкани 86
- •Глава 10. Алкени 98
- •Глава 11. Алкадієни 122
- •Глава 12. Алкіни 135
- •Глава 13. Одноядерні арени 147
- •Глава 14. Природні джерела вуглеводнів 179
- •Глава 15. Гетероциклічні сполуки 187
- •Глава 16. Гідроксильні похідні вуглеводнів 212
- •Глава 17. Насичені альдегіди і кетони 256
- •Глава 18. Монокарбонові кислоти 280
- •Глава 19. Функціональні похідні карбонових кислот 314
- •Глава 20. Гетерофункціональні карбонові кислоти 346
- •Глава 21. Аміни 371
- •Глава 22. Вуглеводи 394 о
- •Глава 23. Білки 426 •
- •Глава 24. Нуклеїнові кислоти 444
- •Глава 25. Ліпіди 453
- •Органічна хімія
- •61002, Харків, вул. Пушкінська, 53.
- •61022, Харків, пл. Свободи, 5, Держпром, 6-й під'їзд, 6-й поверх.
- •61012, Харків, вул. Енгельса, 11.
361 Гетерофункціональні карбонові кислоти
й£-сн2
к
/°С
+ Н,0
у (5 а ^О
к—сн—сн,—сн,—сС
ї
Т • ■ ^оні
о—н
у-лактон
Окремі представники Молочна кислота (а-гідроксипроггіонова кислота). Уперше її було виділено з кислого молока. Молочна кислота утворюється внаслідок молочнокислого бродіння вуглеводів:
СбН1206
ферменти» 2 Н3С—СН—СООН
ін
Міститься в кислому молоці, кефірі, мочених яблуках, квашеній капусті, різних соліннях тощо.
Молочна кислота має у своїй структурі один асиметричний атом Карбону і тому існує у вигляді двох оптично активних енан-тіомерів та оптично неактивної, рацемічної форми:
СООН
-н
соон
н-
-он
сн3
£-(+)-молочна кислота
но-
сн3
7)-(-)-молочна кислота
£-(+)-Молочна кислота утворюється в живих організмах у процесі розщеплення вуглеводів. При інтенсивній фізичній роботі вона накопичується в м'язах, спричиняючи характерний біль. Солі та естери молочної кислоти називають лактатами. Кальцій та фе-рум (II) лактати застосовують у медицині як лікарські препарати: кальцій лактат [СН3СН(ОН)СОО]2Са • 5Н20 — при захворюваннях, пов'язаних з нестачею кальцію в організмі; ферум (II) лактат [СН3СН(ОН)СОО]2Ре — при хронічних анеміях.
Яблучна кислота (гідроксіянтарна кислота) НООСС*Н(ОН)СН2СООН. Безбарвна кристалічна речовина, кисла на смак, добре розчинна у воді. Яблучна кислота містить один асиметричний атом Карбону, тому вона існує у вигляді двох оптично активних енантіомерів і оптично неактивної рацемічної форми:
Карбонові
кислоти. Глава
СООН
СООН
362
-он
-н
Н-
но-
СН2СООН
£-(+)-яблучна кислота
СН2СООН
і-(-)-яблучна кислота
У природі зустрічається £-(-)-яблучна кислота. Вона містить ся в недостиглих яблуках, ягодах горобини, клюкви, малини, бар барису тощо.
У промисловості широко застосовується і-(-)-яблучна кислота—у виробництві вина, фруктових вод та кондитерських виробів, а також у синтезі лікарських засобів.
Винна кислота (а,а-дигідроксибурштинова кислота). Молекул винної кислоти містить два асиметричні атоми Карбону з однаковим набором замісників. Тому для неї відомі три стереоізомери — два оптично активні (2)-(+)-винна та £-(-)-винна кислоти) і один оптично неактивний (мезо-винна кислота):
'
НО—С—СООН
но—сь-соон
СООН
СООН
-он но-—н н—
-он -он
н-
соон
-он н-
-н н-
но-
СООН
СООН
соон
/Ч+)-винна кислота Ь-(-)-винна кислота мезо-винна кислота
Рацемічна суміш Б- та £-винних кислот називається виноградною кислотою.
У природі зустрічається тільки і)-(+)-винна кислота; особливо багато у винограді, який є вихідною сировиною для її добування. Винна кислота утворює кислі та середні солі. Кислі солі називаються гідротартратами, середні — тартратами. Калієво-натрієва сіль винної кислоти називається сегнетовою сіллю:
-СН—СН-ОН ОН
К+ООС—СН—СН—СОО^а+ • 4Н20
Гетерофункціональні карбонові кислоти
.— 363
При взаємодії з купрум (II) гідроксидом у лужному середовищі сегнетова сіль утворює комплекс яскраво-синього кольору, який дістав назву реактив Фелінга, що застосовується для якісного визначення альдегідної групи.
Лимонна кислота (2-гідрокси-1,2,3-пропантрикарбонова кислота). Безбарвна кристалічна речовина (т. пл 153 °С). У великих кількостях міститься в цитрусових (лимонах, апельсинах), а також у смородині, малині тощо.
>Н
?
• 5,5Н20
Солі лимонної кислоти називаються цитратами. Тринатрієва сіль лимонної кислоти (натрій цитрат) застосовують у медицині для консервації донорської крові:
Ш+0-ОС-СН2-С-СН2-СОО-Ка+ СОО"Ка+
Саліцилова кислота (о-гідроксибензойна кислота). Біла криста лічна речовина (т. пл. 159 °С), легко сублімується, при сильному
-* "«^п^лптпгстгга ПОЗ-
СООН
ш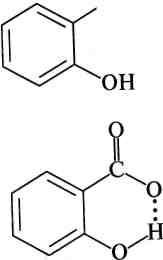 видкому
нагріванні декарбоксилується, розчинна
в гарячій воді. Саліцилова кислота
виявляє
більшу кислотність (рКа
= 2,98),
ніж бензойна
кислота (рКа
= 4,17),
а також мета-
або
иара-гідроксибензойні
кислоти. Підвищена кислотність
саліцилової кислоти зумовлена додатковою
стабілізацією аніона за рахунок
утворення
внутрішньомолекулярного водневого
зв'язку.
видкому
нагріванні декарбоксилується, розчинна
в гарячій воді. Саліцилова кислота
виявляє
більшу кислотність (рКа
= 2,98),
ніж бензойна
кислота (рКа
= 4,17),
а також мета-
або
иара-гідроксибензойні
кислоти. Підвищена кислотність
саліцилової кислоти зумовлена додатковою
стабілізацією аніона за рахунок
утворення
внутрішньомолекулярного водневого
зв'язку.
Саліцилова кислота застосовується в медицині у вигляді спиртових розчинів і мазей як антисептичний лікарський засіб.
Вона також є сировиною для синтезу інших лікарських засобів, таких, як натрій саліцилат, метилсаліцилат, фенілсаліцилат (салол), саліциламід, ацетилсаліцилова кислота (аспірин).
.СООН
(СН3С0)20
-сн3соон
"ОН
саліцилова
кислота
СХо-о-сн,
ацетилсаліцилова кислота
Аспірин застосовують у медицині як жарознижувальний засіб.
364
Карбонові кислоти. Глава 20
ґетерофункціональні карбонові кислоти
365
.
