
- •Передмова
- •Вступ до органічної хімії
- •1.1. Предмет органічної хімії
- •1.2. Короткий огляд історії розвитку органічної хімії
- •Глава 1 6
- •1.3. Розвиток теоретичних уявлень про будову органічних сполук
- •Глава 1
- •1.4. Способи зображення органічних молекул
- •Глава 1
- •2.1. Класифікація органічних сполук
- •Глава 2
- •2.2. Номенклатура органічних сполук
- •Глава 2
- •Глава 2
- •ХїмГчний зв'язок
- •3.1. Типи хімічних зв'язків
- •3.2. Хімічний зв'язок в органічних сполуках
- •3.2.1. Гібридизація атомних орбіталей
- •3.2.2. Ковалентні о- і я-зв'язки
- •3.2.3. Основні характеристики ковалентних зв'язків
- •4.1. Індуктивний ефект
- •Глава 40
- •4.2. Мезомерний ефект (ефект спряження)*
- •Глава 4
- •Глава 4
- •4.4. Надспряження (гіперкон'югація)
- •Глава 4
- •Класифікація ізомерії ізомерія
- •48 Глава 5
- •5.2. Просторова ізомерія (стереоізомерія)
- •Глава 5
- •5.3. Способи зображення просторової будови
- •Глава 5
- •6.1. Кислотність і основність за теорією бренстеда
- •Глава 6
- •6.2. Типи органічних кислот і основ
- •Глава 6
- •6.3. Кислоти і основи льюїса
- •7.1. Поняття про типи механізмів реакцій
- •Глава 7
- •7.2. Поняття про типи органічних реакцій
- •Глава 7
- •Вуглеводні
- •8.1. Електронна та просторова будова алканів
- •8.2. Номенклатура
- •8 .3. Ізомерія
- •8.4. Способи добування
- •8.4.1. Природні джерела
- •8.4.2. Синтетичні методи добування
- •8.5. Фізичні властивості
- •8.6. Хімічні властивості
- •8.6.1. Реакції радикального заміщення (5*)
- •76 Вуглеводні. Глава 8
- •8.6.2. Крекінг
- •8.7. Окремі представники. Застосування
- •1. Напишіть структурні формули наведених вуглеводнів і назвіть їх за раціональною номенклатурою:
- •2. Напишіть структурні формули таких вуглеводнів і назвіть їх за но менклатурою шрас:
- •Ц иклоалкани
- •9.1. Класифікація та номенклатура
- •9.2. Ізомерія
- •9.3. Способи добування. Фізичні властивості
- •9.4. Будова циклоалканів
- •9.5. Хімічні властивості
- •9.6. Окремі представники. Застосування
- •4 Органічна хімія
- •10.1. Номенклатура
- •Перші члени гомологічного ряду алкенів
- •100 Ненасичені вуглеводні. Глава іо
- •10.2. Ізомерія
- •10.3. Електронна і просторова будова алкенів
- •10.4. Способи добування
- •10.5. Фізичні властивості
- •10.6. Хімічні властивості
- •109 Ненасичені вуглеводні. Глава 10 108
- •1 0.6.1. Реакції електрофільного приєднання (ае)
- •10.6.2. Реакції відновлення та окиснення
- •10.6.3. Полімеризація алкенів
- •10.6.4. Алільне галогенування алкенів
- •118 Ненасичені вуглеводні. Глава ю
- •10.7. Окремі представники. Застосування. Ідентифікація
- •0 Контрольні питання та вправи
- •Алкадієни
- •11.2. Будова алкадієнів
- •11.1. Номенклатура
- •11.3. Алкадієни зі спряженими зв'язками 11.3.1. Способи добування
- •11.3.2. Хімічні властивості
- •11.3.3. Натуральний і синтетичний каучук
- •11.4 Окремі представники. Застосування
- •12.1. Номенклатура та ізомерія
- •12.2. Електронна та просторова будова молекул алкінів
- •12.3. Способи добування
- •138 Ненасичені вуглеводні. Глава т2
- •12.4. Фізичні властивості
- •12.5. Хімічні властивості
- •12.5.1. Реакції електрофільного приєднання (ае)
- •12.5.2. Реакції заміщення
- •12.6. Окремі представники. Застосування
- •Одноядерні арени
- •13.1. Будова бензену. Ароматичність
- •13.2. Номенклатура та ізомерія
- •13.3. Способи добування 13.3.1. Природні джерела
- •13.3.2. Синтетичні методи добування
- •13.4. Фізичні властивості
- •13.5. Хімічні властивості
- •13.5.1. Реакції електрофільного заміщення (5£)
- •0/1Ноядєрні аРени
- •13.5.2. Реакції приєднання
- •13.5.3. Реакції окиснення
- •13.5.4. Галогенування гомологів бензену з участю бокового ланцюга
- •165 0ДнояДерн[арени
- •13.6. Вплив замісників у бензеновому кільці на напрямок та швидкість реакцій
- •Електрофільного заміщення
- •13.7. Орієнтація в дизаміщеному бензені
- •1 3.8. Окремі представники. Застосування
- •13.9. Представники багатоядерних аренів
- •13.9.1. Нафтален
- •13.9.2. Антрацен
- •14.1. Природний та попутний нафтовий гази
- •Глава 14
- •14.2. Нафта. Нафтопродукти
- •14.3. Коксування вугілля
- •Глава 1і0у глава Глава 14 186 !
- •15.1. Класифікація та номенклатура
- •15.2. Ароматичність гетероциклів
- •Глава 15
- •15.3. Кислотно-осНбВні властивості гетероциклів
- •15.4. П'ятичленні гетероциклічні сполуки з одним гетероатомом
- •15.4.1. Способи добування
- •15.4.2. Фізичні властивості
- •15.4.3. Хімічні властивості
- •Глава 15
- •15.4.4. Найважливіші похідні піролу
- •Глава 15
- •15.5. Шестичленні гетероциклічні сполуки з одним гетероатомом
- •Глава 15
- •Глава 15
- •В. Реакції відновлення і окиснення
- •15.6. П'яти-1 шестичленні гетероцикли з двома гетероатомами
- •208 Глава 15
- •15.7. Представники конденсованих систем гетероциклів
- •16.1. Одноатомні спирти
- •16.1.1. Номенклатура
- •Глава 16
- •16.1.2. Ізомерія
- •16.1.3. Фізичні властивості
- •Глава 1
- •16.1.4. Способи добування
- •16.1.5. Хімічні властивості
- •16.1.6. Ідентифікація спиртів
- •16.1.7. Окремі представники
- •230 Глава 16
- •16.2.1. Способи добування дво- і триатомних спиртів
- •16.2.2. Фізичні властивості
- •16.2.3. Хімічні властивості
- •16.2.4. Окремі представники
- •16.3.2. Способи добування
- •16.3. Одноатомні феноли 16.3.1. Номенклатура та ізомерія
- •16.3.4. Хімічні властивості
- •16.3.3. Фізичні властивості
- •249 Гідроксильні похідні вуглеводнів
- •В. Реакції відновлення і окиснення
- •255 Гідроксильні похідні вуглеводнів
- •17.1. Номенклатура та ізомерія
- •17.2. Способи добування
- •17.3. Фізичні властивості
- •263 Цясимені альдегіди і кетони
- •269 Насичені альдегіди і кетони
- •271 ИаСйчені альдегіди і кетони
- •17.5. Окремі представники
- •Монокарбонові кислоти
- •18.1. Насичені монокарбонові кислоти
- •18.1.1. Номенклатура та ізомерія
- •18.1.3. Фізичні властивості
- •18.1.4. Хімічні властивості
- •А. Кислотні властивості
- •Г. Окиснення та відновлення
- •18.1.5. Окремі представники
- •18.2. Ненасичені монокарбонові кислоти
- •18.2.1. Номенклатура та ізомерія
- •18.2.2. Способи добування
- •18.2.4. Хімічні властивості
- •18.2.3. Фізичні властивості
- •18.2.5. Окремі представники
- •299 Монокарбонові кислоти
- •18.3. Ароматичні монокарбонові кислоти
- •18.3.1. Способи добування
- •18.3.2. Фізичні властивості
- •18.3.3. Хімічні властивості
- •18.3.4. Окремі представники. Ідентифікація
- •303 Монокарбонові кислоти
- •18.4.1. Номенклатура та ізомерія
- •Назви деяких дикарбонових кислот
- •18.4.2. Способи добування
- •18.4.3. Фізичні властивості
- •18.4.4. Хімічні властивості
- •18.4.5. Окремі представники
- •309 Мриокар6онові кислоти
- •18.5. Ароматичні дикарбонові кислоти
- •310 Карбонові кислоти. Глава и
- •313 Монокарбонові кислоти
- •19.1.2. Способи добування
- •19.1. Галогенангідриди карбонових кислот (ацилгалогеніди)
- •19.1.1. Номенклатура
- •19.1.3. Фізичні властивості
- •19.1.4. Хімічні властивості
- •19.1.5. Окремі представники
- •19.2. Ангідриди карбонових кислот
- •19.2.1. Номенклатура
- •19.2.2. Способи добування
- •19.2.3. Фізичні властивості
- •19.2.4. Хімічні властивості
- •19.2.5. Окремі представники
- •19.3. Естери карбонових кислот
- •19.3.1. Номенклатура
- •19.3.3. Фізичні властивості
- •19.3.4. Хімічні властивості
- •19.3.5. Окремі представники
- •19.4. Жири
- •19.4.1. Номенклатура та ізомерія
- •19.4.2. Способи добування
- •19.4.3. Фізичні властивості
- •19.4.4. Хімічні властивості
- •19.4.5. Воски. Твіни
- •19.5. Аміди карбонових кислот
- •19.5.1. Номенклатура
- •Ацетамщ,
- •19.5.2. Способи добування
- •19.5.3. Фізичні властивості
- •19.5.4. Хімічні властивості
- •19.5.5. Окремі представники
- •19.6. Нітрили (ціаніди)
- •19.6.1. Номенклатура
- •19.6.2. Способи добування
- •19.6.3. Хімічні властивості
- •19.6.4. Окремі представники
- •20.1. Галогенокарбонові кислоти
- •20.1.1. Номенклатура
- •20.1.2. Способи добування
- •20.1.3. Фізичні та хімічні властивості
- •20.2. Гідроксикислоти
- •20.2.2. Оптична ізомерія
- •20.2.3. Аліфатичні пдроксикислоти
- •359 Гетерофункціональні карбонові кислоти
- •Фізичні та хімічні властивості
- •361 Гетерофункціональні карбонові кислоти
- •20.3. Амінокислоти
- •II Амінокислотами називаються похідні карбонових кислот, у вуглеводневому радикалі яких один або кілька атомів Гідрогену замінені аміногрупою.
- •20.3.1. Номенклатура та ізомерія
- •20.3.2. Способи добування
- •20.3.3. Фізичні та хімічні властивості
- •367 Гетерофункціональні карбонові кислоти
- •20.3.4. Окремі представники
- •0 Контрольні питання та вправи
- •21.1. Номенклатура та ізомерія
- •Глава 21
- •Глава 21
- •21.2.1. Способи добування
- •21.2.2. Фізичні властивості. Просторова будова
- •21.2.3. Хімічні властивості
- •Глава 21 378 — —
- •21.3. Ариламіни
- •Глава 21
- •21.3.2. Фізичні та хімічні властивості
- •А. Реакції за участю атома Нітрогену
- •Глава 21
- •Глава 21
- •21.4. Окремі представники. Застосування
- •В. Окислення ариламінів
- •Глава 21
- •Глава 21
- •22.1. Моносахариди
- •22.1.1. Класифікація та номенклатура
- •Глава 22
- •22.1.2. Стереоізомерія
- •Глава 22
- •22.1.3. Будова моносахаридів
- •Глава 22
- •Глава 22 402
- •Глава 22
- •22.1.4. Способи добування
- •22.1.5. Фізичні властивості
- •22.1.6. Хімічні властивості
- •Глава 22
- •Глава 22
- •Б. Реакції за участю циклічних форм
- •Глава 22
- •22.1.7. Окремі представники
- •Глава 22 412
- •Глава 22
- •22.2. Дисахариди
- •22.2.1. Відновні дисахариди
- •Глава 22
- •22.2.2. Невідновні дисахариди
- •14 Органічна хімія
- •Глава 22 418
- •22.3. Полісахариди
- •Глава 22 н он н он н он н он
- •Глава 22 422
- •Глава 22 424
- •425 Вуглеводи
- •Глава 23
- •Глава 23
- •23.1.1. Стереоізомерія
- •23.1.2. Фізичні властивості
- •23.1.3. Способи добування
- •23.1.4. Хімічні властивості
- •Глава 23
- •23.2. Будова пептидів і білків
- •Глава 23
- •23.3. Синтез пептидів та їх властивості
- •440 Глава 23
- •23.4. Функції білків в організмі
- •Нуклеїнові кислоти
- •24.1. Будова нуклеїнових кислот
- •Глава 24
- •Глава 24
- •24.2. Рибонуклеїнові (рнк) і дезоксирибонуклеїнові (днк) кислоти
- •Глава 24
- •Глава 24
- •Глава 25
- •Неомилювані ліпіди
- •Глава 25
- •Глава 9. Циклоалкани 86
- •Глава 10. Алкени 98
- •Глава 11. Алкадієни 122
- •Глава 12. Алкіни 135
- •Глава 13. Одноядерні арени 147
- •Глава 14. Природні джерела вуглеводнів 179
- •Глава 15. Гетероциклічні сполуки 187
- •Глава 16. Гідроксильні похідні вуглеводнів 212
- •Глава 17. Насичені альдегіди і кетони 256
- •Глава 18. Монокарбонові кислоти 280
- •Глава 19. Функціональні похідні карбонових кислот 314
- •Глава 20. Гетерофункціональні карбонові кислоти 346
- •Глава 21. Аміни 371
- •Глава 22. Вуглеводи 394 о
- •Глава 23. Білки 426 •
- •Глава 24. Нуклеїнові кислоти 444
- •Глава 25. Ліпіди 453
- •Органічна хімія
- •61002, Харків, вул. Пушкінська, 53.
- •61022, Харків, пл. Свободи, 5, Держпром, 6-й під'їзд, 6-й поверх.
- •61012, Харків, вул. Енгельса, 11.
20.2. Гідроксикислоти
Гідроксикислотами називаються похідні карбонових кислот, які містять у вуглеводневому радикалі одну або кілька гідроксильних груп.
Залежно від природи вуглеводневого радикала розрізняють аліфатичні гідроксикислоти (спиртокислоти) і ароматичні (феноло-кислоти). Аліфатичні гідроксикислоти за взаємним розміщенням карбоксильної та гідроксильної груп поділяють на а-, В-, у- та ін.
Гетерофункціональні карбонові кислоти
Кількість карбоксильних груп у молекулі гідроксикислоти ви значає основність, а кількість гідроксильних груп, включаючи й гідроксили, що входять до складу карбоксильних груп, характе ризують атомність. Так, гліколева кислота НО—СН2—СООН є одноосновною двохатомною кислотою, а яблучна кислота НООС—СН2—СН—СООН — двохосновною трьохатомною кис- лоток, ^
2С-СООН НзС-СН-СООН Н2С-<
ін ін он
20.2.1. НОМЕНКЛАТУРА ТА ІЗОМЕРІЯ У номенклатурі гідроксикислот широко застосовують тривіальні назви. За замісниковою номенклатурою ШРАС як родоначальну беруть тривіальну або систематичну назву карбонової кислоти. Гідроксильна група позначається префіксом гідрокси- (гідроксі-). При використанні тривіальної назви родоначальної структури положення гідроксильної групи у вуглеводневому ланцюзі позначають літерами грецького алфавіту а, В, у та іншими, а при вживанні систематичної назви родоначальної структури положення ОН-групи вказують цифровими локантами: Н2С—СООН Н3С—СН—СООН Н2С—СН2—СН2—СООН
■ „ „„, молочна,
гліколева,
у-гідроксимасляна,
пдроксюцтова, а-пдроксипропюнова, 4-гідроксибутанова кислота
гідроксіетанова кислота 2-гідроксипропанова кислота
он "' "" "' І
НООС—СН—СН2—СООН НООС—СН—СН—СООН
н он
яблучна, винна,
гідроксибурштинова (гідроксіянтарна), а,а'-дигідроксибурштинова
^ЛООН
гідроксибутандіова кислота 2,3-дигідроксибутандіова кислота
ОН НООС—СН2—С—СН2—СООН
соон
лимонна, саліцилова,
2-гідрокси-1,2,3-пропантрикарбонова кислота 2-гідроксибензойна кислота
Для гідроксикислот характерна структурна ізомерія, що зумовлена різною структурою вуглеводневого радикала, з яким зв'язана карбоксильна група, та різним положенням ОН-групи у вуглеводневому ланцюзі. Наприклад, структурними ізомерами є:
352
Карбонові кислоти. Глава 20
ґетерофункціональні карбонові кислоти
353
Н3С—С—СООН
СН3
и
її
ш
2-гідроксибутанова кислота 2-гідрокси-2-метилпропанова кислота
Н3С—СН—СН2—СООН
он
3-гідроксибутанова кислота
Крім того, в ряду гідроксикислот часто зустрічається оптична ізомерія*.
20.2.2. Оптична ізомерія
Оптична активність і хіральність молекул. Для характеристики оптичної ізомерії важливе значення мають такі поняття, як оптична активність і хіральність молекул.
Оптичною активністю називають властивість речовини обертати площину поляризації поляризованого світла. Якщо промінь звичайного світла, в якому, як відомо, електромагнітні коливання відбуваються в різних площинах, перпендикулярних до напрямку його розповсюдження, пропустити крізь призму Ніколя**, то світло, що вийде, буде площшнополяризоване. У такому промені електромагнітні коливання відбуваються лише в одній площині. Цю площину називають площиною поляризації (рис. 20.1).
При проходженні поляризованого світла крізь оптично активну речовину площина поляризації обертається на певний кут а
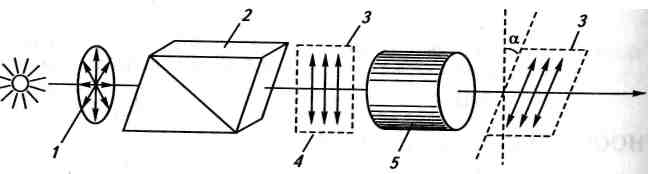
Рис. 20.1. Схема утворення поляризованого світла і обертання площини
поляризації оптично активною речовиною:
/ — звичайне світло; 2 — призма Ніколя; 3 — площина поляризації;
4 — поляризоване світло; 5 — оптично активна речовина
* Вивчається за бажанням учителя.
** Призма Ніколя складається з двох кристалів ісландського шпату (СаС03)-
вправо або вліво (рис. 20.1). Якщо речовина відхиляє площину поляризації вправо (при спостереженні назустріч променю), її називають правообертальною, якщо вліво,— лівообертальною. Праве обертання позначають знаком (+), ліве — знаком (-).
Кут обертання а залежить від природи оптично активної речовини, товщини шару оптично активного середовища, крізь яке проходить поляризоване світло, і його довжини хвилі. Для розчинів кут а залежить також від природи розчинника і концентрації оптично активної речовини. Меншою мірою оптичне обертання залежить від температури.
Оптичну активність вимірюють за допомогою приладів, які названо поляриметрами.
Обов'язковою умовою для виявлення органічною сполукою оптичної активності є асиметрія (відсутність симетрії) його молекул.
Оскільки молекула являє собою тримірне утворення, її будову можна розглядати з точки зору симетрії геометричних фігур. Елементами симетрії є площина, центр і вісь симетрії.
Площина симетрії — це уявна площина, яка проходить крізь молекулу, розділяючи її на дві дзеркально рівні частини.
Центром симетрії називають уявну точку всередині молекули, рівновіддалену від однакових атомів, розташованих на прямій, що проходить крізь цю точку.
Віссю симетрії називається уявна вісь, що проходить крізь молекулу, при обертанні навколо якої на кут 360°/л (п — ціле число, рівне 2, 3, 4 й т. д.) молекула суміщається із своїм вихідним станом. Різноманітні об'єкти, зокрема й молекули, що не мають елементів симетрії, мають властивість не суміщатися зі своїм дзеркальним відображенням. Цю властивість називають хіральністю (від. грец. Хєір — рука), а молекули, що її мають,— хіральними. Наочним прикладом хіральності можуть бути ліва і права руки, які є віддзеркаленням одна одної, але їх неможливо сумістити при будь-якому способі накладання. З цієї причини рукавичка з лівої Руки не придатна для правої.
Молекули, що мають один елемент симетрії, завжди ідентичні зі своїм дзеркальним відображенням і називаються ахіральними. Хіральність молекули можна легко встановити шляхом побудови моделі молекули і моделі її дзеркального відображення з подаль-Црм їх суміщенням. Якщо моделі не суміщаються, — молекула Гральна, якщо суміщаються, — ахіральна.
Хіральність молекул зумовлена асиметрією їхньої будови і є обов'язковою умовою для виявлення речовиною оптичної актив-
исті.
'іОрганіщахіиі,
К арбонові
кислоти. Глава
20
арбонові
кислоти. Глава
20
354 —-
Сполуки з одним асиметричним атомом Карбону. Однією з причин виникнення хіральності органічних молекул є наявність в їх структурі ^-гібридизованого атома Карбону, зв'язаного з чотирма різними замісниками. Такий атом Карбону називається хіральним, або асиметричним. Часто для нього застосовують більш загальну назву — хіральний центр. У структурних формулах асиметричний атом Карбону прийнято позначати зірочкою — С*:
І
І*
Н3С—С—СООН
он І
Молекули, які містять один асиметричний атом Карбону, іс- • нують у вигляді двох ізомерів, що відносяться один до одного як хіральний предмет до свого дзеркального відображення. Такі ізомери називають енантіомерами (рис. 20.2).

Рис. 20.2. Моделі енантіомерних молекул молочної кислоти
Дзеркальне відображення хіральної молекули утворюється, якщо поміняти місцями будь-які два замісники при асиметричному атомі Карбону. Будучи дуже подібними, енантіомери не тотожні. Вони мають однаковий склад і послідовність зв'язування атомів у молекулі, але відрізняються відносним розташуванням їх у просторі, тобто конфігурацією. У тому, що ці молекули різні, можна легко переконатися, накладаючи їх моделі одна на одну.
Енантіомери однакові за фізичними та хімічними властивостями. Істотна різниця полягає в тому, що вони по-різному відносяться до поляризованого світла, а саме: обертають площину поляризації на той самий кут, але в протилежному напрямку (якщо один обертає вліво, то другий на такий самий кут — вправо). Тому їх ще називають оптичними ізомерами, або оптичними антиподами. До того ж енантіомери з різною швидкістю реагують з іншими хіральними сполуками, тому мають різну фізіологічну активність.
Гетерофункціональні карбонові кислоти
Суміш рівних кількостей енантіомерів називають рацемічною. Така суміш не має оптичної активності, тому що однакове за значенням, але протилежне за напрямком обертання взаємно компенсується. Для позначення рацемічної суміші перед назвою сполуки ставиться символ (±).
Зображення оптичних ізомерів на площині. Звичайно оптичні ізомери зображують на площині за допомогою проекційних формул фішера. Для їх одержання необхідно пам'ятати правила розташування тетраедричної моделі молекули в просторі. Спочатку модель молекули будують таким чином, щоб головний карбоновий ланцюг був зорієнтований вертикально, причому зверху має знаходитись той його кінець, з якого за номенклатурою ШРАС починають нумерацію атомів. Потім модель орієнтують у просторі інакше: щоб асиметричний атом Карбону перебував у площині креслення; замісники, розташовані горизонтально, мають бути над площиною, а розташовані вертикально — за площиною креслення. При проектуванні такої моделі на площину одержують проекційну формулу Фішера, в якій зв'язки, що перебувають за площиною, зображуються вертикальними лініями, а розташовані над площиною — горизонтальними. Асиметричний атом Карбону при цьому знаходиться в точці перетину вертикальної та горизонтальної ліній і звичайно не позначається символом:
соон і соон
-н
Н-
-ОН і НО-
сн3 - ;■'■ .Ж .' сн3 :';-'.-"•>
Зображення молочної кислоти '.>ї-»,,';/(і,д-чі.>;^.,-)г~.... за допомогою проекції Фішера
Номенклатура оптичних ізомерів. Оскільки оптичні ізомери відрізняються лише конфігурацією молекул і відношенням до поляризованого світла, у номенклатурі поряд з назвою, яка відображає хімічну будову, вказують також конфігурацію і напрямок обертання площини поляризованого світла.
Відхилення площини площиннополяризованого променя вправо позначають у назві оптичного ізомеру знаком (+), а вліво — знаком (-). Щоб сказати, який енантіомер з пари має праве, а який — ліве обертання, необхідно знати дійсне розташування навколо хі-Рального центру, тобто абсолютну конфігурацію молекул. Важли-
12*

Гетерофункціональні
карбонові кислоти
— 357
сн,
соон
—н
СООН
—он
н-
шіч-
-СІ
356
во зазначити, що напрямок і кут обертання площини поляризації зовсім не пов'язані з конфігурацією. Визначення абсолютної конфігурації молекул виявилося для хіміків досить складним завданням. Лише в 1951 році методом рентгеноструктурного аналізу було вперше встановлено абсолютну конфігурацію натрій-рубідіє-вої солі (+)-винної кислоти. До того часу конфігурацію оптичних ізомерів визначали методом порівняння зі спеціальною стандартною речовиною. Така конфігурація одержала назву відносної. У 1906 році російський вчений М. О. Розанов запропонував стандарт для встановлення відносної конфігурації — гліцериновий альдегід СН2(ОН)—С*Н(ОН)—СН=0. Правообертальному ізомерові глщеринового альдегіду було довільно приписано абсолютну конфігурацію, у фішерівській проекції якої група —ОН знаходиться праворуч. Таку конфігурацію позначили літерою Д Ліво-обертаючому енантіомеру гліцеринового альдегіду відповідно було приписано дзеркальну конфігурацію, яку позначили літерою Ь (група —ОН у проекції Фішера знаходиться ліворуч):
Н.
О
^
V-4
н-
-он
-н
но-
сн3
і-аланін
С2Н5
.О-2-хлоробуган
н—
СН2СООН
,0-яблучна кислота
