
- •Введение
- •Раздел 1. Мыловаренное производство
- •Глава 1. Общие сведения
- •1.1. Краткая история возникновения и развития мыловарения
- •1.2. Химические реакции при образовании мыл
- •1.3. Физико-химические свойства мыл и их водных растворов
- •1.4. Природа водных растворов мыл
- •1.4.1. Структура мыл
- •1.4.2. Поверхностная активность
- •1.4.3. Пенообразование
- •1.4.4. Моющее действие
- •Недостатки мыл
- •1.5. Классификация мыл
- •1.6. Качественные нормы на товарно-выпускаемые мыла
- •Глава 2. Сырье и материалы, используемые в мыловаренном производстве
- •2.1. Жиры
- •2.2. Жирные кислоты
- •2.3. Жирозаменители
- •2.4. Жиросодержащие отходы
- •Соапстоки
- •Отработанные отбельные глины
- •Жир из ловушек и другие жировые отходы
- •2.5. Природные жирозаменители
- •Канифоль
- •Нафтеновые кислоты
- •Технические нафтеновые кислоты.
- •Талловое масло
- •2.6. Щелочи
- •2.7. Принципы составления рецептур для варки мыла
- •2.7.1. Жировые рецептуры для производства хозяйственного мыла Твердые мыла
- •Жидкое мыло
- •2.7.2. Жировые рецептуры туалетного мыла Твердое мыло
- •Жидкое туалетное мыло
- •2.8. Расчеты, выполняемые при составлении рецептур мыла
- •2.8.1. Определение титра жировой смеси
- •2.8.2. Определение числа нейтрализации жировой смеси
- •2.8.3. Расчет числа омыления жировой смеси
- •2.8.3. Расчет выхода безводного мыла
- •2.8.4. Расчет содержания воды в товарном мыле
- •2.8.5. Определение расхода нейтральных жиров и жирных кислот
- •2.8.6. Расчет расхода щелочи
- •2.8.7.Расчет количества углекислого газа
- •2.8.8. Нормы расхода сырья и материалов
- •Глава 3. Подготовка сырья в мыловаренном производстве
- •3.1. Очистка жиров и жиросодержащего сырья
- •3.2. Подготовка канифоли
- •3.3. Приготовление растворов щелочи
- •3.4. Подготовка поваренной соли
- •Глава 4 .Технологический процесс производства мыла
- •4.1 Технология варки мыла
- •4.1.1 Прямой метод варки
- •4.1.2 Косвенный метод варки
- •4.1.3. Омыление нейтрального жира
- •4.1.4. Карбонатное омыление
- •4.1.5. Влияние электролитов на мыльный клей
- •4.2. Прямой периодический метод варки мыла
- •4.3. Косвенный периодический метод варки мыла
- •4.4. Схемы варки определенных видов мыла
- •4.4.1. Общая технологическая схем варки мыла
- •4.4.2. Варка хозяйственного мыла
- •Варка мыла по методу в.Н.Покровского
- •4.4.3. Варка мыла из соапстоков и фузов
- •4.4.4. Методы отбеливания мыла
- •4.4.5. Варка мраморного мыла
- •4.4.6. Варка мыла ддт
- •4.4.7. Варка жидких мыл
- •4.5. Варка основы туалетного мыла
- •4.5.1. Варка мыльной основы из нейтральных жиров косвенным методом
- •4.5.2. Варка туалетной основы из жирных кислот
- •4.6. Варка жидкого туалетного мыла
- •4.7. Непрерывные методы варки мыла
- •4.7.1. Прямой непрерывный метод варки мыла
- •4.7.2. Прямой непрерывный метод варки мыла на установках тнб-1, бшм
- •4.7.2. Косвенный непрерывный метод варки мыла
- •Варка мыла с помощью системы Монсавон
- •4.8. Используемые методы оценки качества мыла
- •4.8.1. Органолептические методы контроля
- •4.8.2. Методы быстрого контроля процесса варки ядрового мыла
- •Глава 5. Придание твердому мылу товарной формы
- •5.1. Охлаждение мыла и используемое для этих целей оборудование
- •5.2. Понятие о кристаллической структуре мыла и о ее превращениях
- •5.3. Способы непрерывного охлаждения мыла
- •5.4. Резка мыла и используемое при этом оборудование
- •5.5. Штамповка готовых кусков мыла
- •5.6. Непрерывное производство пилированного хозяйственного мыла.
- •5.7. Придание товарного вида туалетному мылу
- •5.8. Общая технологическая схема придания туалетному мылу товарного вида
- •5.9. Общая технологическая схема непрерывного процесса производства туалетного мыла.
- •5.10. Общая технологическая схема непрерывного процесса производства мыла
- •Глава 6. Производство порошкообразных мыл
- •Раздел II Синтетические моющие средства и технология их приготовления
- •Глава 1. Общие сведения о синтетических моющих средствах
- •Глава 2. Сырье и материалы для производства синтетических моющих средств
- •2.1. Поверхностно – активные вещества (пав)
- •2.1.1. Ионогенные пав
- •2.1.2. Неионогенные пав
- •2.1.3. Катионоактивные вещества
- •2.1.4. Неионогенные моющие вещества
- •2.2. Электролиты
- •2.3. Перекисные соли
- •2.4. Прочие компоненты моющих средств
- •2.5. Виды моющих и чистящих средств и рецептуры некоторых из них
- •Рецептуры шампуней для мытья головы
- •Глава 3. Основы технологии изготовления синтетических моющих средств
- •3.1. Производство синтетических моющих порошков
- •3.2. Производство жидких моющих средств
- •3.3. Производство кусковых моющих средств
- •3.4. Производство чистящих средств
- •Раздел 3. Техника безопасности в производстве мыла, синтетических порошков и моющих средств
- •Приложение
- •Туалетное мыло
- •Требования, предъявляемые к жировому сырью Животные жиры
- •Требования, предъявляемые к природным жирозаменителям
- •Требования, предъявляемые к щелочам
- •Кальцинированная сода (углекислый натрий) синтетическая
- •Плотность и концентрация водных растворов
- •Раздел IV. Эмульгаторы
- •Глава 1. Производство и применение эмульгаторов в пищевой промышленности
- •1.1. Синтез эмульгаторов типа т1 и т–ф
- •1.2. Синтез эмульгатора типа т–1 способом этерификации (рис. 65)
- •1.3. Синтез эмульгатора типа т–1 методом переэтерификации (глицеролиз, рис. 66)
- •1.4. Синтез эмульгатора типа мд (рис. 67)
- •1.5. Синтез эмульгатора марки т–ф (рис. 65)
- •1.6. Синтез эмульгатора марки т–2 (рис. 68)
- •1.6.1. Синтез полиглицерина (рис. 68)
- •1.6.2. Синтез эфиров полиглицерина (рис. 68)
- •1.7. Синтез высококонцентрированных моноглицеридов (рис. 69)
- •1.8. Синтез лактилированых моноглицеридов (марки лмг, рис. 70)
- •1.9. Синтез моноглицеридов диацетил винной кислоты (мгс–дв, рис. 71)
- •Глава 2. Синтез эмульгаторов, используемых в технических целях, в частности в производстве шампуней
- •2.1. Синтез этаноламинных мыл
1.2. Химические реакции при образовании мыл
Образование мыл происходит в процессе протеканий следующих химических реакций:
а) при использовании, в качестве жирового сырья нейтрального жира и едких щелочей:
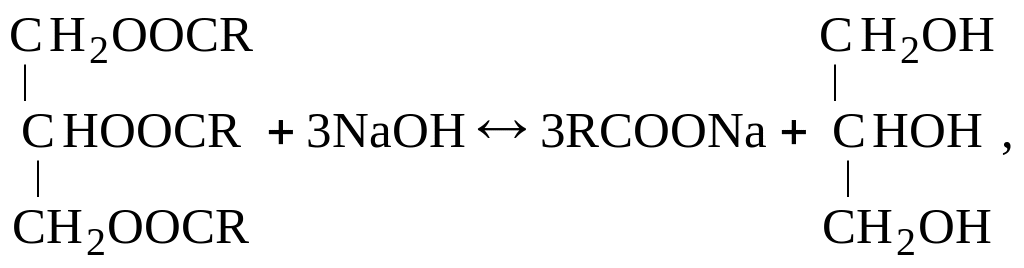
где: R – в данной и последующих реакциях углеводородный радикал жирной кислоты (с оптимальным содержанием атомов углерода в алифатической цепочке от 10 до 20).
б) при использовании в качестве жирового сырья жирных, смоляных и нафтеновых кислот и едких щелочей:
![]()
в) при нейтрализации жирных смоляных и нафтеновых кислот углекислой содой:
![]()
Такая реакция протекает в несколько этапов. Сначала при взаимодействии углекислого натрия с водой образуется:
![]()
И только после этого наблюдается реакция мылообразования:
![]()
Причем, при температурах до 600С эта реакция приводит к одновременному образованию мыла и бикарбоната натрия по схеме:
![]()
Если реакцию осуществляют при температуре > 600С, то образовавшийся бикарбонат натрия разлагается:

Образовавшаяся при этом молекула соды вновь включается в реакции образования мыла по вышеприведенным схемам.
Таким образом, при использовании кальцинированной соды, в процессе мылообразования, в реакциях участвует не углекислый натрий, а едкая щёлочь. Это же объясняет и сам процесс омыления содой нейтральных жиров.
Именно эта реакция представляет наибольший практический интерес, поскольку кальцинированная сода имеется в природных условиях, в виде мощнейших пластовых залежей, порой с толщиной пласта до 60–100 м (в частности в Украине, в районе г. Славянска Донецкой обл.) и её стоимость, на порядок ниже каустической щёлочи. Причем, последняя в природе в свободном состоянии не существует, а получают её при электролизе;
г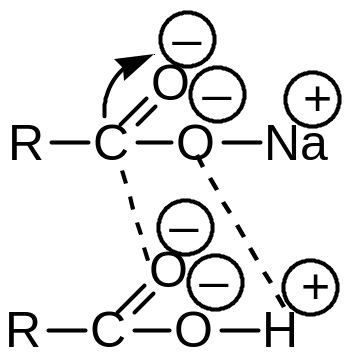 )
В процессе нейтрализации свободных
жирных кислот, при недостатке щёлочи,
за счет реализации водородных связей
образуются ассоциаты, так называемые
«кислые
мыла»,
которые в воде плохо растворимы и
практически не обладают моющим действием:
)
В процессе нейтрализации свободных
жирных кислот, при недостатке щёлочи,
за счет реализации водородных связей
образуются ассоциаты, так называемые
«кислые
мыла»,
которые в воде плохо растворимы и
практически не обладают моющим действием:
В этом случае, молекула мыла и жирной кислоты соединяются друг с другом за счет сил физического взаимодействия противоположно заряженными атомами двух различных молекул: жирной кислоты и мыла.
В общем виде, «кислое мыло» обозначают общей формулой:
![]()
д) Реакция омыления нейтральных жиров и нейтрализации образующихся при этом жирных кислот (или непосредственно жирных кислот как исходного сырья) едким кали (КОН) или углекислой калиевой солью-поташом (К2СО3) протекают по аналогичным схемам.
Оба вида реакций (омыления триглицеридов жирных кислот – жиров и нейтрализация жирных кислот) экзотермичны, т.е. протекают с выделением тепла и данный факт необходимо учитывать при осуществлении процесса мыловарения в условиях реального производства.
1.3. Физико-химические свойства мыл и их водных растворов
а) Консистенция:
В зависимости от природы и свойств жирового сырья и жирозаменителей, щёлочи, а также содержания жирно-кислых солей в нём, получаемые мыла могут иметь твердую, мягкую или мазеобразную консистенцию.
Обычно, на основе твердых жирных кислот получают твердые мыла, на основе жидких жирных кислот – мягкие или мазеобразные.
При использовании в качестве щёлочи едкого кали или поташа (К2СО3) образуются мыла более мягкие, (т.е. при одинаковой природе кислотного радикала и концентрации солей жирных кислот в нём, такие мыла имеют меньшую температуру плавления). Данный эффект связан с тем явлением, что атомный радиус калия намного больше атомного радиуса натрия, что мешает более плотной упаковке молекул образующегося мыла в пространстве и приводит к аморфному (неупорядоченному) состоянию;
б) Температура плавления:
Чистые, абсолютно безводные мыла характеризуются весьма высокой температурой плавления, находящейся в пределах 225-2700С, зависящей от природы используемых жирных кислот и природы щелочного металла.
Присутствие в мыле воды снижает его температуру плавления и в тем большей степени, чем больше доля воды в нём. Например, хозяйственное 60% по содержанию жирнокислотных солей мыло (40% мас. влаги в нём), плавится уже при температуре ниже 1000С.
в) Плотность:
Плотность мыла зависит от степени упорядоченности его макромолекул (кристаллизации) в пространстве и обусловливается, содержанием в мыле солей жирных кислот, количества воды, природы щелочного металла, составом жировой основы, количеством электролитов в нём. Например, плотность 60% мыла при 90–950С, в жидком состоянии равна 970 кг/м3. При наличии в мыле избытка электролитов, сверх допустимых значений – плотность его возрастает;
г) Гигроскопичность:
Мыла являются гигроскопичными продуктами. Причём, калиевые, в большей степени, чем натриевые; мыла на основе ненасыщенных жирных кислот, в большей степени, чем на основе насыщенных.
Этот показатель интересен тем, что поглощая влагу, мыло набухает, увеличиваясь в объёме, вплоть до полного растворения. Кроме того, процесс набухания сопровождается выделением соответствующего количества тепла, что в определённых условиях, при поглощении мыльной стружкой влаги или при хранении смеси сухой и влажной стружки мыла, может привезти к обугливанию и даже самовозгоранию, с большими негативными последствиями;
д) Растворимость в воде и спиртах:
Растворимость мыл в воде зависит от целого ряда факторов. Мыла на основе низкомолекулярных кислот растворяются в воде быстрее и в большей концентрации, чем мыла на основе высокомолекулярных жирных кислот. Растворимость в воде мыл на основе высокомолекулярных жирных кислот, в присутствии мыл на основе низкомолекулярных жирных кислот, растёт. Мыла на основе ненасыщенных жирных кислот растворяются лучше, чем мыла на основе насыщенных кислот.
Хорошей растворимостью в воде характеризуются мыла на основе нафтеновых и смоляных жирных кислот. Калиевые мыла обладают лучшей растворимостью, чем натриевые. С повышением температуры растворимость мыл в воде возрастает.
Что касается мыл тяжелых, щелочно-земельных металлов, то они в воде нерастворимы и их присутствие в товарном мыле недопустимо.
Мыла хорошо растворяются в спирте, особенно при повышенных температурах, образуя при этом истинные растворы.
В серном эфире, бензине, ацетоне и других органических растворителях мыла практически не растворяются. Зато кислые мыла наоборот – растворяются хорошо.
Такие органические вещества, как фенол, крезол, гексалин и другие хорошо растворяются в водных мыльных растворах, особенно с повышенной концентрацией мыла.
Мыла, будучи по своей природе, солями сильного основания и слабой органической кислоты, в водном растворе гидролизуются по схеме:
![]()
давая свободную щёлочь и слабую органическую кислоту. Именно это и обусловливает как электропроводность, так и щелочную реакцию водных мыльных растворов.
Одновременно, молекула жирной кислоты (если концентрация мыльного раствора не слишком мала), с молекулами негидролизованного мыла образует кислое мыло, по выше указанной схеме.
С повышением молекулярной массы жирной кислоты мыла, температуры раствора, с понижением концентрации мыльного раствора, гидролиз мыл усиливается. Причём, поскольку ненасыщенные жирные кислоты более сильные чем насыщенные, то гидролиз мыл на их основе протекает слабее.
Намного сильнее гидролизуются мыла на основе смоляных жирных кислот. Если в водный мыльный раствор вести щёлочь(в виде NaOH, Na2CO3, силиката натрия и др.), то уравнение процесса гидролиза мыла сдвигается влево, вплоть до полного подавления его.
Аналогично, снижает или полностью подавляет процесс гидролиза мыл введение в мыльные растворы этилового спирта, особенно в количестве более 60% мас.
е) Реакции разложения мыл:
Минеральные кислоты, как более сильные, разлагают мыла с выделением свободных жирных кислот по схеме:
![]()
Эту реакцию часто используют при разложении доомыленных соапстоков или грязных мыл с выделением жирных кислот и последующей их дистилляцией. Получаемые чистые жирные кислоты могут быть использованы даже для изготовления основы туалетных мыл.
Слабые кислоты, в частности угольная, при низкой температуре, частично разлагают натриевое мыло с образованием бикарбоната натрия и кислого мыла.
В горячих растворах такого разложения мыл не наблюдается.
Мыла могут вступать в реакции обменного разложения. В частности, калиевые мыла при обработке поваренной солью можно превратить в натриевые и наоборот.
Растворы солей тяжелых или щелочноземельных металлов вступают в реакции обменного разложения с обычными растворами мыл по схеме:
![]()
с образованием нерастворимых в воде щелочноземельных мыл.
и) Вязкость водных мыльных растворов:
Вязкость водных мыльных растворов снижается с повышением температуры и возрастает с повышением концентрации мыла вплоть до затвердевания. Введение в мыльные растворы небольшого количества электролитов способствует понижению вязкости, а большое количество приводит к изменению структуры водных клеевых мыльных растворов, повышению вязкости и последующей высолке мыла.
