
- •Теория строения органических соединений а.М. Бутлерова. Изомерия. Гомология.
- •Строение атома углерода в органических соединениях. Виды гибридизации. Классификация органических соединений.
- •Взаимное влияние атомов в молекулах органических соединений. Электронные эффекты. Индуктивный эффект.
- •Алканы. Гомологический ряд. Изомерия. Номенклатура. Конформации алканов.
- •Химические свойства алканов. Применение метана, этана, пропана, бутана, вазелинового масла, парафинов, вазелина, озокерита и др. Представителей алканов.
- •Алкены. Гомологический ряд. Строение двойной связи. Номенклатура. Изомерия: цис- и транс- изомерия.
- •Физические свойства алкенов. Методы получения: промышленные и лабораторные. Пиролиз алканов.
- •Алкены. Химические свойства. Правило Зайцева. Образование карбкатиона. Реакции электрофильного присоединения. Правило Марковникова.
- •Области применения олефинов в органическом и нефтехимическом синтезе. Полимеры. Реакции полимеризации, поликонденсации.
- •Получение полиэтилена, полипропилена, акрилонитрила, фторированного этилена, бутилена и др. Отдельные представители и их применение.
- •Алкадиены. Номенклатура. Строение бутадиена -1,3. Сопряженная система. Делокализация. Изомерия.
- •Физические свойства алкадиенов. Методы получения. Крекинг-процесс нефти и газа. Промышленное производство синтетического бутадиенового каучука по методу с.В. Лебедеву.
- •Алкины. Строение тройной связи. Номенклатура и изомерия.
- •Промышленные методы получения ацетилена и его гомологов на основе нефтегазового сырья. Высокотемпературный крекинг метана. Получение ацетилена из каменного угля.
- •Физические и химические свойства алкинов. Реакции электрофильного присоединения. Гидратация и изомеризация алкинов. Правило а.П. Эльтекова.
- •Галогенопроизводные углеводороды. Галогенопроизводные углеводороды. Определение и классификация. Номенклатура и изомерия.
- •Производные бензола с содержанием двух атомов галогена. Особенности строения. Способы получения.
- •Галогенопроизводные углеводороды. Способы получения: галогенирование алканов, циклоалканов, алкенов и алкинов, аренов.
- •Галогенопроизводные углеводороды. Физические свойства.
- •Галогенопроизводные углеводороды. Реакции элиминирования в галогеналканах: щелочное дегидрогалогенирование.
- •Реакции ароматических галогенопроизводных: гидролиз хлорбензола, галогенирование бромбензола. Нитрование хлорбензола, сульфирование бромбензола.
- •Физические свойства спиртов одноатомных спиртов. Образование водородных связей.
- •Реакции элиминирования одноатомных спиртов: внутримолекулярная дегидратация спиртов.
- •Реакции окисления одноатомных спиртов в альдегиды и кетоны. Промышленное каталитическое дегидрирование спиртов с образованием альдегидов и кетонов.
- •Двух- и трехатомные спирты. Получение гликолей из галогенпроизводных, гидроксилированием алкенов. Получение глицерина.
- •Двух- и трехатомные спирты. Межмолекулярная дегидратация этиленгликоля с получением диоксана (Метод а.Е. Фаворского).
- •Фенолы. Определение и классификация. Одноатомные, двухатомные, трехоатомные фенолы. Номенклатура и изомерия.
-
Двух- и трехатомные спирты. Получение гликолей из галогенпроизводных, гидроксилированием алкенов. Получение глицерина.
 Общим методом
синтеза гликолей служит гидролиз
соответствующих дигалогенидов (I) или
хлоргидринов (II); 1,2-гликоли получают
также гидратацией соответствующих a-
окисей (III) или окислением олефинов
(IV):гликоль синтез дегидратация
Общим методом
синтеза гликолей служит гидролиз
соответствующих дигалогенидов (I) или
хлоргидринов (II); 1,2-гликоли получают
также гидратацией соответствующих a-
окисей (III) или окислением олефинов
(IV):гликоль синтез дегидратация
Химическая формула глицерина — C3H5(OH)3.
 Синтезировать
глицерин можно и другими способами.
Например, из ацетона. В этом случае его
восстанавливают водородом, чтобы
получить изопропиловый спирт. На
следующей стадии дегидратацией отщепляют
молекулу воды, получая пропилен, который
затем хлорируют. Полученный дихлорпропан
хлорируют еще раз, для получения
трихлорпропана. Последняя стадия
получения глицерина — гидратация при
нагревании.
Синтезировать
глицерин можно и другими способами.
Например, из ацетона. В этом случае его
восстанавливают водородом, чтобы
получить изопропиловый спирт. На
следующей стадии дегидратацией отщепляют
молекулу воды, получая пропилен, который
затем хлорируют. Полученный дихлорпропан
хлорируют еще раз, для получения
трихлорпропана. Последняя стадия
получения глицерина — гидратация при
нагревании.

-
Двух- и трехатомные спирты. Межмолекулярная дегидратация этиленгликоля с получением диоксана (Метод а.Е. Фаворского).


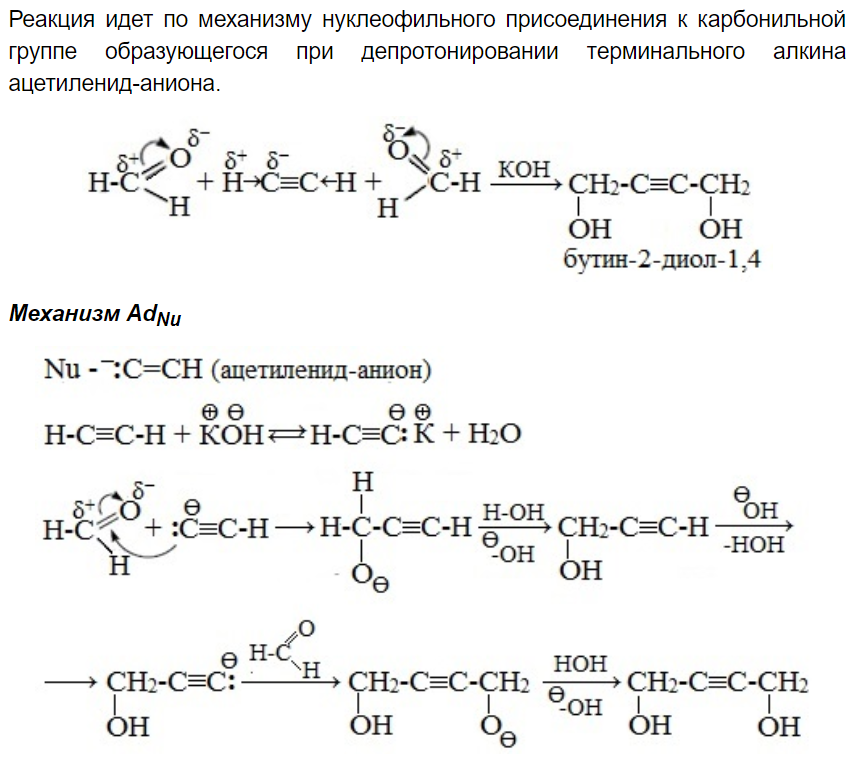
-
Образование глицерата меди и тринитроглицерина. Отдельные представители, их физические свойства и применение: метанол, этанол, пропанол, бутанол, этиленгликоль, глицерин.
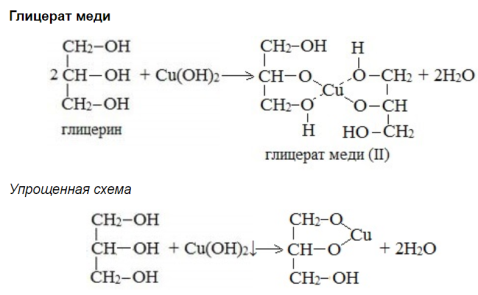

Физические свойства н-пропанола.
Температура кипения: 97°C
Температура плавления: -127°C
Относительная плотность (вода = 1): 0.8
Растворимость в воде: смешивается
Давление паров, кПа при 20°C: 2.0
Относительная плотность пара (воздух = 1): 2.1
Применение: Пропанол-Н (Пропанол нормальный) применяется в качестве растворителя и промежуточного химического продукта. Основное применение: флексографическая печать и другие виды чернил для печати.



-
Фенолы. Определение и классификация. Одноатомные, двухатомные, трехоатомные фенолы. Номенклатура и изомерия.


-
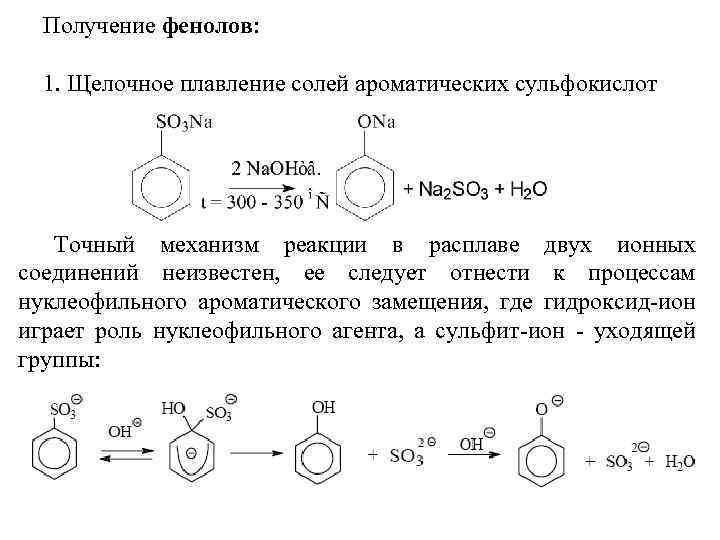
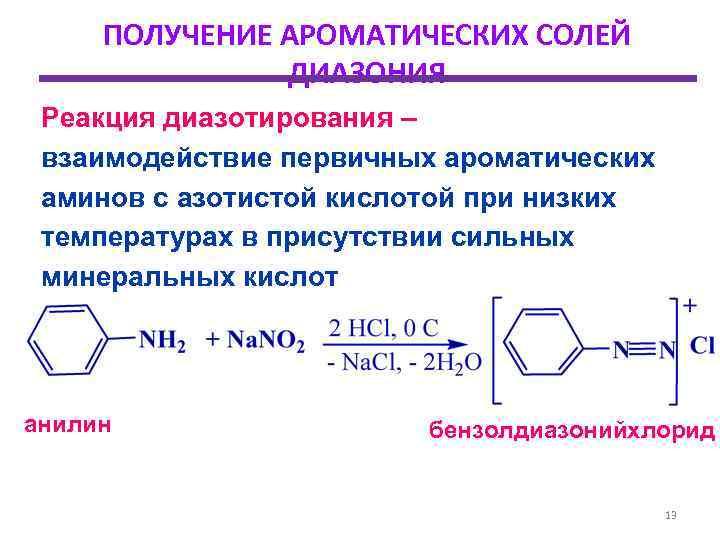
Способы получения фенолов: сплавление натриевых или калиевых солей сульфокислот со щелочами «реакция щелочного плава» с получением резорцина, диазотирование анилина и его производных, промышленное выделение из каменноугольного дегтя.
Каменноугольный дёготь первичный отличается высоким содержанием фенолов (до 40%). Он может быть эффективно переработан методом гидрогенизации. Однако более простой способ — дистилляция с отбором лёгких и средних фракций, которые затем подвергают очистке и вторичной перегонке. Из полученных при щелочной очистке фенолятов отдуваются паром нейтральные масла. Затем феноляты обрабатывают углекислым газом и получают так называемое «сырые» фенолы (смесь фенола, крезолов, ксиленолов и высших фенолов).
-
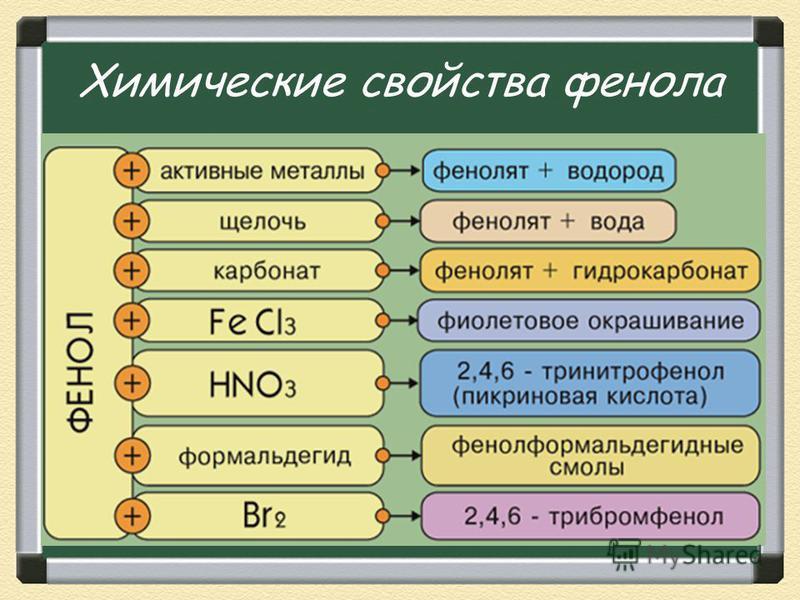
Физические свойства фенолов. Мезомерный эффект. Химические свойства фенолов. Реакции нуклеофильного замещения: образование простых эфиров, ацилирование фенолов с образованием сложных эфиров.
Фенолы – кристаллические вещества при комнатой температуре. Плохо растворимы в холодной воде, но хорошо – в горячей и в водных растворах щелочей. Обладают характерным запахом. Вследствие образования водородных связей, обладают высокой температурой кипения и плавления.


-
Реакции углеводородного радикала: галогенирование, нитрование, сульфирование, окисление. Качественная реакция с хлоридом железа (III). Отдельные представители и их применение: фенол, гидрохинон, пирокатехин, резорцин, пикриновая кислота и др.


 Фенол и
крезолы используют как вещества с сильно
дезинфицирующим действием. Разбавленные
водные растворы фенола (карболка
(5%)) применяют для дезинфекции помещений.
Водные эмульсии крезолов с раствором
мыла свое применение находят
в ветеринарии
Фенол и
крезолы используют как вещества с сильно
дезинфицирующим действием. Разбавленные
водные растворы фенола (карболка
(5%)) применяют для дезинфекции помещений.
Водные эмульсии крезолов с раствором
мыла свое применение находят
в ветеринарии
Гидрохинон – лучшее, что придумали для борьбы с пигментацией. Это вещество активно используется в косметологии и медицине. Но такое высокоэффективное средство имеет и негативные последствия.Резорцин относится к группе медикаментозных средств антисептического действия. Он обладает противомикробным и противосеборейным эффектом. Пикриновую кислоту и её соли, пикраты, используют как взрывчатые вещества, а также в аналитической химии для определения калия, натрия.
