
- •Теория строения органических соединений а.М. Бутлерова. Изомерия. Гомология.
- •Строение атома углерода в органических соединениях. Виды гибридизации. Классификация органических соединений.
- •Взаимное влияние атомов в молекулах органических соединений. Электронные эффекты. Индуктивный эффект.
- •Алканы. Гомологический ряд. Изомерия. Номенклатура. Конформации алканов.
- •Химические свойства алканов. Применение метана, этана, пропана, бутана, вазелинового масла, парафинов, вазелина, озокерита и др. Представителей алканов.
- •Алкены. Гомологический ряд. Строение двойной связи. Номенклатура. Изомерия: цис- и транс- изомерия.
- •Физические свойства алкенов. Методы получения: промышленные и лабораторные. Пиролиз алканов.
- •Алкены. Химические свойства. Правило Зайцева. Образование карбкатиона. Реакции электрофильного присоединения. Правило Марковникова.
- •Области применения олефинов в органическом и нефтехимическом синтезе. Полимеры. Реакции полимеризации, поликонденсации.
- •Получение полиэтилена, полипропилена, акрилонитрила, фторированного этилена, бутилена и др. Отдельные представители и их применение.
- •Алкадиены. Номенклатура. Строение бутадиена -1,3. Сопряженная система. Делокализация. Изомерия.
- •Физические свойства алкадиенов. Методы получения. Крекинг-процесс нефти и газа. Промышленное производство синтетического бутадиенового каучука по методу с.В. Лебедеву.
- •Алкины. Строение тройной связи. Номенклатура и изомерия.
- •Промышленные методы получения ацетилена и его гомологов на основе нефтегазового сырья. Высокотемпературный крекинг метана. Получение ацетилена из каменного угля.
- •Физические и химические свойства алкинов. Реакции электрофильного присоединения. Гидратация и изомеризация алкинов. Правило а.П. Эльтекова.
- •Галогенопроизводные углеводороды. Галогенопроизводные углеводороды. Определение и классификация. Номенклатура и изомерия.
- •Производные бензола с содержанием двух атомов галогена. Особенности строения. Способы получения.
- •Галогенопроизводные углеводороды. Способы получения: галогенирование алканов, циклоалканов, алкенов и алкинов, аренов.
- •Галогенопроизводные углеводороды. Физические свойства.
- •Галогенопроизводные углеводороды. Реакции элиминирования в галогеналканах: щелочное дегидрогалогенирование.
- •Реакции ароматических галогенопроизводных: гидролиз хлорбензола, галогенирование бромбензола. Нитрование хлорбензола, сульфирование бромбензола.
- •Физические свойства спиртов одноатомных спиртов. Образование водородных связей.
- •Реакции элиминирования одноатомных спиртов: внутримолекулярная дегидратация спиртов.
- •Реакции окисления одноатомных спиртов в альдегиды и кетоны. Промышленное каталитическое дегидрирование спиртов с образованием альдегидов и кетонов.
- •Двух- и трехатомные спирты. Получение гликолей из галогенпроизводных, гидроксилированием алкенов. Получение глицерина.
- •Двух- и трехатомные спирты. Межмолекулярная дегидратация этиленгликоля с получением диоксана (Метод а.Е. Фаворского).
- •Фенолы. Определение и классификация. Одноатомные, двухатомные, трехоатомные фенолы. Номенклатура и изомерия.
-
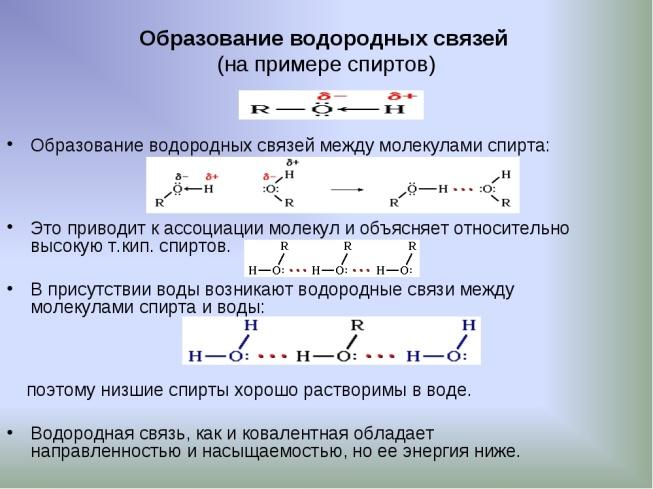
Физические свойства спиртов одноатомных спиртов. Образование водородных связей.
Физические свойства одноатомных спиртов. Спирты с числом углеродных атомов С1 — С15 представляют собой жидкости, более С15 – твердые вещества. Имеют резкий запах. Первый член ряда – метанол очень токсичен (смертельная доза для человека — 30 г). Температура кипения. Размер молекулы спирта определяет его температуры кипения и плавления. Обычно, чем больше размер спирта, тем выше температура кипения.
-
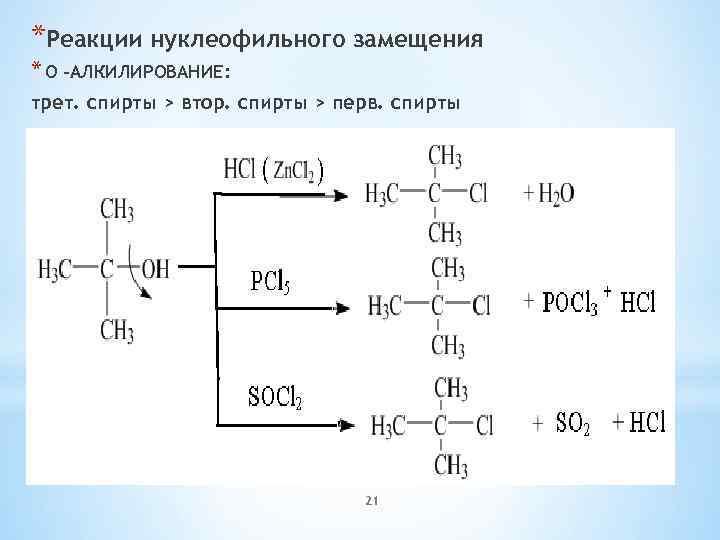
Химические свойства одноатомных спиртов: кислотные свойства - образование алкоголятов, основные свойства. Реакции нуклеофильного замещения: взаимодействие с галогеноводородными кислотами, образование простых и сложных эфиров, межмолекулярная дегидратация спиртов.
1) Взаимодействие
с щелочными металлами (образование
алкоголятов). Подобно воде, спирты
взаимодействуют с щелочными металлами,
образуя алкоголяты (по другому их
называют алкоксиды). Под действием воды
алкоголяты гидролизуются с образованием
спирта и основания: ![]()
Спирты не реагируют с водными растворами щелочей, однако взаимодействуют с их спиртовыми растворами, образуя также алкоголяты:
Алкоголяты щелочных металлов имеют сильно полярную связь О – Ме и диссоциируют в спиртовом растворе на алкоксид – анионы и катионы металла, например, метилат (метоксид) натрия диссоциирует на метоксид – анион и катион натрия:
СH3ONa → СH3O— + Na+
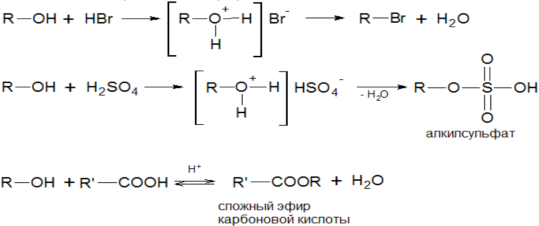
2) Взаимодействие с минеральными и органическими кислотами (образование сложных эфиров). Такие реакции называются реакциями этерификации:
3) Взаимодействие с хлористым тионилом ведет к образованию галогеналканов:
![]()
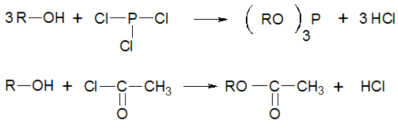
4) Взаимодействие с хлорангидридами минеральных (неорганических) и органических кислот(образование сложных эфиров). Реакции с первичными спиртами:
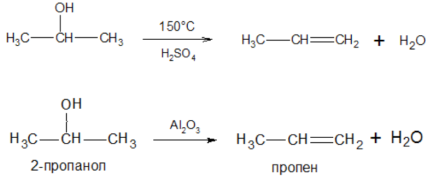
5) Внутримолекулярная дегидратация спиртов (образование алкенов) протекает при нагревании с кислотами или при пропускании спирта над окисью алюминия при ~375°С:
Наиболее легко вода отщепляется от третичных спиртов.
6) Межмолекулярная дегидратация спиртов (образование простых эфиров) происходит при слабом нагревании с кислотами или другими водоотнимающими веществами:
Простые
эфиры можно получить, используя синтез
Вильямсона: ![]()
7) Взаимодействие
одноатомных спиртов с бихроматом или
перманганатом калия приводит
к их окислению. При окислении первичного
спирта образуется альдегид, вторичного
– кетон. При дальнейшем окислении
альдегида можно получить карбоновую
кислоту: 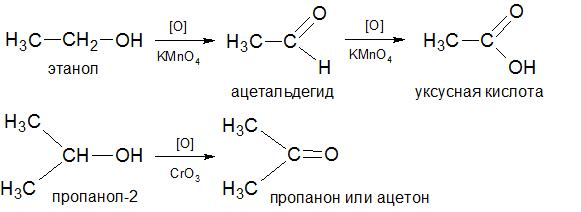
Как и другие органические соединения спирты горят с образованием углекислого газа и воды.
-
Реакции элиминирования одноатомных спиртов: внутримолекулярная дегидратация спиртов.


-
Реакции окисления одноатомных спиртов в альдегиды и кетоны. Промышленное каталитическое дегидрирование спиртов с образованием альдегидов и кетонов.
 Реакции
дегидрирования спиртов необходимы для
получения альдегидов и кетонов. Кетоны
получаются из вторичных спиртов, а
альдегиды из первичных спиртов.
Катализаторами в процессах служат медь,
серебро, хромиты меди, оксид цинка и
т.д. Стоит отметить, что по сравнению с
медными катализаторами оксид цинка
является более стойким и не теряет
активность в ходе процесса, однако может
провоцировать реакцию дегидратации. В
общем виде реакции дегидрирования
спиртов могут быть представлены следующим
образом:
Реакции
дегидрирования спиртов необходимы для
получения альдегидов и кетонов. Кетоны
получаются из вторичных спиртов, а
альдегиды из первичных спиртов.
Катализаторами в процессах служат медь,
серебро, хромиты меди, оксид цинка и
т.д. Стоит отметить, что по сравнению с
медными катализаторами оксид цинка
является более стойким и не теряет
активность в ходе процесса, однако может
провоцировать реакцию дегидратации. В
общем виде реакции дегидрирования
спиртов могут быть представлены следующим
образом:
![]() В
промышленности дегидрированием спиртов
получают такие соединения, как
ацетальдегид, ацетон, метилэтилкетон
и циклогексанон.
В
промышленности дегидрированием спиртов
получают такие соединения, как
ацетальдегид, ацетон, метилэтилкетон
и циклогексанон.
Дегидрирование
этанола осуществляется
на медном или серебряном катализаторе
при температуре 200 - 400 °С и атмосферном
давлении. Катализатор представляет
собой какой-либо носитель Al2O3,
SnO2 или
углеродное волокно, на который нанесены
компоненты серебра или меди. Данная
реакция является одной из составляющих
процесса Вакера, который является
промышленным методом получения уксусного
альдегида из этанола путем его
дегидрирования или окисления кислородом.![]()
