
- •Теория строения органических соединений а.М. Бутлерова. Изомерия. Гомология.
- •Строение атома углерода в органических соединениях. Виды гибридизации. Классификация органических соединений.
- •Взаимное влияние атомов в молекулах органических соединений. Электронные эффекты. Индуктивный эффект.
- •Алканы. Гомологический ряд. Изомерия. Номенклатура. Конформации алканов.
- •Химические свойства алканов. Применение метана, этана, пропана, бутана, вазелинового масла, парафинов, вазелина, озокерита и др. Представителей алканов.
- •Алкены. Гомологический ряд. Строение двойной связи. Номенклатура. Изомерия: цис- и транс- изомерия.
- •Физические свойства алкенов. Методы получения: промышленные и лабораторные. Пиролиз алканов.
- •Алкены. Химические свойства. Правило Зайцева. Образование карбкатиона. Реакции электрофильного присоединения. Правило Марковникова.
- •Области применения олефинов в органическом и нефтехимическом синтезе. Полимеры. Реакции полимеризации, поликонденсации.
- •Получение полиэтилена, полипропилена, акрилонитрила, фторированного этилена, бутилена и др. Отдельные представители и их применение.
- •Алкадиены. Номенклатура. Строение бутадиена -1,3. Сопряженная система. Делокализация. Изомерия.
- •Физические свойства алкадиенов. Методы получения. Крекинг-процесс нефти и газа. Промышленное производство синтетического бутадиенового каучука по методу с.В. Лебедеву.
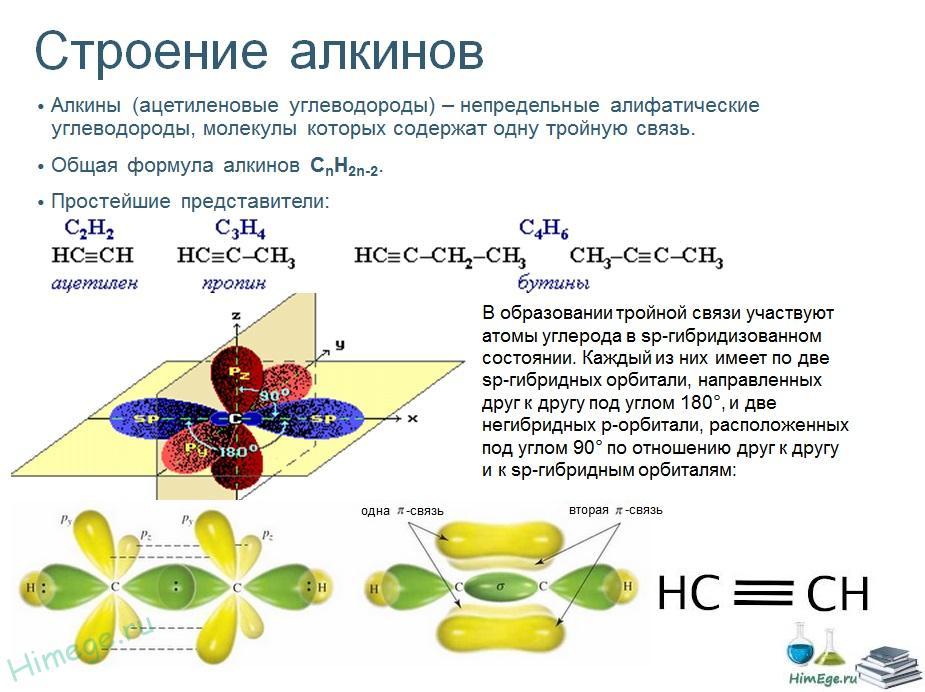
- •Алкины. Строение тройной связи. Номенклатура и изомерия.
- •Промышленные методы получения ацетилена и его гомологов на основе нефтегазового сырья. Высокотемпературный крекинг метана. Получение ацетилена из каменного угля.
- •Физические и химические свойства алкинов. Реакции электрофильного присоединения. Гидратация и изомеризация алкинов. Правило а.П. Эльтекова.
- •Галогенопроизводные углеводороды. Галогенопроизводные углеводороды. Определение и классификация. Номенклатура и изомерия.
- •Производные бензола с содержанием двух атомов галогена. Особенности строения. Способы получения.
- •Галогенопроизводные углеводороды. Способы получения: галогенирование алканов, циклоалканов, алкенов и алкинов, аренов.
- •Галогенопроизводные углеводороды. Физические свойства.
- •Галогенопроизводные углеводороды. Реакции элиминирования в галогеналканах: щелочное дегидрогалогенирование.
- •Реакции ароматических галогенопроизводных: гидролиз хлорбензола, галогенирование бромбензола. Нитрование хлорбензола, сульфирование бромбензола.
- •Физические свойства спиртов одноатомных спиртов. Образование водородных связей.
- •Реакции элиминирования одноатомных спиртов: внутримолекулярная дегидратация спиртов.
- •Реакции окисления одноатомных спиртов в альдегиды и кетоны. Промышленное каталитическое дегидрирование спиртов с образованием альдегидов и кетонов.
- •Двух- и трехатомные спирты. Получение гликолей из галогенпроизводных, гидроксилированием алкенов. Получение глицерина.
- •Двух- и трехатомные спирты. Межмолекулярная дегидратация этиленгликоля с получением диоксана (Метод а.Е. Фаворского).
- •Фенолы. Определение и классификация. Одноатомные, двухатомные, трехоатомные фенолы. Номенклатура и изомерия.
-
Алкины. Строение тройной связи. Номенклатура и изомерия.
Алкины — ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну тройную связь между атомами углерода и соответствующие общей формуле СпН2n-2.
 Для
алкинов характерна структурная изомерия:
изомерия углеродного скелета и изомерия
положения кратной связи. Простейший
алкин, для которого характерны структурные
изомеры положения кратной связи класса
алкинов, — это бутин:
Для
алкинов характерна структурная изомерия:
изомерия углеродного скелета и изомерия
положения кратной связи. Простейший
алкин, для которого характерны структурные
изомеры положения кратной связи класса
алкинов, — это бутин:
![]()
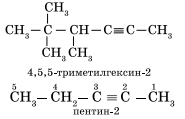
Изомерия углеродного скелета у алкинов возможна, начиная с пентина:
![]()
Наличие тройной связи в молекулах углеводородов этого класса отражается суффиксом — ин, а ее положение в цепи — номером атома углерода. Например:
Алкинам изомерны соединения некоторых других классов. Так, химическую формулу С6Н10 имеют гексин (алкин), гексадиен (алкадиен) и циклогексен (циклоалкен):

-
Промышленные методы получения ацетилена и его гомологов на основе нефтегазового сырья. Высокотемпературный крекинг метана. Получение ацетилена из каменного угля.
Ацетилен в промышленности получают следующими способами и методами:
карбидным методом:
Сначала получают известь из карбоната кальция.
CаСО3 → CаО + CO2. (to = 900-1200 оС).
Затем получают карбид кальция, сплавляя оксид кальция и кокс в электропечах при температуре 2500-3000 °С.
CаО + 3С → CаС2 + CO. (to = 2500-3000 оС).
Далее карбид кальция обрабатывают водой по известной реакции.
CаС2 + H2О → Cа(ОH)2 + C2H2.
В итоге получается ацетилен высокой чистоты – 99,9 %.
высокотемпературным крекингом метана:
Высокотемпературный крекинг метана осуществляется по известной реакции дегидирования метана в электродуговых печах при температуре 2000-3000 °С и напряжении между электродами 1000 В. Выход ацетилена составляет 50 %
-
Физические и химические свойства алкинов. Реакции электрофильного присоединения. Гидратация и изомеризация алкинов. Правило а.П. Эльтекова.
Ф.С. Температуры кипения и плавления алкинов, так же как и алкенов, закономерно повышаются при увеличении молекулярной массы соединений. Алкины имеют специфический запах. Они лучше растворяются в воде, чем алканы и алкены.
Х.М. Для алкинов характерны реакции присоединения, протекающие по нуклеофильному механизму, такие как:
— гидрирование – присоединение воды в присутствии 18%-й серной кислоты, сульфата ртути (II) и нагревании до 90С (реакция Кучерова), в результате чего образуются альдегиды
СH≡CH +H2O → [CH2 = CH-OH] → CH3-CH = O
— галогенирование – присоединение галогенов, протекающее в две стадии
СH≡CH +Br2 →CHBr = CHBr + Br2 →CHBr2-CHBr2
— гидрогалогенирование – присоединение галогеноводородов, также, протекающее в две стадии и присоединение второй молекулы галогеноводорода протекает по правилу Марковникова (присоединение галогеноводородов к тройной связи протекает труднее, чем к двойной)
СH≡CH +HСl → CH2 = CHCl + HCl → CH3-CHCl2
Для алкинов, имеющий концевую тройную связь, характерно наличие слабых кислотных свойств. Такие алкины способны образовывать соли при взаимодействии с активными металлами:
2R-C≡C-H +2Na →2R-C≡C-Na + H2
1. Галогенирование.
Непредельные соединения быстро обесцвечивают раствор брома в воде – бромную воду. Это – качественная реакция на кратные связи.
![]()
2. Гидрогалогенирование.

3. Присоединение серной кислоты.
Серная кислота обязательно должна быть концентрированной.
![]()
4. Гидратация.
Реакция алкена с разбавленным раствором серной кислоты приводит к образованию спирта. Кислота в этой реакции является катализатором присоединения воды к алкену.


-
Образование ацетиленидов. Реакции окисления и восстановления. Применение ацетилена в органическом и нефтехимическом синтезе: получение уксусного альдегида, уксусной кислоты, хлоропрена, бутадиенового каучука, винилхлорида, растворители и др.


-
Алициклические углеводороды. Определение и классификация. Номенклатура и изомерия. Особенности строения циклоалканов. Конформации циклов.
К данной группе относятся циклические алифатические соединения, содержащие насыщенные и ненасыщенные циклы: циклоалканы, циклоал- кены и циклоалкадиены.


Виды конформаций

-
Физические свойства ациклических углеводородов. Методы получения нафтенов.
Циклопропан и циклобутан при обычной температуре - газы, циклопентан и циклооктан - жидкости, высшие представители - твердые вещества.
Одним из способов получения нафтенов является отщепление галогена от таких двугало-генных производных, в которых галогены находятся не у соседних атомов углерода.

-
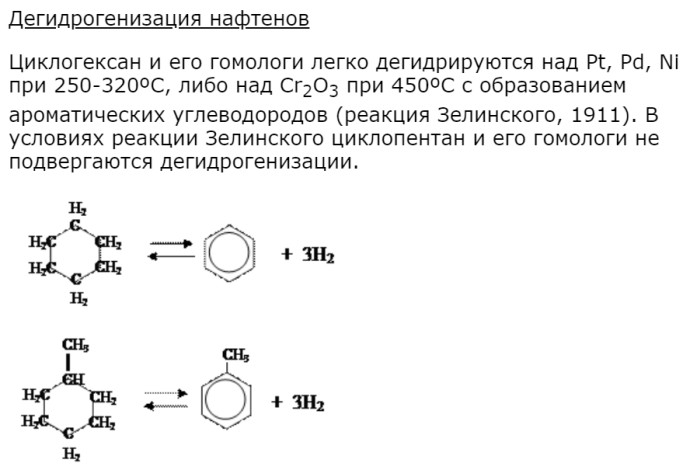
Химические свойства нафтенов. Реакции присоединения, замещения. Взаимодействие циклоалканов с галогенами, галогеноводородами, водородом.



-
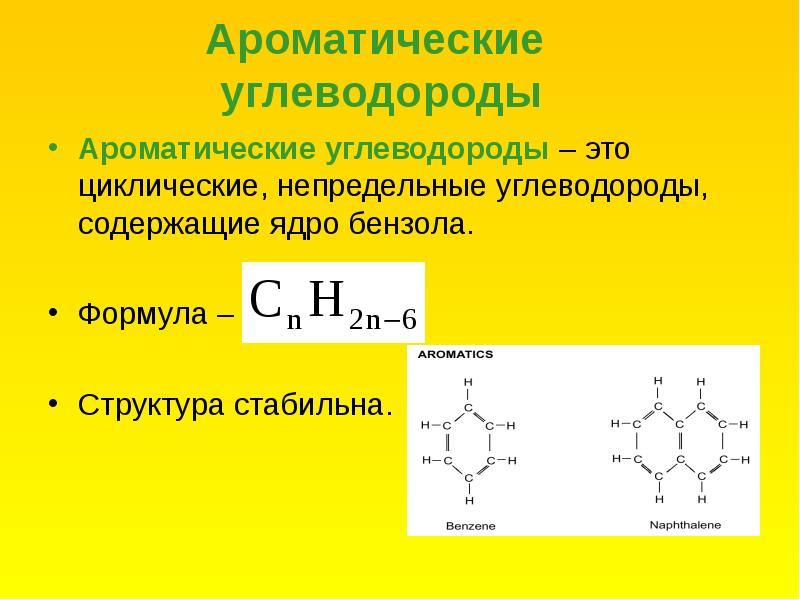
Ароматические углеводороды. Строение бензола. Ароматичность. Правило Хюккеля. Номенклатура и изомерия.

![]()
-
Промышленные методы получения бензола (ароматизация нефти): получение из алифатических углеводородов каталитической дегидроциклизацией, тримеризация ацетилена, каталитическое дегидрирование циклогексана.


-
Ароматические углеводороды. Химические свойства: реакции электрофильного замещения. Образование пи и сигма комплексов.
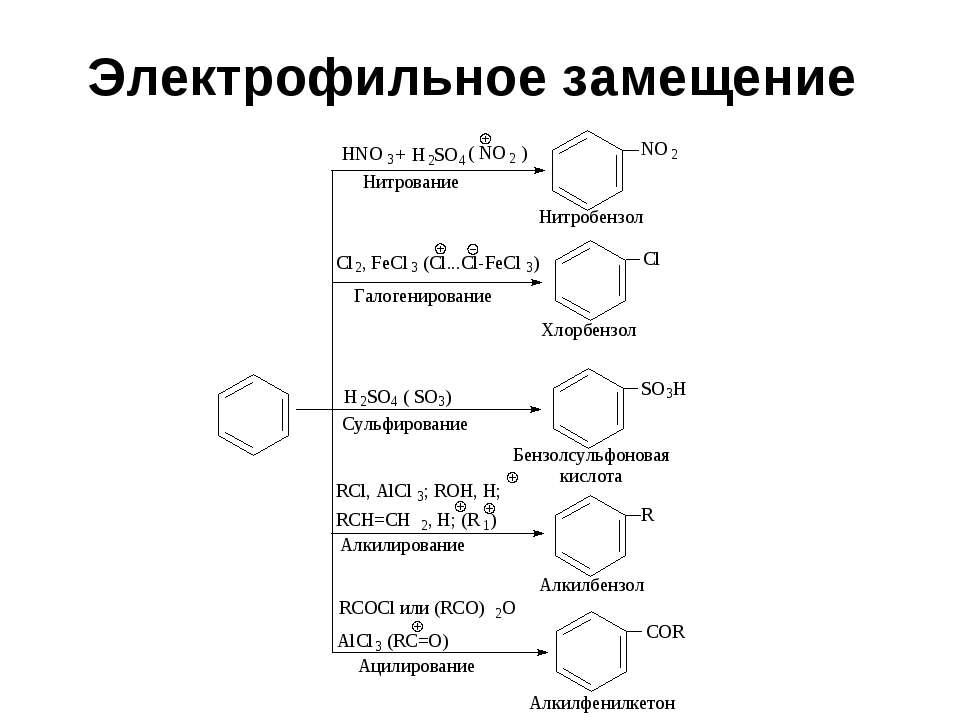

-
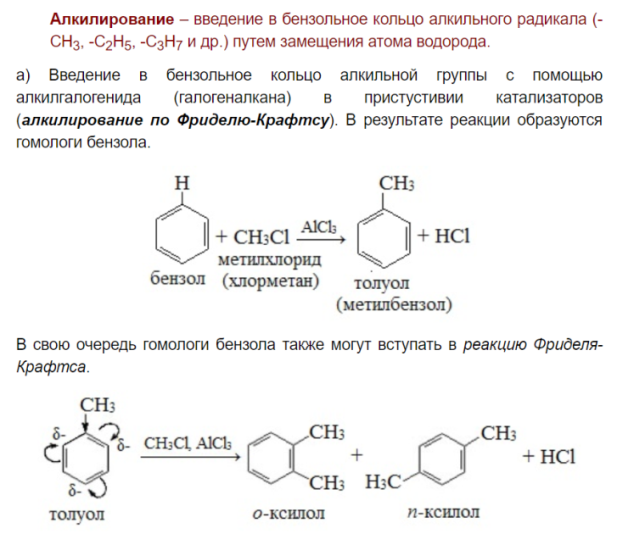
Галогениерование, нитрование, сульфирование аренов. Каталитическое алкилирование бензола по Фриделю-Крафтсу.



-
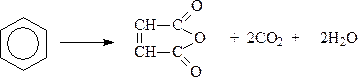
Реакции окисления и восстановления аренов. Реакции в боковой цепи.
Окисление аренов. Само бензольное кольцо отличается необыкновенной устойчивостью к действию окислителей. В этом проявляется так называемый ароматический характер. Обычные окислительные реагенты: CrO3, KMnO4, H2O2, OsO4, которые применяются при окислении алкенов, окислить бензол не могут. Конечно, в очень жестких условиях можно окислить и бензольное кольцо. Для этого требуется 450-5000C и наличие катализатора – пятиокиси ванадия. При окислении бензола кислородом воздуха в указанных условиях бензольное кольцо разрушается и получается малеиновый ангидрид


-
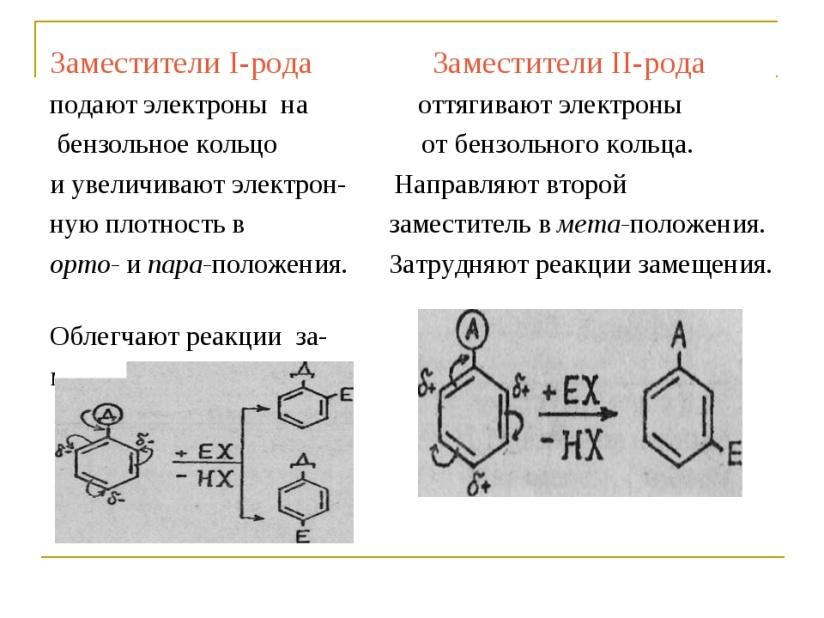
Мезомерный эффект ароматических углеводородов. Правила замещения в производных бензола. Электродонорные и электроноакцепторные заместители. Заместители I рода и заместители II рода.
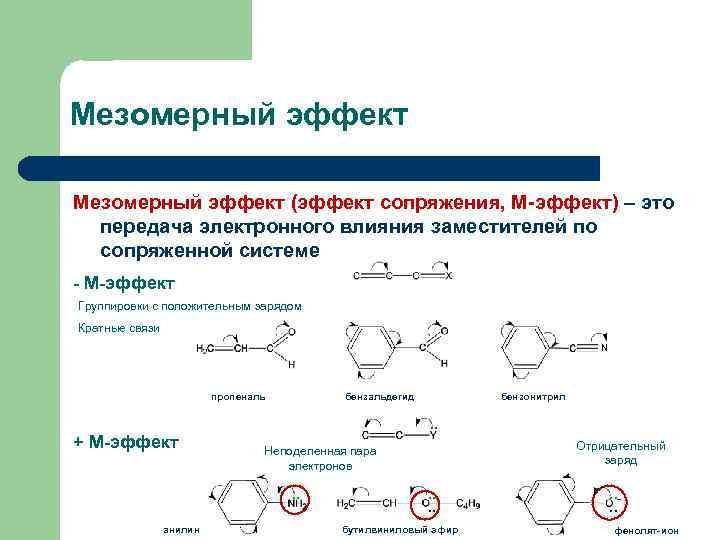
Заместители первого рода: направляют электрофильное замещение в орто и пара-положения и активируют реакцию – она протекает легче, чем с незамещѐнным бензолом.
Эти заместители являются электронодонорами (алкильные группы, OH, NH2, CH3O,)
Заместители второго рода: направляют электрофильное замещение в мета-положения и дезактивируют реакцию – она протекает труднее, чем с незамещѐнным бензолом.
Эти заместители являются электроноакцепторами (COOH, CHO, CONH2, SO3H, NO2)
Галогены. Направляют электрофильное замещение в орто и пара- положения и дезактивируют реакцию (F, Cl, Br, I).
Реакции замещения в производных бензола.Заместители в бензольном кольце вызывают изменения в распределении пи-электронной плотности. Это влияет на такие параметры реакции, как:
скорость реакции, т.е. на относительную реакционную способность соединения;
ориентацию замещения.
-
Отдельные наиболее важные представители аренов, физические свойства и их применение: бензол, толуол, этилбензол, ксилол, пропилбензол, кумол, стирол и полистирол, нафталин, антрацен, фенантрен.






