
- •Теория строения органических соединений а.М. Бутлерова. Изомерия. Гомология.
- •Строение атома углерода в органических соединениях. Виды гибридизации. Классификация органических соединений.
- •Взаимное влияние атомов в молекулах органических соединений. Электронные эффекты. Индуктивный эффект.
- •Алканы. Гомологический ряд. Изомерия. Номенклатура. Конформации алканов.
- •Химические свойства алканов. Применение метана, этана, пропана, бутана, вазелинового масла, парафинов, вазелина, озокерита и др. Представителей алканов.
- •Алкены. Гомологический ряд. Строение двойной связи. Номенклатура. Изомерия: цис- и транс- изомерия.
- •Физические свойства алкенов. Методы получения: промышленные и лабораторные. Пиролиз алканов.
- •Алкены. Химические свойства. Правило Зайцева. Образование карбкатиона. Реакции электрофильного присоединения. Правило Марковникова.
- •Области применения олефинов в органическом и нефтехимическом синтезе. Полимеры. Реакции полимеризации, поликонденсации.
- •Получение полиэтилена, полипропилена, акрилонитрила, фторированного этилена, бутилена и др. Отдельные представители и их применение.
- •Алкадиены. Номенклатура. Строение бутадиена -1,3. Сопряженная система. Делокализация. Изомерия.
- •Физические свойства алкадиенов. Методы получения. Крекинг-процесс нефти и газа. Промышленное производство синтетического бутадиенового каучука по методу с.В. Лебедеву.
- •Алкины. Строение тройной связи. Номенклатура и изомерия.
- •Промышленные методы получения ацетилена и его гомологов на основе нефтегазового сырья. Высокотемпературный крекинг метана. Получение ацетилена из каменного угля.
- •Физические и химические свойства алкинов. Реакции электрофильного присоединения. Гидратация и изомеризация алкинов. Правило а.П. Эльтекова.
- •Галогенопроизводные углеводороды. Галогенопроизводные углеводороды. Определение и классификация. Номенклатура и изомерия.
- •Производные бензола с содержанием двух атомов галогена. Особенности строения. Способы получения.
- •Галогенопроизводные углеводороды. Способы получения: галогенирование алканов, циклоалканов, алкенов и алкинов, аренов.
- •Галогенопроизводные углеводороды. Физические свойства.
- •Галогенопроизводные углеводороды. Реакции элиминирования в галогеналканах: щелочное дегидрогалогенирование.
- •Реакции ароматических галогенопроизводных: гидролиз хлорбензола, галогенирование бромбензола. Нитрование хлорбензола, сульфирование бромбензола.
- •Физические свойства спиртов одноатомных спиртов. Образование водородных связей.
- •Реакции элиминирования одноатомных спиртов: внутримолекулярная дегидратация спиртов.
- •Реакции окисления одноатомных спиртов в альдегиды и кетоны. Промышленное каталитическое дегидрирование спиртов с образованием альдегидов и кетонов.
- •Двух- и трехатомные спирты. Получение гликолей из галогенпроизводных, гидроксилированием алкенов. Получение глицерина.
- •Двух- и трехатомные спирты. Межмолекулярная дегидратация этиленгликоля с получением диоксана (Метод а.Е. Фаворского).
- •Фенолы. Определение и классификация. Одноатомные, двухатомные, трехоатомные фенолы. Номенклатура и изомерия.
-
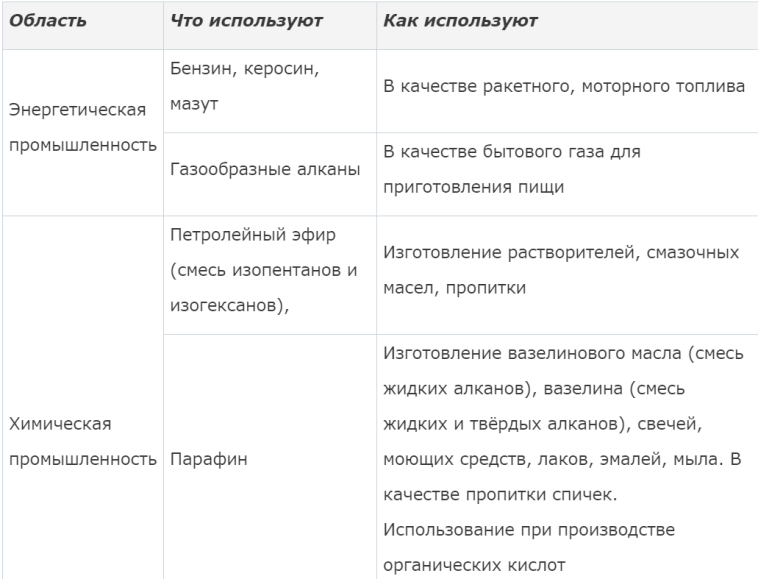
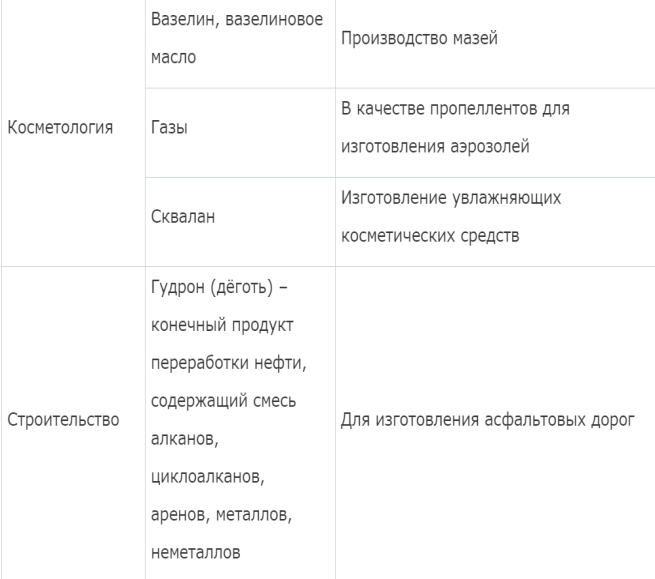
Химические свойства алканов. Применение метана, этана, пропана, бутана, вазелинового масла, парафинов, вазелина, озокерита и др. Представителей алканов.
 Алканы
выделяют из полезных ископаемых –
нефти, газа, каменного угля. На разных
этапах переработки получают бензин,
керосин, мазут. Алканы используются в
медицине, косметологии, строительстве.
Алканы
выделяют из полезных ископаемых –
нефти, газа, каменного угля. На разных
этапах переработки получают бензин,
керосин, мазут. Алканы используются в
медицине, косметологии, строительстве.
-
Алкены. Гомологический ряд. Строение двойной связи. Номенклатура. Изомерия: цис- и транс- изомерия.
Алкены (олефины, этиленовые углеводороды)– углеводороды, которые содержат в молекуле одну двойную связь. Общая формула – CnH2n.
Первый член ряда – этилен (этен) C2H4:
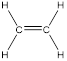
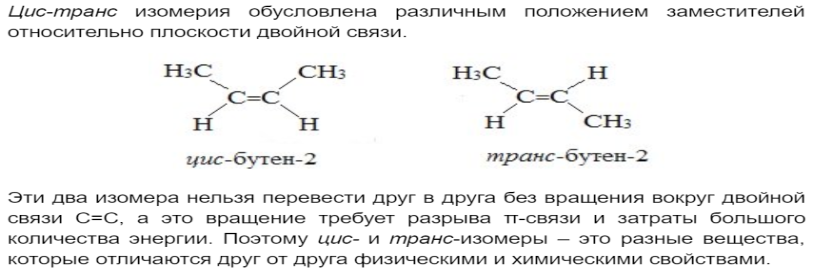
Двойную связь обозначают с помощью суффикса -ен. Основная цепь должна включать кратную связь. Нумерация цепи проводится с того конца, к которому ближе двойная связь.
CH3-CH2-CH2-CH=CH-CH3 гексен-2 (гексен-4)
![]() 2-этилпентен-1
2-этилпентен-1
Атомы углерода при двойной связи находятся в состоянии sp2-гибридизации. Двойная связь состоит из σ-связи, образованной sp2-гибридными орбиталями, и π-связи, возникающей за счет перекрывания p-орбиталей. Три σ-связи атома углерода направлены к вершинам треугольника с атомом С в центре, угол между связями 120о
-
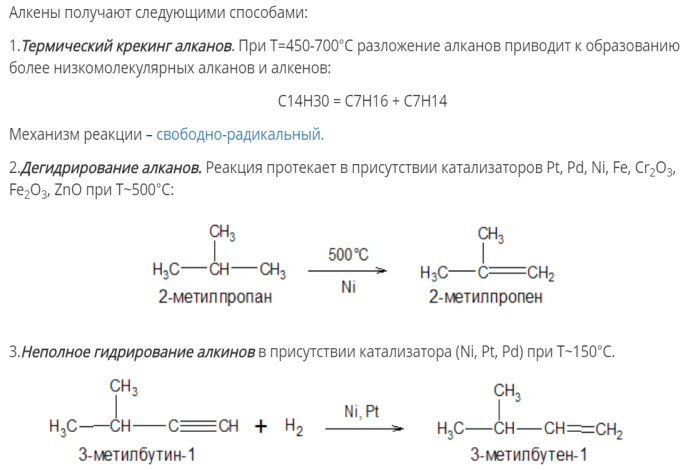
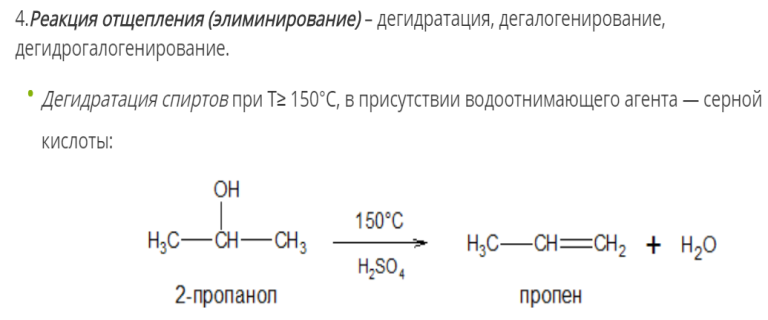
Физические свойства алкенов. Методы получения: промышленные и лабораторные. Пиролиз алканов.
Этен, пропен и бутен – газы. Алкены, содержащие от 5 до 18 атомов С в молекуле, – жидкости. Если атомов в молекуле алкена больше 19 – это твердые вещества.
Алкены бесцветны, нерастворимы в воде и легче ее, обладают характерным резким запахом.

-
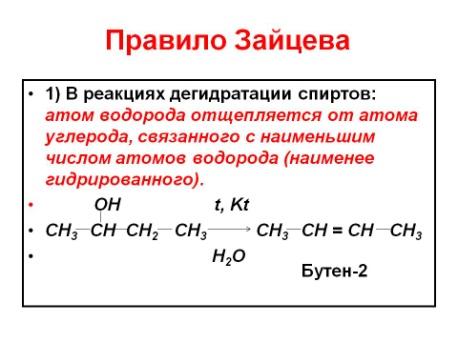
Алкены. Химические свойства. Правило Зайцева. Образование карбкатиона. Реакции электрофильного присоединения. Правило Марковникова.
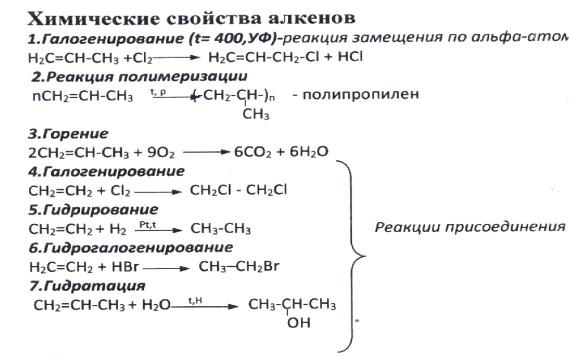 Алкены (олефины,
этиленовые углеводороды)– углеводороды,
которые содержат в молекуле одну двойную
связь. Общая формула – CnH2n.
Алкены (олефины,
этиленовые углеводороды)– углеводороды,
которые содержат в молекуле одну двойную
связь. Общая формула – CnH2n.
Первый член ряда – этилен (этен) C2H4: Двойную связь обозначают с помощью суффикса -ен. Основная цепь должна включать кратную связь. Нумерация цепи проводится с того конца, к которому ближе двойная связь.
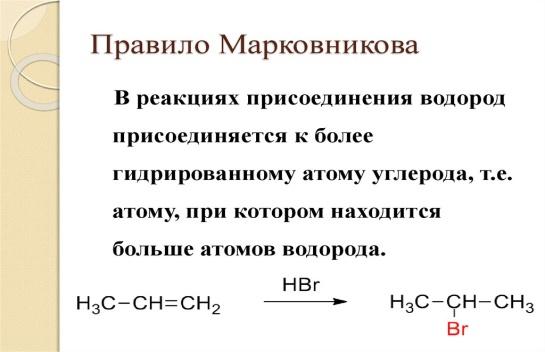 Карбокатионы
имеют положительный полный заряд (+I) на
атоме углерода, который находится в
гибридизированному состоянии. Поэтому
структура карбокатиона плоская и три
гибридные орбитали расположены в одной
плоскости под углами 120. Образование
карбкатиона 1)диссоциации связи C−X;
Гетеролитический распад по связи C−X,
как правило, является эндотермическим
процессом и происходит под действием
растворителя. Ионная диссоциация с
образованием карбкатиона может произойти
только в том случае, если как карбкатион,
так и анион X достаточно стабильны.
2)распада диазониевих солей (горячие
карбениеви ионы Для получения карбкатионов
по этому методу обычно исходят из
соответствующих первичных аминов,
проводя сначала диазотирование с
образованием диазокатионов, которые
самопроизвольно разлагаются с выделением
азота и катиона, последняя реакция
экзотермична.
Карбокатионы
имеют положительный полный заряд (+I) на
атоме углерода, который находится в
гибридизированному состоянии. Поэтому
структура карбокатиона плоская и три
гибридные орбитали расположены в одной
плоскости под углами 120. Образование
карбкатиона 1)диссоциации связи C−X;
Гетеролитический распад по связи C−X,
как правило, является эндотермическим
процессом и происходит под действием
растворителя. Ионная диссоциация с
образованием карбкатиона может произойти
только в том случае, если как карбкатион,
так и анион X достаточно стабильны.
2)распада диазониевих солей (горячие
карбениеви ионы Для получения карбкатионов
по этому методу обычно исходят из
соответствующих первичных аминов,
проводя сначала диазотирование с
образованием диазокатионов, которые
самопроизвольно разлагаются с выделением
азота и катиона, последняя реакция
экзотермична.
![]()
