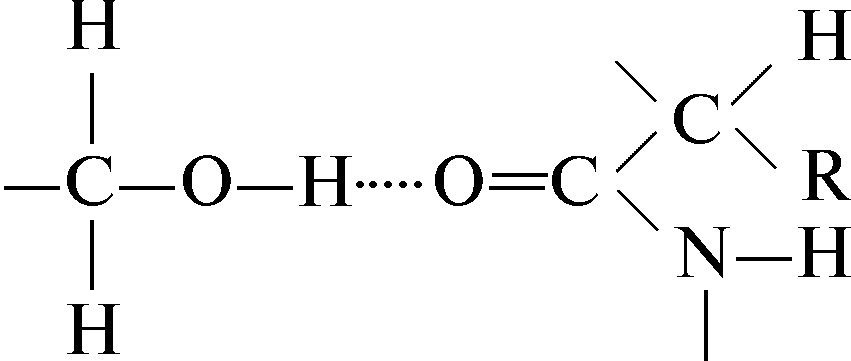- •3. Белковые вещества и их свойства
- •1. Определение
- •2. Локализация белков
- •3. Функции белков
- •4. Элементарный состав белков
- •5. Аминокислотный состав белков
- •5.1 Незаменимые амминокислоты
- •5.2 Биологически полноценная пища
- •6 Связи, участвующие в формировании молекулы белка
- •6.1 Пептидная связь
- •6.2 Дополнительные виды химической связи
- •6.2.1 Дисульфидная связь
- •6.2.2 Водородная связь
- •6.2.3 Солевая связь
- •6.2.4 Гидрофобное взаимодействие
- •7. Структура белковой молекулы
- •7.1 Форма белковой молекулы
- •7.2 Структура белка
- •8. Физико-химические свойства белков
- •8.1 Физические свойства
- •8.2 Денатурация белков
- •8.2.1 Факторы, вызывающие денатурацию
- •8.2.2 Значение денатурации в пищевой технологии
- •8.3 Изоэлектрическая точка
- •8.4 Гидрофильность белка
- •8.5 Высаливание белков
- •8.6 Набухание белков
- •9 Качественные реакции на белки
- •10 Классификация белков
6 Связи, участвующие в формировании молекулы белка
6.1 Пептидная связь
В составе белковой молекулы аминокислоты образуют неразветвленную цепь, в которой они связаны ковалентными пептидными связями:
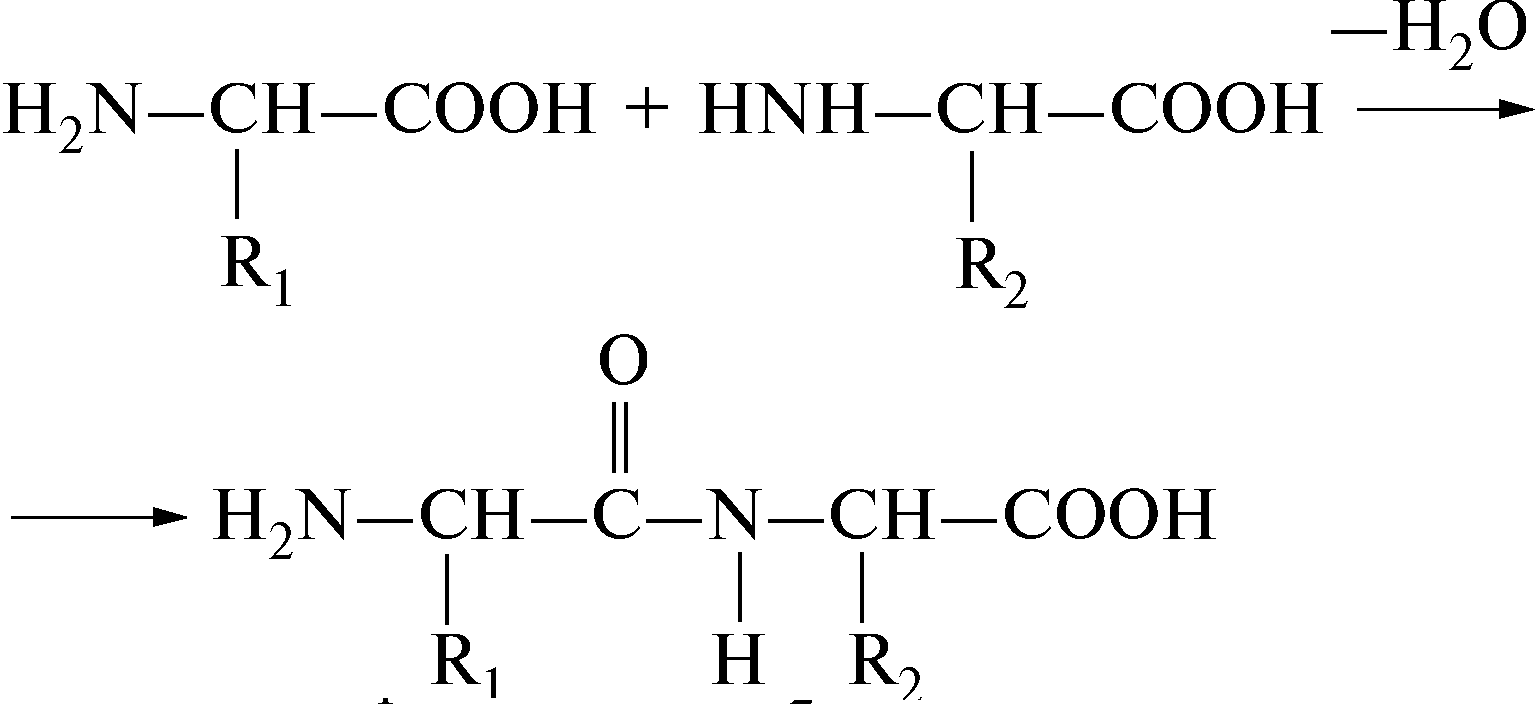
О![]() бразовавшееся
соединения, являющееся результатом
взаимодействия двух молекул аминокислот,
называется дипептидом, а связь
– пептидной.
бразовавшееся
соединения, являющееся результатом
взаимодействия двух молекул аминокислот,
называется дипептидом, а связь
– пептидной.
Свободная карбоксильная группа дипептида может соединяться с аминной группой еще одной молекулы какой-либо аминокислоты, в результате образуется трипептид. В случае соединения пептидными связями четырех остатков аминокислот получается тетрапептид, пяти – пентапептид и т.д. Общее название соединений, состоящих из нескольких аминокислот, - полипептиды – это и есть белки.
Многие из полипептидов встречаются в свободном виде в растениях, тканях животных и микроорганизмах и имеют большое значение в качестве промежуточных продуктов обмена веществ и физиологически весьма активных соединений. Примером может служить открытый выдающимся английским биохимиком Ф. Гопкинсом трипептид глютатион, состоящий из остатков гликокола, цистеина и глютаминовой кислоты:

Глютатион содержится во всех живых клетках. Его содержание особенно высоко в зародыше пшеничного зерна и дрожжах. Чрезвычайно важная роль глютатиона в обмене веществ заключается в том, что он является сильным восстановителем и очень легко подвергается окислению.
К числу полипептидов принадлежит ряд антибиотиков, образуемых микроорганизмами веществ, убивающих другие микроорганизмы или угнетающих их рост: грамицидин, тироцидин, лихениформин. Некоторые из этих антибиотиков широко применяются в медицине для борьбы с болезнетворными микробами.
Аминокислоты – это алфавит белковой молекулы: соединив их в различном порядке, можно получить бесконечное множество разнообразных белков.
6.2 Дополнительные виды химической связи
Все многообразие биохимических свойств природных белков обусловлено последовательностью соединения аминокислот с различными боковыми радикалами – R-группами в их полипептидной цепи.
Схематично боковые цепи полипептидов могут быть представлены следующим образом:

Различие химических свойств R-групп аминокислот ведет к появлению в структуре белковой молекулы химических связей различной прочности – дисульфидных, водородных, ионных связей и гидрофобных взаимодействий.
6.2.1 Дисульфидная связь
Пептидные цепочки аминокислот (в белке их может быть одна, две или несколько) могут быть сшиты внутри себя или между собой за счет образования ковалентной дисульфидной связи –S–S– между сульфгидрильными группами –SН, расположенными в полипептидной цепи цистеинов:
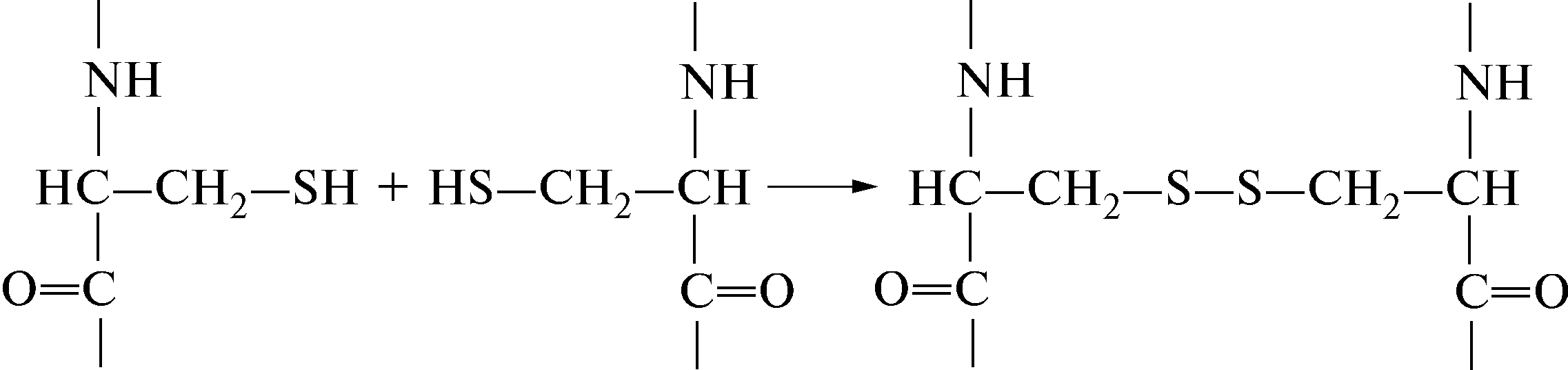
6.2.2 Водородная связь
Водородные связи возникают в результате дипольных взаимодействий между ковалентно связанным водородным атомом, имеющим положительный заряд, и отрицательно заряженным ковалентно связанным атомом – акцептором. Ниже приведены примеры различных водородных связей (обозначены пунктиром), образующихся в белках.
Водородная связь между пептидными группами:
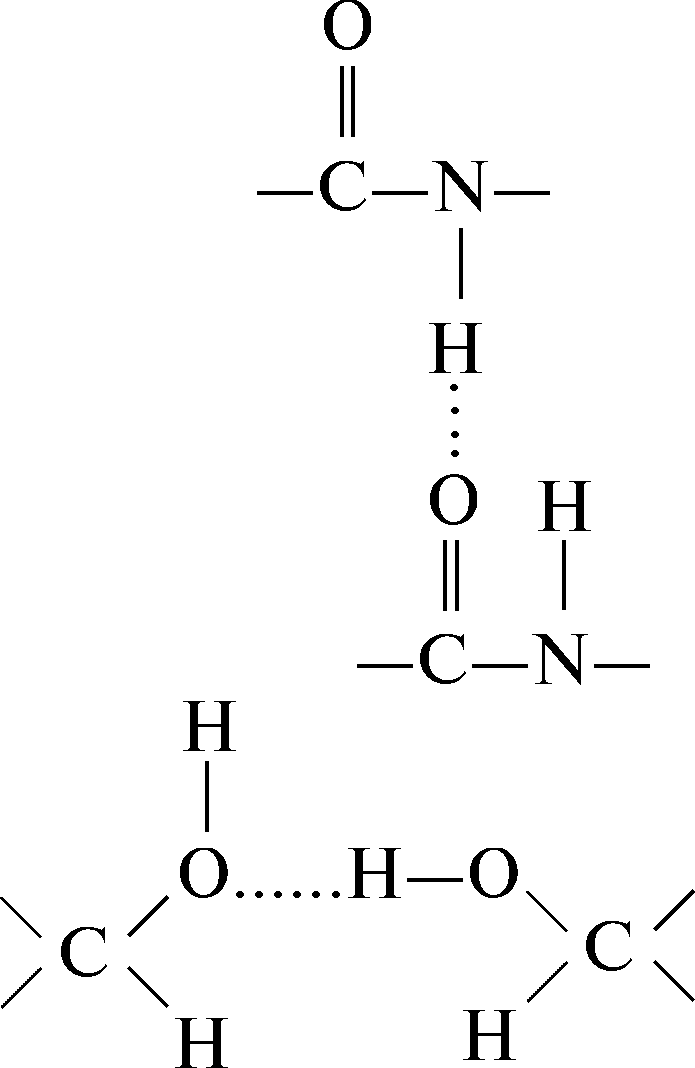
Водородная связь между двумя гидроксильными группами:
Водородная связь между заряженной карбоксильной группой и гидроксильной группой тирозина:

Водородная связь между заряженной аминной группой и заряженной карбоксильной группой:
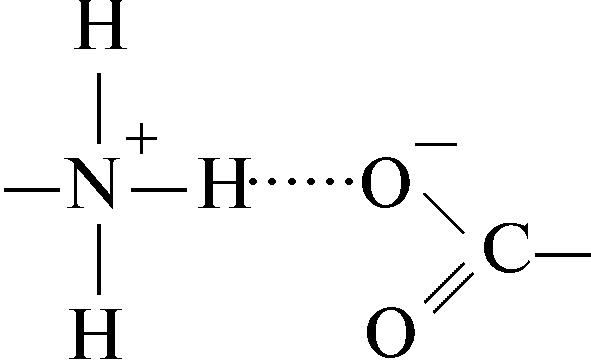
Водородная связь между гидроксильной группой серина и карбонильной пептидной связи: