
- •1.1.Электроды и гальванические элементы.
- •1.2.Измерение эдс гэ.
- •1.3.Потенциометрическое титрование.
- •1.4.Мембранные электроды.
- •Работа № 1 Определение активной и титруемой кислотности вина.
- •1.Приборы, посуда, реактивы.
- •Выполнение работы.
- •Ионометрический метод анализа
- •Работа № 2 Определение нитратов в экстрактах пищевого сырья
- •Кондуктометрия
- •Работа № 3 определение содержания кислоты в растворе Приборы и материалы
- •Выполнение работы.
- •Техника определения
- •Вопросы для самопроверки
- •Оптические методы анализа Спектральный анализ
- •Анализа вещества (спектрофотометра)
- •Работа № 4 Определение содержания хрома и марганца на стилоскопе
- •Выполнение работы
- •Отождествление спектральных линий с помощью дисперсионной кривой
- •Полуколичественный спектральный анализ
- •Количественный спектральный анализ Работа №5 Определение % содержания марганца в образце стали
- •Работа № 6 Определение содержания ионов натрия, калия и кальция пламенно-фотометрическим методом
- •Фотоэлектроколориметрический метод анализа
- •Построение градуированной кривой
- •Анализ вина
- •Люминесцентный анализ Флуориметрический метод
- •Работа № 8 определение витамина в2 (рибофламина) в драже или таблетках флуориметрическим методом.
- •Выполнение работы Построение градуировочной кривой Приготовление стандартных растворов
- •Расчет содержания рибофлавина в таблетках
- •Рефрактометрический анализ
- •Работа № 9 Определение сухих веществ в сахарном сиропе на рефрактометре
- •Выполнение работы
- •Построение градуировочной кривой
- •Хроматографический колличественный анализ
- •Работа № 10 Анализ смеси полисахарида и нитрата кобльта методом гельхроматографии
- •Выполнение работы
- •Гельхроматографическое разделение исследуемой смеси.
- •Спектрометрический анализ полисахарида на спектрофотометре
- •Вопросы для самопроверки:
- •Литература
- •Дополнительная литература:
Институт пищевых технологий – филиал
государственного бюджетного образовательного учреждения
высшего профессионального образования
«Нижегородский государственный инженерно-экономический институт»
Кафедра математических и естественнонаучных дисциплин
Физико-химические методы исследования
Лабораторный практикум для студентов
по специальности 100800
очной и заочной формы обучения 1 курса
Нижний Новгород2012
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
ПОТЕНЦИОМЕТРИЯ
Теоретическое введение
1.1.Электроды и гальванические элементы.
Различают прямую потенциометрию или ионометрию и потенциометрическое титрование. В обоих случаях аналитическим сигналом является величина электродвижущей силы (ЭДС) гальванического элемента (ГЭ), системы, в которой химическая энергия превращается в электрическую. В электролизере (в электролитической ванне) происходит обратный процесс превращения электрической энергии в химическую. Ионометричекий метод анализа основан на прямом измерении электродвижущей силы (ЭДС) в системе, зависящей от концентрации потенциалопределяющего иона и относится к потенциометрическим методом анализа. ГЭ состоит, как минимум, из двух соединенных электродов. Электродом называют совокупность двух (и более) контактирующих фаз с разной природой проводимости (электронной, ионной, дырочной и т.д.). При обозначении электрода участники электродной реакции перечисляют через запятую, фазы, на границе которых происходит скачок потенциала, отделяют вертикальной чертой, например: никелевый электрод (металлический никель, погруженный в раствор сульфата никеля) Ni2+|Ni или NiSO4|Ni. Иногда вертикальные линии внутри одного электрода опускают, например: окиснортутный электрод (металлическая ртуть, в контакте с оксидом, залита раствором щелочи) Hg, HgO, OH-.
В условной записи ГЭ справа располагают более положительный электрод, катод, на котором при необратимой работе ГЭ протекает реакция восстановления (+ē). Для ГЭ
- Zn|ZnCl2| |NiSO4|Ni + протекают реакции:
цинковый электрод никелевый электрод
на + катоде: Ni2+ + 2ē → Niº
на – аноде: Znº - 2ē → Zn2+
в ГЭ: Ni2+ +Znº → Niº + Zn2+
ЭДС ГЭ Е равна разности потенциалов φ на концах цепи
Е = φ+ - φ- = φкатода – φанода = φпр – φлев.
Измерить φ отдельного электрода не представляется возможным, поэтому относительный потенциал электрода приводят в справочнике как ЭДС ГЭ, составленного из данного электрода и другого, выбранного за начало отсчета, чаще стандартного водородного электрода. Стандартный электрод – электрод, активности участников реакции для которого равны единице.
1.2.Измерение эдс гэ.
Для расчета потенциала рабочего (индикаторного) электрода ЭДС ГЭ (Ех) измеряют в условиях, близких к равновесным, т.е. в условиях отсутствия тока в цепи. Это достигается использованием компенсационного метода (рис.1), при котором Ех компенсируется внешним источником Е при сопротивлении магазина сопротивлений Rх. Гальванометр Г показывает отсутствие тока. Переключателем К Ех сравнивают с ЭДС стандартного источника (например, элемента Вестона) Ест, для которого компенсация наблюдается при Rст.
Элемент Вестона.
Схема - Cd(Hg) | CdSO4 | Hg2SO4 | Hg +
12,5% нас.CdSO4·3/2H2O тв
Реакция Cd + Hg22+ ↔ 2Hg + Cd2+
ЭДС
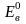 =
1,018В = 0,615 – (-0,403)
=
1,018В = 0,615 – (-0,403)
температурная зависимость Е = 1,018 – 4,06·10-5 (t - 20)
 CdSO4
· 3/2H2O
CdSO4
· 3/2H2O
Hg2SO4
Cd(Hg) Hg
– | | + токоподвод (Pt)
Из
равенства токов
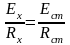 ,
откуда Ех=Ест·
,
откуда Ех=Ест·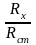 .
Выполнявшийся ранее вручную компенсационный
метод в современных приборах реализуется
автоматически.
.
Выполнявшийся ранее вручную компенсационный
метод в современных приборах реализуется
автоматически.
Равновесные условия (или близкие к ним) достигаются также при использовании потенциометров с высоким входным сопротивлением.
Е




 R
R
 Г
Г
Ест

К
Ех
Рис.1. Компенсационная схема
