
- •«Посттрансляционная модификация полипептидов»
- •Содержание
- •Введение
- •Основные виды модификаций:
- •Ограниченный протеолиз
- •Ограниченный протеолиз
- •Ковалентная модификация
- •Включение Кофакторов
- •Ассоциация в олигомеры
- •Биохимия: Учеб. Для вузов, Под ред. Е.С. Северина., 2003. 779 с.
- •Биохимия: Учебник для вузов/ в.П. Комов, в.Н. Шведова – м.:Дрофа, 2004. – 640 с.
Ассоциация в олигомеры
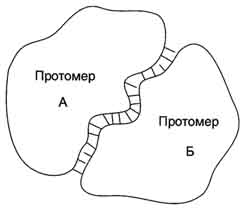
1. Многие белки имеют в своем составе несколько полипептидных цепей. Такие белки называют олигомерными, а отдельные цепи — протомерами. Протомеры в олигомерном белке соединены множеством слабых, нековалентных связей (гидрофобных, ионных, водородных).
Взаимодействие протомеров осуществляется благодаря комплементарности их контактирующих поверхностей.
Количество протомеров в белках может сильно варьировать: гемоглобин содержит 4 протомера.
2. Взаимодействие одного протомера с другими можно рассматривать как частный случай взаимодействия белка с лигандом. Каждый протомер служит лигандом для других протомеров.
3. Количество и порядок соединения протомеров в белке называется четвертичной структурой.
Особенности строения и функционирования олигомерных белков
1.Олигомерные белки могут содержать разное количество протомеров (например, димеры, тетра-меры, гексамеры и т. д.).
2. В состав олигомерных белков могут входить одинаковые или разные протомеры, например го-модимеры - белки содержащие 2 одинаковых протомера, гетеродимеры - белки, содержащие 2 разных протомера.
3. Различные по структуре протомеры могут связывать разные лиганды.
4. Взаимодействие одного протомера со специфическим лигандом вызывает конформационные изменения всего олигомерного белка и изменяет сродство других протомеров к лигандам. Это явление носит название кооперативных изменений конформации протомеров.
5. У олигомерных белков появляется новое по сравнению с одноцепочечными белками свойство — способность к аллостерической регуляции их функций.
Сборка протомеров в олигомерный белок. Комплементарность протомеров
"Узнавание" и присоединение отдельных протомеров олигомерного белка происходят благодаря формированию на их поверхности контактных участков. Последние состоят из радикалов аминокислот, собранных в данном месте в процессе образования третичной структуры белка. Совокупность этих радикалов формирует уникальные поверхности, способные с высокой специфичностью объединяться друг с другом.
Специфичность связывания контактных участков определяется их комплементарностью. Комплементарность - пространственное и химическое соответствие взаимодействующих поверхностей. Впадины и выступы на поверхности одной молекулы должны совпадать с выступами и впадинами на поверхности другой молекулы, как два куска неровно разорванной бумаги. Кроме того, функциональные группы радикалов аминокислот на одной контактирующей поверхности должны образовывать слабые химические связи с радикалами аминокислот на другой поверхности (рис. 1-21). В области контактных поверхностей обычно содержится много гидрофобных радикалов аминокислот, в результате объединения которых формируется гидрофобное ядро олигомерного белка. Гидрофильные радикалы могут образовывать водородные и ионные связи.
Таким образом, взаимодействие протомеров осуществляется во многих точках контактирующих поверхностей, с образованием десятков слабых связей. Благодаря этому контактные поверхности соединяются с высокой специфичностью, и ошибки формирования четвертичной структуры белков практически исключены.
Список источников
