
- •«Производственные процессы и оборудование объектов автоматизации» Введение
- •Часть 1
- •Технико-экономические показатели станков
- •Компоновка станка
- •Базовые детали и направляющие
- •Системы автоматического управления станками
- •Системы числового программного управления
- •Классификация систем чпу
- •Особенности конструкции и эксплуатации станков с чпу
- •Целевые механизмы Устройства для автоматической смены инструментов
- •Часть 2.
- •1. Теплообменные аппараты
- •Классификация теплообменных аппаратов
- •Конструкции аппаратов поверхностного типа
- •Аппараты со смешиванием теплоносителей (без разделительной стенки)
- •2. Выпарные установки Общие понятия о процессе выпаривания водных растворов
- •Классификация выпарных аппаратов и установок
- •Конструкции наиболее распространенных выпарных аппаратов с паровым обогревом
- •Сеперация вторичного пара в выпарных установках
- •Принципиальные схемы многокорпусных выпарных установок непрерывного действия
- •3. Дистилляционные и ректификационные установки
- •Основные физико-химические свойства бинарных смесей
- •Дистилляционные установки
- •4. Способы получения искусственного холода
- •Холодильные циклы и схемы установок
- •Абсорбционная холодильная машина
- •Пароэжекторные холодильные машины
3. Дистилляционные и ректификационные установки
Дистилляция и ректификация, называемые часто перегонкой, представляют собой такой термический процесс разделения жидких смесей на их составные части, в котором из кипящей смеси выделяются пары, содержащие те же компоненты, но в другой пропорции. Обычно в парах процент содержания легкокипящих компонентов, при данном давлении имеющих более низкую температуру кипения, больше, чем в самой жидкой смеси. Дистилляцией называют перегонку смеси с полной конденсацией полученных паров, а ректификацией – перегонку одной и той же смеси с многократными частичными конденсацией и сепарацией паров.
Дистилляционные и ректификационные установки получили широкое применение в пищевой, нефтяной и химической промышленности.
Путем перегонки жидких смесей выделяют, например, в чистом или концентрированном виде следующие продукты: этиловый спирт, бензол, уксусную кислоту, газы при крекинге, продукты переработки нефти – хлоропрен, нитротолуол, продукты хлорирования бензола, анилиновую воду, аммиак и многие другие продукты различных производств. При перегонке могут разделяться как многокомпонентные, так и бинарные (состоящие из двух компонентов) смеси. В нашем курсе рассматривается перегонка только бинарных смесей.
Основные физико-химические свойства бинарных смесей
При изучении процессов дистилляции и ректификации бинарные смеси можно разделить на три класса: смеси с практически взаимно нерастворимыми компонентами, смеси с компонентами, полностью растворимыми один в другом, и смеси с частично растворимыми компонентами.
Смеси со взаимно нерастворимыми компонентами. Примерами практически взаимно нерастворимых жидкостей могут служить ртуть и вода или вода и бензол.
Для кипящей смеси из взаимно нерастворимых компонентов применим закон Дальтона, согласно которому парциальное давление пара каждого компонента в паровой смеси равно давлению насыщенного пара чистого компонента при температуре кипящей смеси.
Рассмотрим смесь воды и бензола. Как
известно, вода при давлении 760 мм рт. ст.
кипит при 100оС, а бензол – при
80,4оС. Зависимость температуры
кипения воды от давления характеризуется
(рис.4-1,а) кривой А, а температуры кипения
бензола – кривой В. Складывая ординаты
кривых А и В, находим суммарную кривую
С.
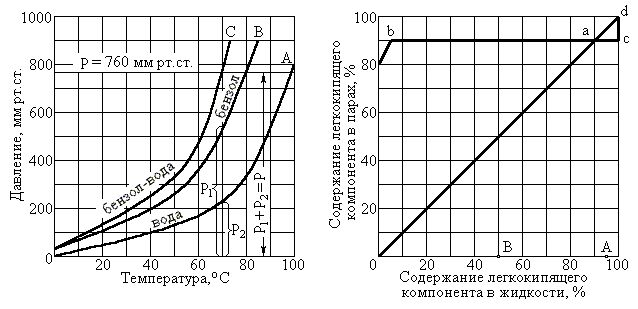
а) б)
Рис. 2-18. Графики давлений, температур и процентного состава для
взаимно нерастворимых компонентов бинарной смеси бензола и воды.
Так как согласно закону Дальтона давление паровой или газовой смеси равно сумме парциальных давлений ее компонентов, то кривая С показывает зависимость между давлением и температурой кипящей смеси бензол-вода. Пересечение кривой С с горизонталью, соответствующей 760 мм рт.ст., показывает, что при давлении 760 мм рт.ст. смесь кипит при температуре около 70оС, а также что парциальное давление паров воды в паровой смеси равно 225, а паров бензола – 535 мм рт.ст. независимо от содержания воды и бензола в жидкой смеси. Таким образом, смесь из двух взаимно нерастворимых жидкостей закипает при температуре более низкой, чем температура кипения легкокипящей жидкости, входящей в смесь. Пользуясь этим свойством, в технике применяют дистилляцию некоторых жидкостей с водяным паром. Как и перегонка под вакуумом, такой способ особенно пригоден для дистилляции жидкостей, точка кипения которых при атмосферном давлении настолько высока, что они при температуре кипения разлагаются.
При дистилляции с водяным паром двух- или многокомпонентная жидкость, подлежащая разгонке, смешивается с водой, смесь кипятится, а образующиеся пары конденсируются. После конденсации получается жидкая смесь одного из компонентов и воды, которая в большинстве случаев разделяется простым расслоением конденсата из-за разных удельных весов компонентов или механическими методами (отстаиванием, центрифугированием). Часто дистилляция с водяным паром применяется для отделения высококипящих веществ от нелетучих растворенных примесей.
В табл.1 приведены данные о понижении температуры кипения ряда веществ при перегонке с водяным паром при атмосферном давлении, а также содержание перегоняемого вещества в парах.
Таблица 1.
Название вещества |
Температура кипения, оС |
Содержание отгоняемого вещества в паре, % |
|
чистого вещества |
вещества с водяным паром |
||
Анилин |
189,9 |
98,4 |
23,1 |
Бензол |
80,4 |
69,2 |
91,1 |
Нафталин |
128,0 |
99,3 |
14,4 |
Нитробензол |
208,3 |
99,3 |
25,0 |
Ртуть |
356,8 |
100,0 |
0,4 |
Температура кипения смеси со взаимно нерастворимыми компонентами постоянна и не зависит от содержания компонентов в жидкой смеси. И только в тот момент, когда один компонент выкипит полностью, она делает скачок и становится равной температуре кипения оставшегося компонента. Содержание компонентов в паровой фазе остается постоянным и тоже не зависит от соотношения их в жидкой фазе до того момента, пока один компонент не выкипит полностью.
На рис.2-18,б изображен график для бинарной смеси со взаимно нерастворимыми компонентами. Зависимость содержания легкокипящего компонента (бензола) в парах от содержания его в жидкости изображается прямой bc. Пересечение этой прямой в точке «а» с диагональю 0d соответствует равновесному состоянию, когда содержание по весу легкокипящего компонента (бензола) в парах и жидкой фазе одинаково. Точка «а» называется азеотропической точкой, а жидкая смесь, соответствующая этому состоянию, азеотропической смесью. Температура кипения азеотропической смеси остается постоянной до полного выкипания смеси.
Азеотропические смеси характеризуются тем, что ни один компонент их не может быть выделен перегонкой в чистом виде, так как состав паров и жидкой смеси совершенно одинаков. Если летучего компонента в первоначальной жидкой смеси больше, чем в азеотропической смеси (точка А на рис.4-1,б), то после некоторой перегонки, во время которой из жидкости удаляются пары с составом азеотропической смеси (точка А смещается вправо), остается жидкий остаток из чистого летучего компонента (бензола в данном случае). Наоборот, если летучего компонента в первоначальной жидкой смеси меньше, чем азеотропической смеси (точка В на рис.4-1,б), то при перегонке точка В смещается влево и в жидкости остается нелетучий компонент (вода).
Бинарные смеси (растворы) со взаимно растворимыми компонентами. Растворы из полностью растворимых друг в друге жидкостей делятся на подчиняющиеся закону Рауля (идеальные) и имеющие положительное или отрицательное отклонение от закона Рауля (растворы с минимальной и максимальной температурами кипения).
Закон Рауля гласит, что парциальное давление пара каждого компонента в паровой смеси над кипящей при какой-либо температуре жидкой смесью равно давлению насыщенного пара этого компонента, кипящего в чистом виде при той же температуре, умноженному на молекулярную долю этого компонента в жидкой смеси.
Под молекулярной долей компонента подразумевается отношение числа молей его в смеси к суммарному числу молей обоих компонентов. Если в бинарной смеси вещество с молекулярным весом а находится в количестве а% по весу, а вещество с молекулярным весом в в количестве b%, то молекулярные доли компонентов смеси определяются по формулам:
 ;
;
 ,
,
причем ха + хb = 1.
Молекулярные доли можно выражать также в процентах. Число моль-процентов компонента получается умножением вышеприведенных формул на 100.
Математически закон Рауля можно выразить в следующем виде:
ра = Рах,
где ра – парциальное давление пара компонента «а» над кипящей смесью;
х – молекулярная доля этого компонента в жидкой смеси;
Ра –давление насыщенного пара компонента «а» при температуре кипения
смеси.
Аналогичное уравнение для компонента b:
pb = Pb (1-x) .
Если Р обозначает суммарное давление, то
Р = ра + рb = Pa x + Pb (1-x) .
На рис.2-19,а представлен графически закон Рауля для бинарной смеси. По оси ординат отложены упругости паров, а по оси абсцисс – состав смеси в моль-процентах. Начало координат соответствует содержанию в смеси 100 моль-процентов вещества В (нелетучего компонента) и, следовательно, нулю моль-процентов вещества А. Конечная точка оси абсцисс соответствует 100 моль-процентам летучего компонента А.
На основании приведенных формул следует, что парциальные давления паров обоих компонентов изображаются прямыми линиями. Суммарное давление тоже изображается прямой, проведенной через конечные точки прямых А и В.
Таким образом, при слиянии двух жидкостей, химически не действующих друг на друга и дающих однородный раствор, суммарное давление паров при изменении состава раствора изменяется монотонно по прямолинейному закону в зависимости от величины упругости пара одной жидкости, кипящей в чистом виде при той же температуре, до величины упругости пара второй жидкости в тех же условиях.
Графическое изображение связи между температурой кипения жидкой смеси, составом жидкости и составом получающихся паров при заданном давлении, называемое диаграммой кипения и конденсации, или фазовой диаграммой, приведено на рис.2-19,б. По оси ординат графика отложена температура смеси, а по оси абсцисс – молекулярные доли компонентов в жидкой и паровой фазах. Зависимость между температурой кипения жидкой смеси и ее составом изображается нижней линией, называемой кривой кипения. Состав получающихся паров в зависимости от температуры кипения изображается верхней пунктирной кривой. Так как в результате полной конденсации паров получается жидкая смесь того же состава, что и паровая, то эту кривую называют линией сухого пара или кривой конденсации. Из диаграммы ясно, что содержание легкокипящего компонента в парах больше, чем в жидкости (y x). Точки Е и С соответствуют температурам кипения чистых компонентов при заданном давлении.

Рис.2-19. Характерные зависимости для бинарных смесей,
подчиняющихся закону Рауля.
а– упругость паров над кипящей жидкостью в зависимости от состава;
б – диаграмма кипения и конденсации смеси (фазовая t-x-диаграмма);
в – диаграмма равновесия y = x.
Кривая равновесия для бинарной смеси (рис.2-19,в) иллюстрирует зависимость состава пара от состава жидкой смеси. Состав смеси обычно характеризуется содержанием в ней летучего компонента, поэтому по оси абсцисс откладывается содержание летучего компонента в жидкости х, а по оси ординат – в парах y. Величины х и y обычно выражаются в моль-процентах или в весовых процентах.
Для более летучего компонента «y» всегда больше «х», поэтому кривая равновесия смеси взаимно растворимых жидкостей располагается над диагональю квадрата, построенного на сторонах х =100 моль-процентам и y =100 моль-процентам. Отсюда следует, что для растворов, подчиняющихся закону Рауля, азеотропической точки не существует.
Жидкости, частично растворимые одна в другой. Для частично взаимо растворимых жидкостей содержание летучего компонента в парах вычисляется в две стадии. В пределах растворимости компонентов расчет ведут по закону Рауля или по экспериментальным таблицам, а во второй фазе (в пределах нерастворимости) – по закону Дальтона.
Примером частично растворимых жидкостей являются фенол и вода. При 20оС вода растворяет до 8,4% по весу фенола, а при 50оС растворимость его увеличивается до 12,08%. Фенол растворяет воду при 20оС в количестве до 27,76%, а при 50оС до 37,17% (проценты даны по отношению ко всей смеси).
Если по оси абсцисс отложить концентрацию воды и фенола, а по оси ординат – температуры, как это представлено на рис.2-20,б, то окажется, что кривые растворимости одного компонента в другом в действительности представляют собой одну кривую, проходящую через максимум в точке, соответствующей составу смеси с 39,9% фенола и 64,1% воды при температуре смеси 68,8оС.
На рис.2-20,а для иллюстрации дан график зависимости между составом жидкой частично растворимой смеси и давлением паровой смеси при постоянной температуре.
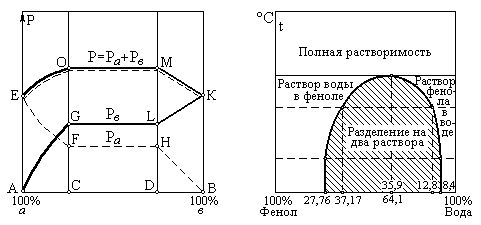 а)
б)
а)
б)
Рис.2-20. График зависимости растворимости и парциальных давлений
от состава частично растворимой бинарной смеси фенол-вода.
