
1 Введение
В 1944 г. в Казанском университете Г.К. Завойский проводил исследования парамагнитной релаксации на высоких частотах (108гц). Поместив парамагнитные соли (CuSO4 5H2О, MnCl2 и др.) в постоянное магнитное поле и облучая их электромагнитным потоком, он заметил интенсивное резонансное поглощение электромагнитного потока парамагнитными солями при строго определенных отношениях напряженности постоянного магнитного поля к (Н) частоте радиоволн (). Так было открыто новое физическое явление, широко известное теперь под названием электронного парамагнитного резонанса (ЭПР). В первые годы после открытия метод ЭПР применялся в основном физиками для решения частных физических задач. С начала пятидесятых годов началось бурное применение метода ЭПР к решению химических задач. Это связано с тем, что для современной химии имеет чрезвычайно большое значение выяснение структуры и химических свойств парамагнитных частиц, принимающих участие в сложных химических реакциях. Это, с одной стороны, парамагнитные ионы металлов переходных групп периодической системы, являющиеся активными центрами огромного числа различных гетерогенных катализаторов и входящие в состав различных комплексных соединений, определяющих активность сложных органических катализаторов, в том числе большинства биологических ферментов. С другой стороны, детальное исследование огромного числа сложных химических процессов в газовой и жидкой фазах, в том числе фотохимических, радиационно-химических и биохимических реакций, привело к представлению о чрезвычайно большой распространённости в химии свободно-радикальных и цепных механизмов. К достоинствам метода ЭПР спектроскопии можно отнести, во-первых, уникальную информативность, благодаря которой из спектров ЭПР можно извлечь корректную информацию о пространственной и электронной структурах парамагнитных молекул. Современные ЭПР спектрометры, которые работают при гораздо более высоких частотах, в области сверхвысоких частот (СВЧ): в Х-диапазоне (9Ггц, 1Ггц=109гц) или в Q-диапазоне (35Ггц). Поскольку чувствительность спектрометров значительно зависит от частоты электромаг-нитного потока и возрастает в раз, использование СВЧ радиоволнового диапазона позволяет исследовать даже незначительное количество парамагнитных примесей в образцах. Это достоинство становится особенно ценным при исследовании парамагнитных молекул, атомов или ионов металлов, время жизни которых очень незначительно. Например, ЭПР спектрометр фирмы “Радиопан“ (Х-диапазон частот), эксплуатируемый на кафедре физической и коллоидной химии ЮФУ, позволяет исследовать 1014 парамагнитных молекул, а это меньше чем 10-8% молекулярной массы образца. В третьих, метод ЭПР позволяет проводить исследования при самых различных экспериментальных условиях: широкий диапазон температур и давлений, электрохимические, фотохимические, адсорбционные процессы и т.д., что очень важно, например, для моделироваия и исследования химических процессов при их реальных условиях (высокотемпературный крекинг углеводородов, фотокаталитические свойства хлорофилла и т.д.
2 Электронный эффект Зеемана
2.1 Атом водорода в магнитном поле
Метод ЭПР спектроскопии основан на известном электронном эффекте Зеемана, заключающемся в том, что при введении одного электрона (S=1/2) в постоянное магнитное поле, энергетический уровень S расщепляется на 2S+1 подуровней отделенных друг от друга интервалами энергии, равными:
E=g, (1)
где H-напряжённость магнитного поля, измеряется в эрстедах (Э);
-константа-магнетон Бора.
Параметр g – важнейшая характеристика в ЭПР спектроскопии, поскольку его
величина зависит от пространственной и электронной структуры парамагнитной молекулы. Для электрона, который движется не по атомной орбите или молекулярной орбитали, а, например, по прямолинейной траектории (т.е. не наблюдается орбитальное движение) g=gе=2.00232. gе- Константа, но на практике величина g не равна gе, поскольку в парамагнитных соединениях неспаренный электрон движется или по молекулярной орбитали (в молекулах) или по атомной орбите (в атомах или ионах металлов).
Рассмотрим простой и в тоже время наиболее распространенный в химии случай S=1/2 (органические радикалы, низкоспиновые комплексы с одним неспаренным электроном). В качестве объекта исследования выберем атом водорода (рисунок 1), в котором неспаренный электрон движется по 1s атомной орбите (АО), имеющей сферическую форму.
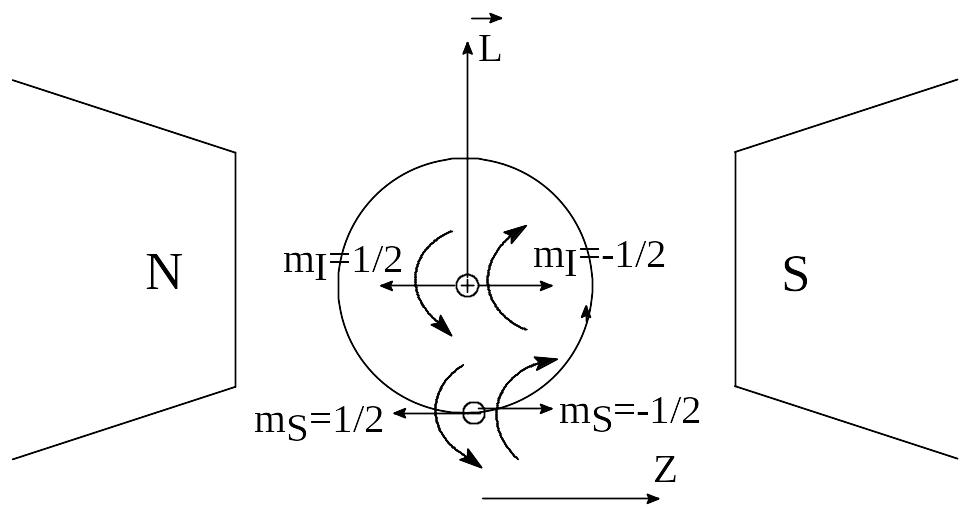
Рисунок 1 – Ориентации угловых моментов электрона и протона в магнитном
поле
Там, где происходит движение заряженной частицы, всегда возникает орбитальный магнитный момент и вектор этого орбитального момента Lz направлен перпендикулярно к плоскости, в которой наблюдается движение электрона по окружности. Можно смоделировать этот процесс, пустив по витку медной проволоки постоянный электрический ток. Поток электронов, двигаясь по проволоке будет наводить магнитный момент, который можно легко зафиксировать с помощью магнитной стрелки компаса. Поскольку 1s АО имеет сферическую форму, вращение электрона происходит в любых плоскостях. Помимо орбитального движения электрона по 1s АО, у электрона наблюдается также так называемое спиновое вращение вокруг себя. И вращение электрона вокруг себя (спиновое движение) приводит к появлению спинового углового момента, который гораздо меньше по величине чем орбитальный угловой момент этого электрона. Очень важно, что направление спинового углового момента электрона в постоянном магнитном поле не будет произвольным из-за взаимодействия спинового момента электрона и постоянного магнитного поля. В результате этого взаимодействия возможны две противоположно направленные ориентации спинового момента электрона вдоль силовых линий магнитного поля. Разумеется, энергия электрона будет зависеть от того, как у него ориентирован спиновый угловой момент: по магнитному полю или против направления. В постоянном магнитном поле благодаря эффекту Зеемана происходит расщепление энергетического уровня электрона на два Зеемановские уровня с магнитными квантовыми числами mS=+1/2, -1/2. Только что мы ввели новое квантовое число – магнитное квантовое число mS, которое позволяет вычислить проекции спинового углового момента MSZ неспаренного электрона на ось Z в магнитном поле (направление оси Z совпадает с направлением силовых линий постоянного магнитного поля):
MSZ=mSh/2
где h - постоянная Планка.
В общем случае, если парамагнитная молекула, атом или металла содержит n неспаренных электронов то S=n/2, а mS принимает значения от –S до S+ (через единицу), т.е. всего возможно M=2S+1 проекций спинового углового момента неспаренных электронов на ось Z. В нашем случае S=1/2 (низкоспиновое состояние), а mS=-1/2,+1/2 и M=2. Новая характеристика электронного эффекта Зеемана – число М называется мультиплетностью, оно указывает на количество
возможных проекций спиновых угловых моментов на ось Z. Каждое спиновое состояние S можно охарактеризовать мультиплетностью М, которое имеет свое соответствующее название: М=1 (синглетное состояние), М=2 (дублетное состояние), М=3 (триплетное состояние), М=4 (квартетное состояние), М=5 (квинтетное состояние) и т.д.
