
- •II. Окислительно-восстановительные реакции
- •1.Значение окислительно-восстановительных реакций (овр)
- •1. Замещение s
- •2. Присоединение а
- •III. Характерные реакции основных классов органических соединений
- •2 . Свойства основных классов органических соединений Алканы и циклоалканы sr,
- •1. Инициирование цепи
- •2. Рост цепи
- •3. Обрыв цепи
- •Дегидрогеназное окисление
- •Алкены и малые циклоалканы, ае
- •Правило Марковникова
- •Окислительно восстановительные и качественные реакции алкенов
- •Ароматические соединения se
- •Спирты, простые эфиры, тиолы, сульфиды, амины, sn,e
- •Карбонильные соединения альдегиды и кетоны, an
- •Карбоновые кислоты, их функциональные производные, sn
- •Строение карбоксильной группы
- •Важнейшие функциональные производные карбоновых кислот
- •Реакции нуклеофильного замещения sn карбоновых кислот и их функциональных производных
- •Этерификация,sn
- •2. Образование тиоэфиров с тиолами
- •3. Образование амидов с аминами или n-ацилирование, sn
ГБОУ ВПО
Ярославская государственная медицинская академия Минздравсоцразвития РФ
Кафедра биологической и общей химии
Лекция 10. Химические свойства моно- и полифункциональных соединений
1.Реакционная способность органических соединений
I. Кислотно-основные свойства органических соединений
Кислотно-основные свойства органических соединений рассматриваются на основе протолитической теории кислот и оснований Брёнстеда –Лоури и проявляются в кислотно-основном взаимодействии. Кислоты Брёнстеда – доноры протона R–ХH всегда содержат кислотный центр –XH (ОН, -NH, -SH, -CH). Различают ОН – кислоты (карбоновые кислоты, спирты, фенолы), NH- кислоты (амины, амиды), SH-кислоты (тиолы). Основания Брёнстеда - акцепторы протона. Основания делятся на n-основания, если основным центром является гетероатом (атом неметалла), который содержит неподеленную электронную пару (кислород, азот, сера), и p-основания, если основным центром является p- связь между углеродами. Основные центры: N, O, S, p-связь.
Большинство органических соединений могут проявлять свойства как кислот, так и оснований (быть и донорами и акцепторами протона). Какую роль данное соединение будет выполнять, зависит от второго реагента, так как кислота проявляет свои свойства только в присутствии сильного основания и наоборот. Согласно законам термодинамики каждая частица самопроизвольно стремится перейти в более устойчивое состояние и уменьшить тем самым энтальпию системы. Так, сильная кислота является неустойчивой и легко отдает протон основанию. Сильное основание легко присоединяет протон отрывая его от кислоты. Данные процессы идут самопроизвольно, так как сопровождаются уменьшением свободной энергии (G0). Поэтому в реакциях важно определить сравнительную силу кислот или оснований, так как это определяет самопроизвольное протекание кислотно-основного взаимодействия.
Сила кислоты определяется стабильностью сопряженного с ней основания (аниона). Чем стабильнее анион, тем сильнее кислота, а стабильность аниона зависит от степени делокализации электронной плотности (энтропийный фактор). Поэтому усиливают кислотность:
сопряжение с кислотным центром
большой радиус атома в кислотном центре
высокая электроотрицательность атома в кислотном центре
электроноакцепторные заместители в молекуле кислоты
Сравнительная сила кислот: карбоновые кислоты> фенолы > тиолы многоатомные спирты> одноатомные спирты > амины
1.Наиболее сильные кислоты (карбоновые кислоты, фенолы, тиолы) взаимодействуют со щелочами с образованием соли.
2. Средние по силе кислоты многоатомные спирты взаимодействуют с гидорксидом меди (II), с образованием хелатного комплекса.
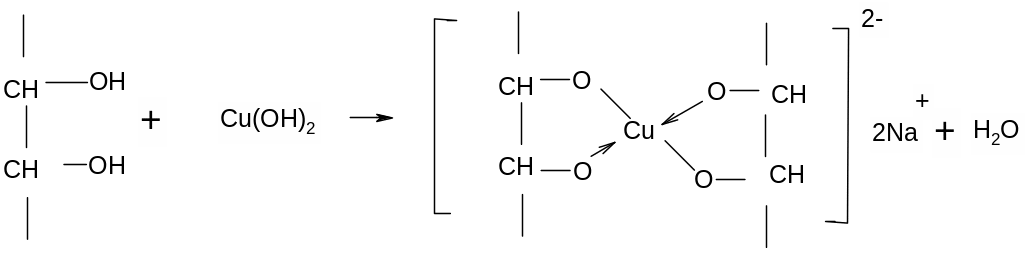
3. Слабые кислоты одноатомные спирты взаимодействуют только со щелочными металлами.
Сила оснований определяется степенью локализации электронной плотности на основном центре, следовательно, все факторы, усиливающие кислотность будут в той же мере снижать силу оснований.
Сравнительная сила основных центров:
N> O>S>p -связь
Сопряжение с основным центром максимально ослабляет основность. Электронодоноры усиливают основность.
Примеры:
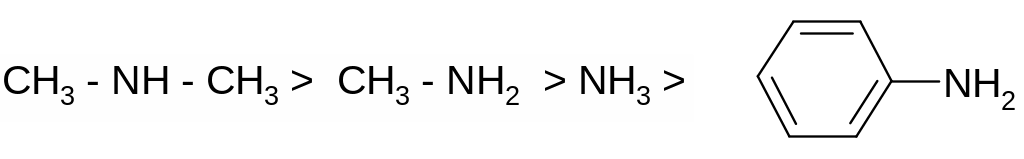
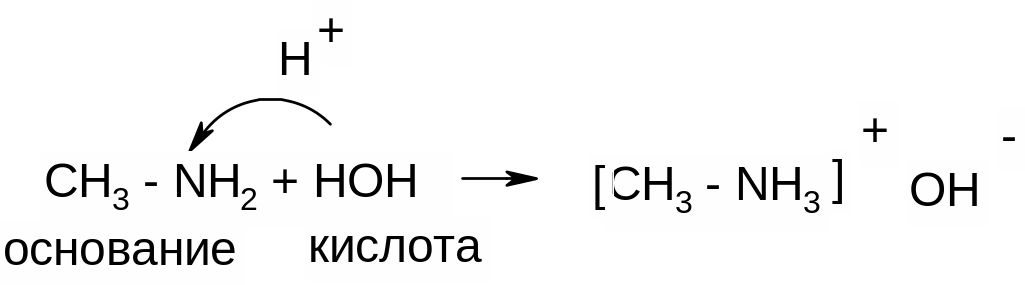
Доказательство основных свойств аминов
II. Окислительно-восстановительные реакции
Окислительно-восстановительными реакциями (ОВР) называют химические реакции, протекающие с изменением степени окисления атомов вследствие переноса электрона от одной частицы к другой.
1.Значение окислительно-восстановительных реакций (овр)
ОВР – основа существования живых систем, снижающих энтропию за счет получения энергии из окружающей среды. Основная часть энергии поступает в организм в процессе питания. Органические соединения пищи окисляются (экзэргонические реакции) и организм получает энергию для эндэргонических реакций синтеза, снижающих энтропию
Окисление – процесс отдачи электронов, восстановление процесс присоединения электронов. Пара соединений, между которыми идет перераспределение электронов называется ред-окс парой.. ОВР самопроизвольно протекают в сторону превращения сильного окислителя (термодинамически менее стабильное соединение) в слабый восстановитель (термодинамически более стабильное соединение) или сильного восстановителя в слабый окислитель. В любом случае этот процесс самопроизвольный, так как сопровождается уменьшением свободной энергии (G0). Количественной мерой окислительно-восстановительной способности является величина восстановительного (редокс -) потенциала j Чем выше восстановительный (редокс) потенциал j, тем сильнее окислительные свойства редокс- пары, чем он ниже, тем сильнее восстановительные свойства редокс- пары. (См. Электрохимический ряд напряжения металлов). Потому процесс передачи электронов всегда идет от реагента с меньшим j к реагенту с большим j. Способов измерить абсолютную величину редокс-потенциала нет, поэтому его измеряют относительно эталонной пары 2Н+/Н20 потенциал которой, в стандартных условиях, принят равным нулю j 0 =0В. Стандартный окислительно-восстановительный потенциал (стандартный восстановительный потенциал или редокс-потенциал) 0, рассчитан, как э.д.с. в вольтах в гальваническом элементе со стандартным водородным электродом (2Н+/Н2). Границы значений j 0 от -3,05В (литий) до +2,84В (фтор). В организмах, где рН =7 определяют «нормальный восстановительный потенциал j0¢». Он отличается от стандартного, так для пары 2Н+/Н2 j 0¢ = -0,42В.
Виды биохимических окислительно-восстановительных процессов
А. дегидрогеназная ОВР. Это наиболее распространенный тип ОВР органических соединений. Реакции окисления большинства органических соединений связаны не с уменьшением количества атомов водорода в молекуле, при этом степень окисления углерода повышается. Реакции восстановления – с увеличением атомов водорода.
СН3 – ОН = Н2С=О
спирт альдегид
Б. ОВР, связанная с изменением содержания атомов кислорода в молекуле называют оксигеназная ОВР
Н2С=О + [O] = НСООН
альдегид карбоновая к-та
В. Свободнорадикальное окисление-восстановление идет по цепному механизму и не контролируется ферментами.
III. Характерные реакции органических соединений Основные понятия
Субстрат – вещество, у которого происходит разрыв связи у атома углерода. Определяет тип реакции.
Реагент – вещество (частица), атакующая субстрат (радикал, электрофил, нуклеофил). Определяет механизм реакции.
Образование реагентов
А. Гомолиз, образование радикалов
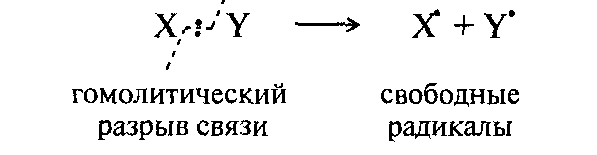
R- Радикал (свободный радикал) это частица с неспаренным электроном, образуется в результате гомолитического разрыва связи:
Н· СН3· Сl·
Радикал определяет радикальный (цепной) механизм реакции.
II. Характерные реакции органических соединений Основные понятия
Субстрат – вещество, у которого происходит разрыв связи у атома углерода. Определяет тип реакции.
Реагент – вещество (частица), атакующая субстрат (радикал, электрофил, нуклеофил). Определяет механизм реакции.
Образование реагентов
А. радикалы
R- Радикал (свободный радикал) это частица с неспаренным электроном, образуется в результате гомолитического разрыва связи:
Н· СН3· Сl·
Радикал определяет радикальный (цепной) механизм реакции.
Б. нуклеофилы и электрофилы
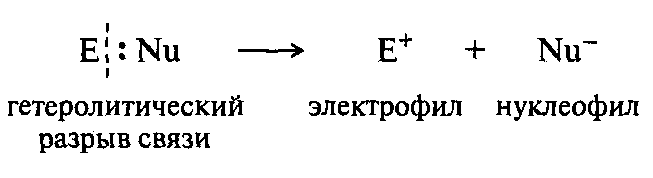
Нуклеофильные реагенты имеют целый или частичный отрицательный заряд, содержат атом с неподеленной электронной парой или -связь: ОН-, NH3, H2O, CH3OH. Электрофильные реагенты несут целый или частичный положительный заряд: Н+, SO3.
Типы реакций
