
- •Волновая и квантовая оптика. Атомная и ядерная физика.
- •Воронеж
- •Оглавление
- •Предисловие
- •Введение
- •I. Геометрическая оптика
- •II. Волновая оптика Когерентность и монохроматичность световых волн
- •Интерференция света
- •Расчет интерференционной картины от двух когерентных источников
- •Дифракция света. Принцип Гюйгенса-Френеля
- •Метод зон Френеля
- •Дифракция в параллельных лучах на одной щели
- •Дифракция на дифракционной решетке
- •Дифракция рентгеновских волн на пространственной кристаллической решетке. Формула Вульфа-Брэгга
- •Дисперсия света
- •Электронная теория дисперсии света
- •Поляризация света. Естественный и поляризованный свет
- •Закон Малюса
- •Поляризация при отражении и преломлении. Закон Брюстера
- •Двойное лучепреломление
- •III. Квантовая оптика Тепловое излучение и его характеристики
- •Закон Кирхгофа
- •Закон Стефана-Больцмана
- •Распределение энергии в спектре излучения абсолютно черного тела . Закон смещения Вина
- •Формула Рэлея-Джинса
- •Формула Планка
- •Внешний фотоэффект и его законы
- •Уравнение Эйнштейна
- •Давление света
- •IV. Элементы квантовой механики Гипотеза де Бройля
- •Соотношение неопределенностей
- •Волновое уравнение Шредингера
- •Волновая функция (X, y, z, t)
- •Уравнение Шредингера для стационарных состояний
- •Уравнение Шредингера для микрочастицы в одномерной прямоугольной потенциальной яме
- •V. Атомная физика Теория атома Бора. Постулаты Бора
- •Квантовые числа
- •Спин электрона
- •Принцип Паули
- •VI. Физика твердого тела Классическая и квантовая статистики
- •Статистика Бозе - Эйнштейна
- •Статистика Ферми - Дирака
- •Энергетические зоны в кристаллах. Классификация твердых тел по зонной теории
- •Полупроводники. Собственная и примесная проводимость полупроводников
- •Контакт электронного и дырочного полупроводников
- •Полупроводниковый диод и его вольт - амперная характеристика (вах)
- •VII. Элементы физики атомного ядра и элементарных частиц Состав и характеристики атомного ядра
- •Спин ядра
- •Ядерные силы
- •Энергия связи ядра. Дефект массы
- •Радиоактивность
- •Ядерные реакции
- •Реакция деления ядер. Цепная реакция
- •Реакция синтеза атомных ядер
- •Классификация элементарных частиц по типу взаимодействия между ними
- •Вопросы для самоподготовки
- •Библиографический список
V. Атомная физика Теория атома Бора. Постулаты Бора
Резерфорд предложил
ядерную модель атома: вокруг положительно
заряженного ядра, имеющего заряд
![]() (
(![]() – порядковый номер элемента), по замкнутым
орбитам движутся электроны, образуя
электронную оболочку атома. Кулоновская
сила взаимодействия сообщает электрону
центростремительное ускорение. Второй
закон Ньютона для электрона, движущегося
по окружности:
– порядковый номер элемента), по замкнутым
орбитам движутся электроны, образуя
электронную оболочку атома. Кулоновская
сила взаимодействия сообщает электрону
центростремительное ускорение. Второй
закон Ньютона для электрона, движущегося
по окружности:
![]() ,
где
,
где
![]() и
– масса и скорость электрона на орбите
радиуса
и
– масса и скорость электрона на орбите
радиуса
![]() .
Недостаток уравнения в том, что оно
содержит два неизвестных
и
.
Следовательно, существует бесчисленное
множество значений радиусов и скоростей,
а значит и энергий, которая может меняться
непрерывно, и следовательно, испускаться
любая порция энергии. Этому противоречит
линейчатый спектр излучения атомов.
Попытки построить теорию атома в рамках
классической физики не привели к успеху.
Первая попытка построить новую квантовую
теорию атома была предложена Бором. В
основу теории Бор положил два постулата:
.
Недостаток уравнения в том, что оно
содержит два неизвестных
и
.
Следовательно, существует бесчисленное
множество значений радиусов и скоростей,
а значит и энергий, которая может меняться
непрерывно, и следовательно, испускаться
любая порция энергии. Этому противоречит
линейчатый спектр излучения атомов.
Попытки построить теорию атома в рамках
классической физики не привели к успеху.
Первая попытка построить новую квантовую
теорию атома была предложена Бором. В
основу теории Бор положил два постулата:
I
постулат (постулат стационарных
состояний). В атоме существуют стационарные
(не изменяющиеся во времени) состояния,
в которых он не излучает энергии.
Стационарным состояниям соответствуют
стационарные орбиты, по которым движутся
электроны. Движение электронов по ним
не сопровождается излучением
электромагнитных волн. В стационарном
состоянии атома электрон должен иметь
дискретные квантовые значения момента
импульса, удовлетворяющие условию:
![]() .
.
II
постулат (правило частот). При переходе
электрона с одной стационарной орбиты
на другую излучается или поглощается
один фотон с энергией
![]() ,
равной разности энергий соответствующих
стационарных состояний.
,
равной разности энергий соответствующих
стационарных состояний.
![]() – энергии электрона на соответствующих
орбитах. Решая совместно уравнение
Резерфорда с условием первого постулата
Бора, найдем радиус стационарной орбиты
электрона
– энергии электрона на соответствующих
орбитах. Решая совместно уравнение
Резерфорда с условием первого постулата
Бора, найдем радиус стационарной орбиты
электрона
![]() ,
тогда энергия электрона на
-ой
стационарной орбите:
,
тогда энергия электрона на
-ой
стационарной орбите:
![]() .
Полученные энергетические состояния
атома образуют последовательность
энергетических уровней, изменяющихся
в зависимости от значения
,
где
– главное квантовое число. Состояние
атома для значения главного квантового
числа
называется основным или нормальным
состоянием; если
>
1 – состояния называются возбужденными.
.
Полученные энергетические состояния
атома образуют последовательность
энергетических уровней, изменяющихся
в зависимости от значения
,
где
– главное квантовое число. Состояние
атома для значения главного квантового
числа
называется основным или нормальным
состоянием; если
>
1 – состояния называются возбужденными.
В квантовой механике
состояние электрона в атоме водорода
(![]() )
описывается волновой функцией
)
описывается волновой функцией
![]() ,
удовлетворяющей стационарному уравнению
Шредингера:
,
удовлетворяющей стационарному уравнению
Шредингера:
![]() .
.
Потенциальная
энергия взаимодействия электрона с
ядром
![]() ,
тогда
,
тогда
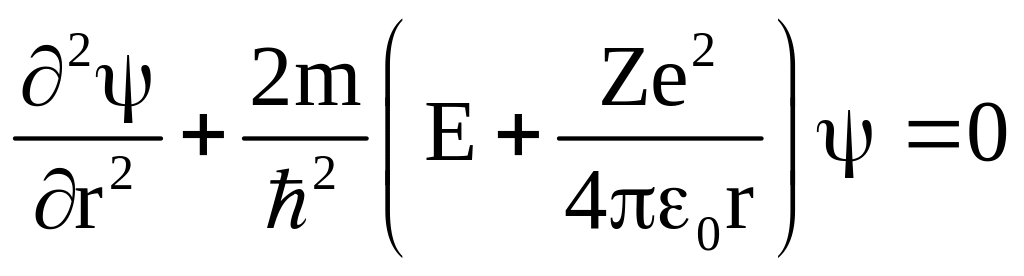 .
Решение этого уравнения позволяет найти
собственные значения энергии электрона:
.
Решение этого уравнения позволяет найти
собственные значения энергии электрона:
![]() .
.
Энергия принимает дискретные отрицательные значения. Выражение для совпадает с формулой, полученной Бором для энергии электрона в атоме водорода, однако, если Бору пришлось вводить дополнительные гипотезы (постулаты), то в квантовой механике дискретные значения энергии вытекают непосредственно из решения уравнения Шредингера.
Квантовые числа
Квантовые числа – это целые или полу целые числа, определяющие возможные дискретные значения физических величин системы, подчиняющиеся квантовым законам.
Главное квантовое
число
,
определяет энергетические уровни
электрона в атоме,
Электроны со значениями энергии,
соответствующими главному квантовому
числу
образуют К-оболочку; со значениями
![]() – L-оболочку,
– L-оболочку,
![]() – М-оболочку, и т.д.
– М-оболочку, и т.д.
Из решения уравнения
Шредингера вытекает, что механический
орбитальный момент импульса электрона
квантуется, принимая дискретные значения,
определяемые формулой
![]() ,
где
– орбитальное квантовое число. Оно
определяет форму орбиты и принимает
значения
,
где
– орбитальное квантовое число. Оно
определяет форму орбиты и принимает
значения
![]() ,
т.е. всего
значений. Например, при
,
т.е. всего
значений. Например, при
![]() ,
,
![]() Если
Если
![]() – это s-электрон,
при
– это s-электрон,
при
![]() – р-электрон, при
– р-электрон, при
![]() – d-электрон,
и т.д.
– d-электрон,
и т.д.
И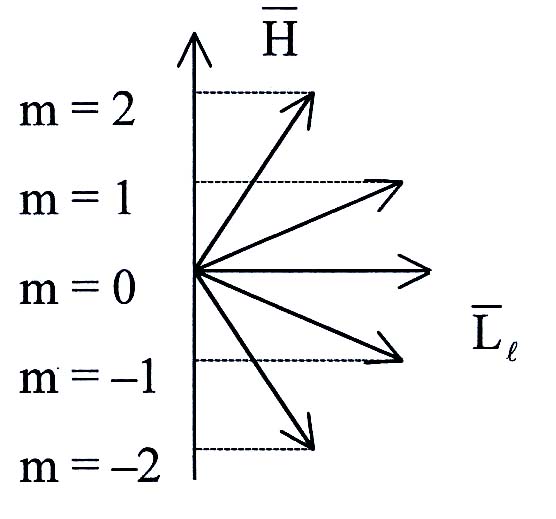 з
решения уравнения Шредингера следует,
что вектор
з
решения уравнения Шредингера следует,
что вектор
![]() орбитального момента импульса электрона
может быть только так ориентирован в
пространстве, когда его проекция
орбитального момента импульса электрона
может быть только так ориентирован в
пространстве, когда его проекция
![]() на направление внешнего магнитного
поля принимает только квантованные
значения
на направление внешнего магнитного
поля принимает только квантованные
значения
![]() ,
где
– магнитное квантовое число. Оно
определяет проекцию
,
где
– магнитное квантовое число. Оно
определяет проекцию
![]() на направление внешнего магнитного
поля
и характеризует ориентацию плоскости
электронной орбиты в пространстве,
принимая значения
на направление внешнего магнитного
поля
и характеризует ориентацию плоскости
электронной орбиты в пространстве,
принимая значения
![]() ,
всего
,
всего
![]() значений ориентаций.
значений ориентаций.
Хотя энергия
электрона и зависит только от квантового
числа
,
но каждому собственному значению энергии
соответствует несколько собственных
функций
![]() ,
отличающихся значениями
и
.
Значит, атом водорода может иметь одно
и то же значение энергии, находясь в
различных состояниях. Число различных
состояний, соответствующих главному
квантовому числу
,
равно
,
отличающихся значениями
и
.
Значит, атом водорода может иметь одно
и то же значение энергии, находясь в
различных состояниях. Число различных
состояний, соответствующих главному
квантовому числу
,
равно
![]() .
Состояния с одинаковым значением энергии
называются вырожденными, а число таких
состояний с одинаковыми значениями
энергии называется кратностью вырождения
соответствующего уровня. Каждый уровень
энергии водородоподобного атома имеет
кратность вырождения, равную
.
Состояния с одинаковым значением энергии
называются вырожденными, а число таких
состояний с одинаковыми значениями
энергии называется кратностью вырождения
соответствующего уровня. Каждый уровень
энергии водородоподобного атома имеет
кратность вырождения, равную
![]() .
.
