
- •Молекулярная физика и термодинамика
- •Макроскопические состояния Макроскопические параметры.
- •Основное уравнение молекулярно-кинетической теории.
- •Уравнения состояния идеального и реального газов
- •Функции состояния. Внутренняя энергия. Число степеней свободы молекулы
- •Основы термодинамики Термодинамические процессы. Работа и количество теплоты. Теплоемкость
- •Первое начало термодинамики. Адиабатный процесс
- •Обратимые и необратимые процессы. Тепловые машины. Цикл Карно. Неравенство Клаузиуса
- •Энтропия. Теорема Карно
- •Второе начало термодинамики. Третье начало термодинамики (тепловая теорема Нернста)
- •Статистические распределения Распределение молекул газа по скоростям. Распределение Максвелла. Распределение Больцмана
- •Флуктуации. Микросостояния и вероятность макросостояния. Термодинамическая вероятность и энтропия
- •Элементы физической кинетики
- •Элементарная теория явлений переноса. Диффузия. Теплопроводность. Внутреннее трение (вязкость)
- •Фазовые равновесия и фазовые превращения. Фазы и фазовые равновесия. Фазовые диаграммы.
- •Фазовые переходы первого и второго рода. Уравнение Клапейрона-Клаузиуса. Изотермы Ван-дер-Ваальса
Энтропия. Теорема Карно
Кроме термодинамических параметров p, V, T и функции состояния системы - внутренней энергии U, в термодинамике используются и другие функции состояния системы. Особое место среди них занимает энтропия. Как это следует из теоремы Клаузиуса, для любого бесконечно малого обратимого процесса отношение dQ/T есть полный дифференциал некоторой функции состояния системы, которая называется энтропией.
dS = dQ/T.
Для любого конечного процесса интеграл вида:
S2 - S1 = dQ/T ,
выражает изменение энтропии.
Каждому состоянию системы соответствует определенное значение энтропии S (подобно внутренней энергии U). Энтропия системы как целого равна сумме энтропий отдельных частей системы, т.е. энтропия аддитивная величина. Как видно из определения энтропии, можно рассчитать только ее изменение, а не саму энтропию. Однако для термодинамики, изучающей в основном различные процессы в веществе, этого вполне достаточно. В расчетные формулы при описании различных процессов будет входить изменение энтропии. То же самое можно сказать и о внутренней энергии. dS и dQ имеют одинаковые знаки. Это позволяет судить о направлении теплообмена по изменению энтропии. Например, при нагревании тела ( dQ > 0) его энтропия возрастает. При адиабатном процессе ( dQ = 0) энтропия системы не изменяется. Весьма полезно многие процессы изображать на диаграмме в координатах T - S (T - S диаграммы). Рассмотрим любой обратимый процесс в координатах T - S (рис. 8).
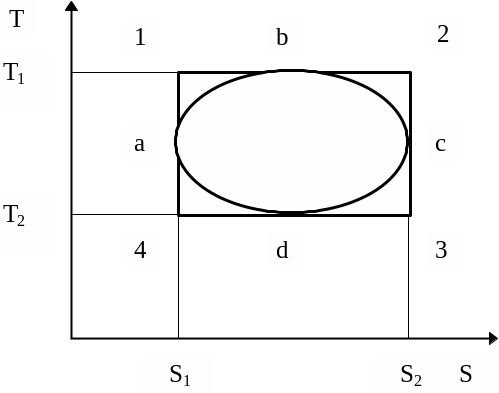
Рис. 8. Теорема Карно и максимальный КПД тепловой машины
Из определения энтропии следует, что для обратимого процесса dQ = TdS. Количество теплоты, сообщенное системе в процессе 12, будет равно площади всей фигуры S112S2:
Q12 = dQ = TdS.
Используя T - S диаграмму можно доказать теорему Карно: к.п.д. цикла Карно максимален и не зависит от природы рабочего тела и конструкции идеальной тепловой машины, а определяется только температурами нагревателя и холодильника.
Рассмотрим любой произвольный обратимый круговой процесс аbсdа. Как видно из диаграммы, к рабочему телу в процессе abc подводится тепло Q1 = TdS > 0. В процессе cda отводится Q2’= - Q2 = TdS < 0. Работа за весь цикл A соответствует площади, ограниченной замкнутой кривой abcda. По определению hобр = A/Q1 . В частности для цикла Карно (рис. 8):
hK = (T1 -T2 )(S2 -S1 )/[T1 (S2 - S1 )] = (T1 - T2 )/T1 ,
без каких либо ограничений на тип рабочего тела и идеальной тепловой машины. Полученная формула совпадает с формулой, полученной ранее в предположении, что рабочим телом является идеальный газ.
Из диаграммы для произвольного обратимого цикла видно, что
Q1 = T1(S2 - S1) - (A1 +A2), а Q2 = T2(S2 - S1) + (A3 + A4). Тогда hобр = (Q1 - Q2)/Q1 =
= [T1(S2 - S1) - (A1 +A2) - T2(S2 - S1) - (A3 + A4)]/ [T1(S2 - S1) - (A1 +A2)] =
= [T1(S2 - S1) - T2(S2 - S1) - (A1 +A2 + A3 +A4)]/[T1(S2 - S1) - (A1 +A2)], или
hобр =
![]() ,
,
где - k = (A1+A2 + A3 +A4)/[(T1 - Т2)(S2 - S1), k’= (A1+A2) )/[(T1 - Т2)(S2 - S1).
Очевидно, что k >k’. Тогда (1-k)/(1-k’) < 1, что доказывает максимальность КПД цикла Карно по сравнению с другими циклами (hобр £ hК).
