
- •26.08.2011 Г. Протокол №1
- •Выписка из плана учебного процесса
- •Содержание
- •Введение
- •Сферы применения природных и синтетических цеолитов
- •1. Общие свойства и особенности структуры цеолитов
- •1.1 Химические составы природных цеолитов
- •1.2 Номенклатура цеолитов
- •1.3 Классификация цеолитов
- •1.4 Типы кристаллических решеток. Структуры цеолитов
- •Кристаллографические сингонии
- •Формы кристаллов
- •2 Краткие сведения о генезисе природных цеолитов.
- •3 Вода в минералах. Классификация. Вода в цеолитах
- •Измерения усредненных диффузией
- •4 Свойства цеолитов
- •4.1 Физические свойства цеолитов
- •4.2. Химические свойства цеолитов
- •5. Синтез цеолитов. Молекулярные сита
- •Синтезы порошкообразных цеолитов различных типов при кристаллизации алюмокремниевых гидрогелей
- •6. Ионный обмен. Ионный обмен на различных формах цеолитов
- •Цеолиты как ионообменники для защиты окружающей среды.
- •7. Адсорбция. Адсорбционные свойства цеолитов
- •Ионная адсорбция
- •Обманная адсорбция
- •Vpsa генераторы кислорода
- •8. Катализ. Использование цеолитов в качестве катализаторов
- •Типы катализаторов
- •Как работают катализаторы
- •Применение катализа в промышленности
- •9. Использование цеолитов в нефтяной и газовой промышленности Подготовка нефти и газа к транспорту
- •Основные способы отделения воды от нефти
- •Осушка газа молекулярными ситами
- •Экспериментальное исследование адсорбции нефтепродуктов в слое цеолитов б.С.Байзакова, к.К. Сырманова, ф.Е.Алтынбеков
3 Вода в минералах. Классификация. Вода в цеолитах
Вода в минералах. Классификация
Относительно воды в минералах в литературе существуют самые различные термины и классификации. Остановимся вкратце на них, чтобы было ясно, относительно какой из разновидностей воды идет речь. По литературным данным вода в минералах бывает:
конституционная,
кристаллизационная,
вода твердых коллоидов,
межплоскостная,
межслоевая,
гигроскопическая,
физически связанная,
химически связанная,
цеолитная,
адсорбционная.
Вода конституционная находится в кристаллической решетке минерала в виде ионов ОН1–, реже Н1– и оксония Н2О+; она переходит в молекулярное состояние лишь при разрушении структуры минерала. При нагревании выделение конституционной воды у каждого минерала происходит в определенном интервале температур от 300 до 1000 °С.
Кристаллизационная вода находится в решетке в виде нейтральных молекул Н2О, занимающих определенные места. Выделение кристаллизационной воды при нагревании происходит при температуре ниже 300 °С. Различаются два типа кристаллизационной воды. Типичная кристаллизационная вода выделяется в узком интервале температур с полным разрушением и перестройкой структуры минерала с изменением его физических свойств: показатель преломления, удельный вес и др.
Цеолитная вода может выделяется постепенно, в большом интервале температур, и вновь поглощаться при изменении условий, без нарушения физической однородности вещественного состава, но с изменением всех его физических свойств (например, прозрачности, показателя преломления и т. д.).
Молекулы адсорбционной воды находятся на поверхности кристаллических частиц и легко удаляются при нагревании.
Различают межплоскостную воду, адсорбированную на поверхности отдельных слоев в минерале, воду твердых коллоидов (затвердевших гелей) и гигроскопическую воду, механически примешанную к минералу, которая при нагревании полностью удаляется при температуре 105–110 °С. Межплоскостная вода в минералах – вода, характерная для некоторых минералов слоистой структуры (например, монтмориллонита, слюд). Молекулы этой воды располагаются иногда в несколько слоев между нейтральными слоями решетки. По своему типу она приближается к кристаллизационной, а по поведению близка к цеолитной воде, но, в отличие от последней, при выделении ее объем минерала уменьшается, а удельный вес и показатель преломления увеличиваются.
Адсорбционная вода – молекулы связаны с поверхностью кристаллических частиц, образуют вокруг частиц гидратные оболочки.
Такое большое разнообразие терминов по определению воды в минералах вносит большую путаницу, и порой сложно определить, с какой водой имеем дело. Нужна более строгая классификация воды и более современный метод ее отнесения. Наиболее надежными методами являются метод ЯМР и метод ИК-спектроскопии, которые позволяют классифицировать ее по энергии связи с минералом.
Горные породы характеризуются влагоемкостью и водоотдачей. Влагоемкостью называется способность горных пород вмещать и удерживать определенное количество воды. Высокой влагоемкостью обладают глины; средней – мелкие пески; слабой – галечники. Влагоемкость, определяемая силами молекулярного притяжения на поверхности частиц пород, зависит от диаметра этих частиц. Так, например, влагоемкость частицы диаметром 1 мм равна 1,6 %, а диаметром менее 0,005 мм – 45 %.
Водоотдача – отношение количества воды, которое может отдать порода, к общему содержанию воды в ней. Здесь зависимость диаметрально противоположна: процент водоотдачи тем больше, чем крупнее частицы породы. Так, у галечников она максимальная, а у глин минимальная.
Вода в цеолитах
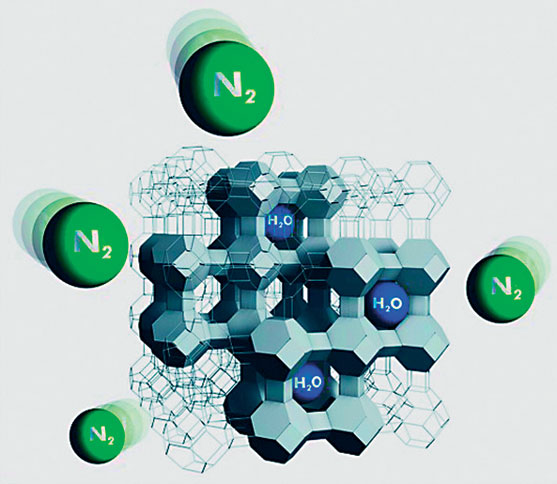
Все цеолиты по своему химическому составу являются водными алюмосиликатами кальция, натрия, бария, калия. Вопрос о том, в каком виде заключается в силикатах вода, еще далеко нельзя считать решенным. Дело в том, что вода, заключающаяся в них, выделяется из них при различной температуре: у одних при нагревании до сравнительно низкой температуры, у других же только прокаливанием можно выделить всю воду (напр., у натролита вся вода может быть удалена только нагреванием до 300°). Интересно то, что лишенные воды цеолиты. способны во влажном воздухе снова возмещать потерянную воду, причем все прежние физические свойства тоже восстановляются.
Если тонкий обломочек цеолита ввести в самое горячее место пламени паяльной трубки, то он очень быстро сплавляется, после чего вода из продолжающих нагреваться внутренних частей минерала не может выйти на воздух, она вздувает это новообразованное стекло, и кусочек цеолита перед паяльной трубкой начинает увеличиваться в объеме, изгибаться, местами в нем появляются боковые вздутия, а иногда и довольно большие выросты. Эта особенность минерала, свидетельствующая о его легкоплавкости и содержании в нем воды, и дала название всей минеральной группы.
Присутствие воды – характернейший признак цеолитов – можно обнаружить и иначе. Если на дно пробирки насыпать порошок цеолита и осторожно нагреть его так, чтобы верхняя часть пробирки осталась холодной, то очень скоро вода, выделяющаяся из нагревающегося цеолита, в виде капель осядет на холодных стенках пробирки.
Вода в цеолитах имеет еще одну особенность. Если нагревание цеолита относительно невелико и не превышает 300–400°, то из цеолита постепенно выделяется значительная часть содержащейся в нем воды. При этом структура цеолита не разрушается, и если после охлаждения или в процессе охлаждения минерал будет помещен во влажную атмосферу, он снова очень активно поглощает воду и восстанавливает все свои свойства. Такая легко отдаваемая и вновь восстанавливаемая вода в структуре минерала получила даже название «цеолитной воды».
Своеобразны и некоторые другие свойства цеолитов. Они, например, как оказалось, очень легко подвергаются так называемому ионному обмену; в результате обработки цеолита растворами, содержащими какой-либо катион (металл), присутствующие в составе минерала щелочи и щелочные земли могут заменяться этим новым катионом, даже таким, как серебро.
Причина этих необычных особенностей цеолитов заключается в их структуре. Для структуры цеолитов, как и для структуры полевых шпатов, характерен алюмосиликатный каркас, в котором каждый ион алюминия или кремния окружен четырьмя ионами кислорода, а каждый ион кислорода, в свою очередь, связан с двумя ионами этих металлов. Избыточные отрицательные ионы (Напомним, что алюминий трехвалентен и, таким образом, может компенсировать только три, а не четыре кислородных заряда. В результате один заряд кислорода остается «избыточным») компенсируются ионами натрия, кальция или реже калия. Как в структуре полевого шпата, так и в структуре цеолитов эти ионы располагаются в плоскостях кремнекислородного каркаса. В структуре полевого шпата такие полости очень малы, тогда как в структуре цеолитов эти полости крупные и зачастую сообщаются между собой (рис. 1 и 2). В структуре многих цеолитов присутствуют и каналы, пронизывающие всю кристаллическую постройку. Отсюда и большая относительная легкость цеолитов (напомним, что плотность полевых шпатов около 2,6–2,7 г/см3, а цеолитов 2,1–2,2 г/см3, редко выше). К этим каналам и полостям у цеолитов приурочены щелочные и щелочноземельные катионы, а также молекулы воды; последние сравнительно слабо связаны с каркасом и катионами, и поэтому могут свободно удаляться по каналам без разрушения связей каркаса – это и создает способность цеолита терять воду и набирать ее обратно.
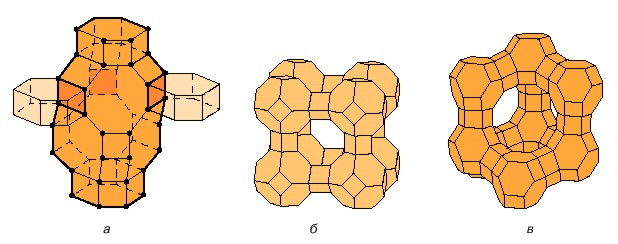



а б в
Рисунок 1 – Структурные элементы цеолитов: а – шабазит; б – синтетические кристаллы Линде Х; в – фожазит.
Прямыми линиями соединены центры соседних тетраэдров. Каждая вершина соответствует положению атома Si или Al. Видны широкие каналы, благодаря которым цеолиты используются в качестве молекулярных сит

 3
3
 4
4
Рисунок 2 – Цеолит NaA (структура типа LTA, размер пор 0,41 нм):
1 – структура; 2 – кристаллы; 3 – молекулярное сито-5A; 4 – молекулярное сито-3А.
Способность цеолитов, потерявших воду, поглощать ее обратно из разных сред, а также молекулярно-ситовая способность – способность избирательно адсорбировать некоторые вещества, была замечена довольно давно, но только в самом начале пятидесятых годов прошлого века начала практически использоваться.
Спектры ЯМР (ядерный магнитный резонанс) цеолитной воды в большинстве природных и искусственных кристаллов семейства цеолитов и их модификаций отвечают фиксированной воде лишь при температурах, не превышающих 200–250 К. Исключение составляют узкопористые цеолиты (натролит, сколецит, томсонит и др.), для которых не фиксируется подвижность молекул воды до 350–400 К.
Интересно, что ИК-спектры узкопористых цеолитов обладают тонкой структурой, как и в случае гипса, что указывает на упорядоченность структуры кристалла в целом.
При температурах свыше 200–250 К спектры ЯМР широкопористых цеолитов резко (в сотни раз) сужаются и приобретают характерную для диффундирующей в кристаллах воды структуру. При этом существенны два факта.
Во-первых, ширина суженного спектра остается постоянной вплоть до температуры дегидратации (200–300° С и более). Это означает, что при всех температурах молекула движется по одному и тому же строго заданному структурой кристалла диффузионному пути в точности так же, как в кристаллогидратах.
Во-вторых, несмотря на низкотемпературную подвижность, сохраняются очень высокие значения температуры дегидратации. Данная особенность резко отличает цеолиты от кристаллогидратов, в которых дегидратация или плавление редко происходит при температурах заметно выше 100 °С.
Природа высокотемпературного гидратированного состояния цеолитов прояснилась только после обнаружения «двухфазного» строения цеолитной воды. Оказалось, что диффузия молекул воды в цеолитных каналах не мешает некоторой части этих молекул быть жестко связанной в цеолитных каналах. Например, в мордените, несмотря на начало диффузионного сужения спектра ЯМР при –100 °С, даже при –110° С остается около 10 % жестко связанной воды (при этом полная дегидратация имеет место лишь при 450 °С).
Было предположено, что эти жестко связанные молекулы подобно пробкам блокируют цеолитный канал, преграждая путь диффундирующим молекулам. Отсюда естественно выдвинуть изохорическую модель цеолитной воды в замкнутом пространстве каналов. Нагрев повышает давление внутри канала а вместе с давлением растет и температура «плавления» цеолитной воды. В соответствии со сказанным диффузию воды в гидратированных цеолитах можно рассматривать как изохорическое (в замкнутом объеме) плавление.
Очевидно также, что эффективность «пробок» в запирании объема каналов связана с их коллективными свойствами, вытекающими из наличия более прочных связей вода-вода в определенных участках цеолитных каналов».
