
- •26.08.2011 Г. Протокол №1
- •Выписка из плана учебного процесса
- •Содержание
- •Введение
- •Сферы применения природных и синтетических цеолитов
- •1. Общие свойства и особенности структуры цеолитов
- •1.1 Химические составы природных цеолитов
- •1.2 Номенклатура цеолитов
- •1.3 Классификация цеолитов
- •1.4 Типы кристаллических решеток. Структуры цеолитов
- •Кристаллографические сингонии
- •Формы кристаллов
- •2 Краткие сведения о генезисе природных цеолитов.
- •3 Вода в минералах. Классификация. Вода в цеолитах
- •Измерения усредненных диффузией
- •4 Свойства цеолитов
- •4.1 Физические свойства цеолитов
- •4.2. Химические свойства цеолитов
- •5. Синтез цеолитов. Молекулярные сита
- •Синтезы порошкообразных цеолитов различных типов при кристаллизации алюмокремниевых гидрогелей
- •6. Ионный обмен. Ионный обмен на различных формах цеолитов
- •Цеолиты как ионообменники для защиты окружающей среды.
- •7. Адсорбция. Адсорбционные свойства цеолитов
- •Ионная адсорбция
- •Обманная адсорбция
- •Vpsa генераторы кислорода
- •8. Катализ. Использование цеолитов в качестве катализаторов
- •Типы катализаторов
- •Как работают катализаторы
- •Применение катализа в промышленности
- •9. Использование цеолитов в нефтяной и газовой промышленности Подготовка нефти и газа к транспорту
- •Основные способы отделения воды от нефти
- •Осушка газа молекулярными ситами
- •Экспериментальное исследование адсорбции нефтепродуктов в слое цеолитов б.С.Байзакова, к.К. Сырманова, ф.Е.Алтынбеков
1.4 Типы кристаллических решеток. Структуры цеолитов
Цеолиты – кристаллические нанопористые твердые тела с диаметром пор приблизительно 1 нм.
Из школьного курса химии Вам известно, что в зависимости от того, какие частицы находятся в узлах решетки, различают ионную, атомную и молекулярные кристаллические решетки. Известны и металлические кристаллические решетки.
В отличие от кристаллических веществ в аморфных веществах такое закономерное расположение частиц не наблюдается.
Ионные кристаллические решетки. Такие решетки характерны для ионных соединений. В узлах ионных решеток находятся противоположно заряженные ионы. Типичными представителями этих соединений являются соли. Например, в узлах кристаллической решетки хлорида натрия находятся ионы натрия и хлорид-ионы.
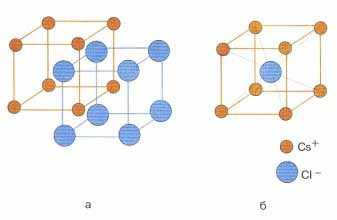
Изображения кристаллической решетки NaCl и CsCl
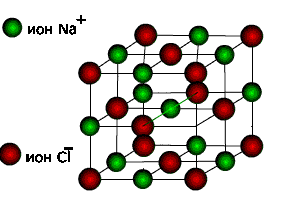

Изображения кристаллической решетки галита (поваренной соли).
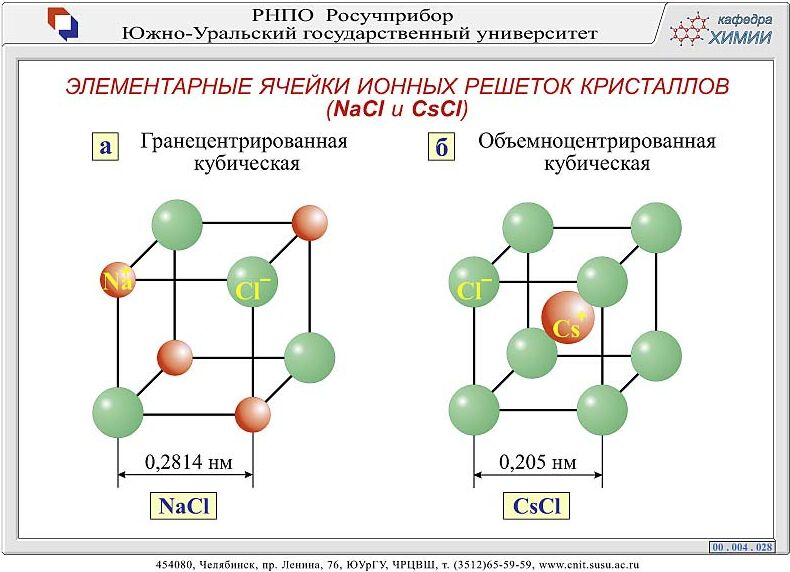
В хлориде натрия каждый ион связан (в трех перпендикулярных плоскостях) с шестью противоположно заряженными ионами. Эти ионы находятся на одинаковых расстояниях друг от друга, образуя кристаллы кубической формы. В кристаллах хлорида натрия отдельных молекул хлорида натрия не существует. Весь кристалл представляет собой как бы гигантскую молекулу.
Подобно хлориду натрия большинство солей состоит не из молекул, а из отдельных ионов.
Атомные кристаллические решетки. В узлах атомных кристаллических решеток находятся отдельные атомы, связанные между собой ковалентными связями. Так как атомы, подобно ионам, могут располагаться в пространстве по-разному, то и в этих случаях образуются кристаллы различной формы. Например, в узлах кристаллических решеток алмаза и графита находятся атомы углерода, но из-за различного расположения атомов кристаллы алмаза имеют октаэдрическую форму, а кристаллы графита призматическую.
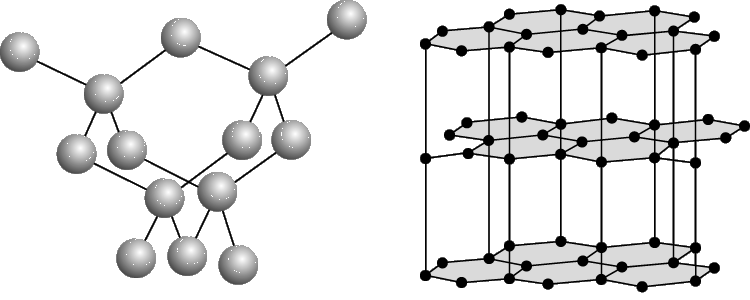
а б
Структура алмаза (а) и графита (б)
Молекулярные кристаллические решетки. В узлах молекулярных кристаллических решеток находятся неполярные или полярные молекулы. Например, в узлах кристаллической решетки кислорода (при температуре ниже –219°С) находятся неполярные молекулы О2, в узлах кристаллической решетки твердого хлороводорода (при температуре ниже –144°С) полярные молекулы НСl. Как и в предыдущих случаях, в зависимости от взаимного расположения молекул в пространстве могут образовываться кристаллы различной формы.
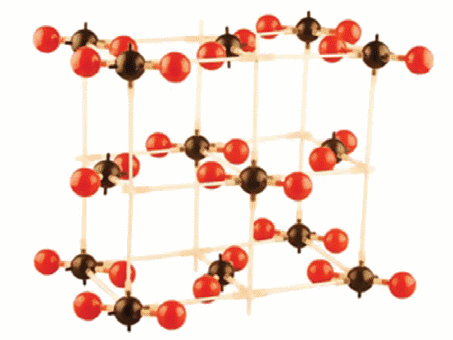
Кристаллическая решетка углекислого газа
Зависимость некоторых физических свойств веществ от типов кристаллических решеток. Существует следующая закономерность:
если известно строение веществ, то можно предсказать их свойства или наоборот: если известны свойства веществ, то можно определить их строение.
http://www.kabinetgeo.narod.ru/lech1_m.htm
Все твердые минералы по своему внутреннему строению делятся на кристаллические и аморфные.
Химические элементы (атомы, ионы, молекулы), слагающие минералы, могут располагаться друг относительно друга закономерно, т.е. на определенном расстоянии и в определенном количественном соотношении. В этом случае образуются кристаллы или минералы кристаллического строения. Если же расположение химических элементов хаотичное (неупорядоченное) – образуются минералы аморфного строения.
Роль внутреннего строения является определяющей в совокупности свойств минерала. Поэтому в минералогии выделился раздел науки называемый кристаллографией. По Дэна – это наука о твердых телах и законах, которые управляют их ростом, внешней формой и внутренней структурой.
Закономерное размещение атомов и ионов заключается в следующем. Атомы и ионы, составляющие минералы располагаются в виде узлов геометрических фигур:
Серия таких фигур образует плоскую сетку (модель графита).
Плоские сетки могут располагаться параллельно друг другу и взаимно пересекаться. В этом случае они образуют пространственную решетку. Факт геометрически закономерной кристаллической структуры минералов объясняет ряд важнейших свойств. Рассмотрим некоторые из них.
1. Прежде всего, из этого вытекает само определение кристалла – это твердое тело, имеющее естественную форму многогранника, в котором слагающие частицы (атомы, ионы …) располагаются закономерно по принципу кристаллической решетки.
2. Отсюда способность к самоогранению, т.е. принимать внешние формы, отражающие плоские сетки кристаллической решетки. Элементами самоогранения кристаллов являются грани, ребра, вершины углов. Здесь же важное свойство кристаллов, формулируемое как Закон постоянства гранных углов. Его суть: углы между соответствующими гранями во всех кристаллах одного и того же минерала постоянны. На практике применение этого закона дает возможность, сделав измерения углов, определить минералогическую принадлежность кристалла.
3. Однородность – важное свойство, означающее, что любая часть кристалла обладает теми же свойствами, что и весь кристалл по параллельным направлениям.
4. Анизотропность – свойство однородных кристаллов изменять величину одного и того же физического свойства по не параллельным направлениям. Наглядным примером служат: минерал ДИСТЕН, у которого разная твердость по взаимно перпендикулярным направлениям слюды легко расщепляются по параллельным пластинам, но трудно в перпендикулярном направлении.
Аморфные вещества – изотропны, т.е. все свойства одинаковы по всем направлениям.
5. Симметрия (от греч. symmetria – соразмерность) – свойство кристаллов закономерно повторять “равные части”, т.е. элементы огранения кристаллов, относительно воображаемым вспомогательным элементам, которые называются элементами симметрии . К ним относятся:
Центр С – точка внутри кристалла, которая располагается на равном удалении от элементов огранения (граней, ребер, углов).
Плоскость симметрии Р – воображаемая плоскость, делит кристалл на равные зеркально отраженные части.
Ось симметрии L – воображаемая линия, вокруг которой несколько раз повторяются равные части фигуры. Поскольку кристалл можно повернуть на 360 о, то количество совмещений элементов его огранения составляет 2, 3, 4, 6 раз. Эти числа определяют порядок оси, запись делают: L2 – что означает ось второго порядка.
Кроме обычных осей, существуют инверсионные (поворотные) оси (редко встречаются). Они определяются при одновременном повороте кристалла вокруг оси симметрии и вокруг центра.
Полный набор элементов симметрии данного кристалла называется видом симметрии или классом. Установлено, что существует 32 класса. Запись полной совокупности элементов симметрии кристалла от высших к низшим называется формулой симметри и – например L33L23PC.
Классы объединяются в сингонии. Сингония – это группа видов симметрии, которая обладает одним или несколькими общими элементами симметрии. Всего установлено 7 сингоний. В свою очередь, сингонии объединяются в 3 категории – низшую, среднюю и высшую.
