
- •26.08.2011 Г. Протокол №1
- •Выписка из плана учебного процесса
- •Содержание
- •Введение
- •Сферы применения природных и синтетических цеолитов
- •1. Общие свойства и особенности структуры цеолитов
- •1.1 Химические составы природных цеолитов
- •1.2 Номенклатура цеолитов
- •1.3 Классификация цеолитов
- •1.4 Типы кристаллических решеток. Структуры цеолитов
- •Кристаллографические сингонии
- •Формы кристаллов
- •2 Краткие сведения о генезисе природных цеолитов.
- •3 Вода в минералах. Классификация. Вода в цеолитах
- •Измерения усредненных диффузией
- •4 Свойства цеолитов
- •4.1 Физические свойства цеолитов
- •4.2. Химические свойства цеолитов
- •5. Синтез цеолитов. Молекулярные сита
- •Синтезы порошкообразных цеолитов различных типов при кристаллизации алюмокремниевых гидрогелей
- •6. Ионный обмен. Ионный обмен на различных формах цеолитов
- •Цеолиты как ионообменники для защиты окружающей среды.
- •7. Адсорбция. Адсорбционные свойства цеолитов
- •Ионная адсорбция
- •Обманная адсорбция
- •Vpsa генераторы кислорода
- •8. Катализ. Использование цеолитов в качестве катализаторов
- •Типы катализаторов
- •Как работают катализаторы
- •Применение катализа в промышленности
- •9. Использование цеолитов в нефтяной и газовой промышленности Подготовка нефти и газа к транспорту
- •Основные способы отделения воды от нефти
- •Осушка газа молекулярными ситами
- •Экспериментальное исследование адсорбции нефтепродуктов в слое цеолитов б.С.Байзакова, к.К. Сырманова, ф.Е.Алтынбеков
Синтезы порошкообразных цеолитов различных типов при кристаллизации алюмокремниевых гидрогелей
Некоторые общие условия синтеза
Обычно синтез цеолитов проводится в следующих условиях:
реакционно-способные исходные соединения типа свежеосажденных гелей или аморфных твердых тел;
относительно высокие рН в результате использования гидроокисей щелочных металлов или других сильных оснований;
низкотемпературные гидротермальные условия с сопутствующим низким автоклавным давлением, создаваемым насыщенными парами воды;
высокая степень пересыщения по компонентам геля, ведущая к образованию зародышей большого числа кристаллов.
Используемый гель представляет гидратированный алюмосиликат металла, полученный либо из водных растворов, реакционно-способных твердых тел или коллоидных золей, либо из реакционно-способных алюмосиликатов типа остаточных структур метакаолина (получены из каолина путем дегидроксилирования) или стекол. Получение и свойства аморфных силикатных гелей типа силикагелей были предметом многочисленных исследований в течение ряда лет. Силикагель определяют как «коллоидную систему твердого типа, в которой коллоидные частицы в какой-то степени образуют когерентную структуру, причем эта структура пронизана системой, состоящей из кинетических единиц, меньших, чем коллоидные частицы (обычно жидкостью).
Гели кристаллизуются в закрытых гидротермальных системах, обычно при температурах от комнатной до 175 °С. В некоторых случаях используются и более высокие температуры, до 300 °С. Давление обычно соответствует давлению насыщенных паров воды при данной температуре. Длительность кристаллизации изменяется от нескольких часов до нескольких дней. Полученные алюмосиликатные гели сильно различаются по внешнему виду: это могут быть плотные полупрозрачные вещества, непрозрачные желатинообразные осадки и гетерогенные смеси аморфных твердых тел, диспергированных в водном растворе. Щелочные металлы образуют растворимые гидроокиси, алюминаты и силикаты и поэтому весьма удобны при приготовлении гомогенных смесей.
Получение геля и кристаллизацию в системе Na2O – Al2O3 – SiO2 – Н2O можно представить схематически следующим образом:
NaOH (aq) + NaAl(OH)4 (aq) + Na2SiO3(aq)
v Т1 = 25 °С
[Naa(AlO2)b (SiO2)c· NaOH·H2О] (гель)
v Т2 = 25–175 °С
Nax [(AlO2)b (SiO2)у] mH2O + раствор
Кристаллы цеолита
Легкость, с которой кристаллизуются цеолиты, объясняется высокой реакционной способностью геля, соответствующей концентрацией щелочи и высокой поверхностной активностью, обусловленной небольшими размерами частиц рассматриваемых твердых фаз. Гель, вероятно, образуется вследствие сополимеризации индивидуальных силикатов и алюминатов по механизму конденсационной полимеризации. Состав геля и его структура, по-видимому, определяются размером и структурой полимеризующихся частиц.
Кинетические закономерности образования синтетических цеолитов в различных системах
Кинетика кристаллизации описывается S – образными кривыми, точка перегиба которых соответствует максимальной скорости цеолитообразования. На S – образных кривых, описывающих кинетику кристаллизации цеолита, можно выделить следующие основные периоды цеолитообразования:
индукционный период, в течении которого заметного образования кристаллической фазы не наблюдают, а происходит образование предшественников кристаллов - центров кристаллизации и их рост до критических размеров;
автокаталитический период - период быстрого роста цеолитных кристаллов, в котором скорость цеолитообразования достигает максимального значения;
заключительный период, в котором формирование цеолита завершается и который характеризуется значительной продолжительностью из-за снижения скорости цеолитообразования вследствие возникающих транспортных (диффузионных) затруднений подвода компонентов, находящихся в жидкой фазе, к поверхности растущих цеолитных кристаллов.
Одним из основных факторов, влияющих на кинетику кристаллизации цеолитов, является предшествующая собственно кристаллизации низкотемпературная выдержка реакционных смесей. Было установлено, что в гелях, подвергнутых старению при комнатной температуре, скорость цеолитообразования и глубина кристаллизации увеличиваются. В этом случае не только значительно сокращается продолжительность синтеза, но и резко уменьшаются размеры получаемых кристаллов. Ускорение кристаллизации гелей, подвергнутых старению, связано с зародышеобразованием, протекающим в гелях в период старения, и большей интенсивностью этого процесса в начальный период цеолитообразования. Уменьшение размеров кристаллов в конечном продукте вызывается общим сокращением длительности синтеза, а также связано с диспергированием самих гелей. Длительное старение реакционной смеси при комнатной температуре приводило к полной кристаллизации цеолита типа А в течение 3-х месяцев.
Старение реакционных смесей оказывает влияние не только на скорость процесса, но, в некоторых случаях, и на направление кристаллизации.
Таким образом, фактор старения геля создает благоприятные предпосылки для кристаллизации высокосимметричных цеолитных структур. А сам процесс кристаллизации можно рассматривать как двухстадийную реакцию, состоящую из предварительной выдержки реакционных структур при низких температурах - старения и собственно кристаллизации.
Существенное влияние на кинетику кристаллизации оказывает содержание щелочи в реакционных смесях. С увеличением концентрации щелочи, при прочих равных условиях цеолитообразование ускоряется. Увеличение щелочности приводит, с одной стороны, к увеличению линейной скорости роста кристаллов, а с другой стороны - к увеличению общего числа центров кристаллизации. Следствием последнего обстоятельства является образование более высокодисперсного продукта из более щелочных систем. При кристаллизации гелей различного катионного состава цеолитообразование происходит быстрее в тех случаях, когда гели содержат более сильные основания.
Увеличение концентрации щелочи приводит к увеличению рН реакционной смеси. С другой стороны, увеличения рН можно достичь концентрированием геля, т.е. снижением разбавления реакционных смесей. При снижении объема жидкой фазы удлиняется индукционный период, поэтому эффект концентрирования гелей оказывает двойственное влияние на кинетику кристаллизации. Однако основным фактором при этом является все же увеличение концентрации щелочи, что и приводит к ускорению кристаллизации реакционных смесей при их концентрировании.
На скорость и направление кристаллизации цеолитов влияет катионный состав исходных реакционных смесей. Изменение природы щелочного компонента чаще всего приводит к образованию различных цеолитных структур. Направление кристаллизации и скорость цеолитообразования, как правило, различны в моно- и бикатионных системах и зависят не только от общей щелочности реакционных смесей, но и от соотношения щелочных катионов.
Кроме вышеперечисленных факторов на направление и скорость кристаллизации существенно влияют добавки порошкообразных цеолитов. Использование затравочных кристаллов может привести к образованию в гелях цеолита того же структурного типа, что и затравка, даже если из этих реакционных смесей этот тип цеолита обычно не кристаллизуется. Увеличение скорости кристаллизации тем выше, чем больше масса вводимых затравочных кристаллов и выше их дисперсность.
При использовании затравок рост кристаллической фазы происходит за счет роста самих кристаллов затравок и за счет зарождения и роста новых кристаллов. Непосредственные измерения линейной скорости роста затравочных кристаллов и вновь образовавшихся зародышей показали, что они растут с близкими скоростями.
В качестве затравок, значительно ускоряющих кристаллизацию, применяют не только порошкообразные кристаллические добавки цеолитов, но и рентгеноаморфные высокощелочные силикаалюмогидрогели. По химическому составу «аморфные затравки» значительно отличаются от составов реакционных смесей, для ускорения кристаллизации которых они используются. Так, например, в качестве «аморфной затравки» при кристаллизации цеолита типа Y может быть использован гель, который самопроизвольно кристаллизуется только в цеолит типа А.
Основным кинетическим фактором кристаллизации цеолитов является температура, при которой осуществляется синтез. С повышением температуры сокращается индукционный период, а также весь процесс кристаллизации. Температура процесса в ряде случаев определяет также равновесный состав продуктов кристаллизации. Так, при одинаковом химическом составе реакционных смесей температурная последовательность образования цеолитов определяется степенью их гидратации.
Каждый тип цеолита образуется в определенном температурном интервале, причем чувствительность состава продуктов синтеза к изменению температуры процесса весьма высока. В зависимости от природы компонентов, составляющих исходную реакционную смесь, и от структуры кристаллизующихся цеолитов с повышением температуры скорость цеолитообразования возрастает по-разному.
Таким образом, все вышеизложенное позволяет заключить, что кинетические закономерности процесса кристаллизации порошкообразных цеолитов из гидрогелей изучены достаточно подробно.
Методика высокопроизводительного синтеза цеолита типа А из растворов алюмината и силиката Na
Химический состав цеолита: Na2O· Al2O3·2 SiO2·4,5 H2O
Состав элементарной ячейки: Na12[(AlO2)12 (SiO2)12] 27 H2O
Пределы изменения Si/Al =0,7/1,2; диаметр входного окна – 4,2 Å.
Сущность синтеза мелкокристаллического цеолита типа NaA заключается в кристаллизации аморфного щелочного алюмокремнегеля следующего химического состава:
(2,52,9) Na2O · Al2O3 · (2,12,3) SiО2 · (60120) Н2О
Гидрогели, необходимые для кристаллизации цеолита типа NaA, могут быть приготовлены различными способами:
а) смешением раздельно осажденных кремнегидрогеля и алюмогидрогеля с едким натром;
б) смешением раствора жидкого стекла с алюмогидрогелем и едким натром;
в) осаждение алюмокремниего гидрогеля при смешении растворов сернокислого алюминия и жидкого стекла с последующей промывкой для удаление ионов SO42– и введением едкого натра;
г) введением твердого алюмината натрия в раствор жидкого стекла;
д) смешением щелочного раствора алюмината натрия с раствором жидкого стекла при комнатной температуре;
е) смешением щелочного раствора алюмината натрия с раствором жидкого стекла при 100 °С.
Практически удобным способом является смешение щелочного раствора алюмината натрия с раствором жидкого стекла.
Во всех случаях состав гидрогеля должен отвечать молярным соотношениям Na2O /Al2O3 в пределах 1–6, а SiО2/Al2O3 в пределах 0,5–2,5. Оптимальный состав реакционной смеси см. выше.
Для ускорения кристаллизации необходимо вводить в реакционную массу коллоидную затравку и кристаллизацию осуществлять при температуре 60–80 °С. Результат процесса кристаллизации будет зависеть от свойств исходных реагентов, их концентраций, условий осаждения исходного щелочного алюмокремнегеля и режима кристаллизации. Любые отклонения от заданного тщательно отработанного режима кристаллизации цеолита NaA приводят к ухудшению его качества. Кристаллизацию цеолита NaA осуществляют из щелочного алюмокремнегеля, содержащего избыточное по отношению к составу получаемого цеолита NaA количество Na2O и А12О3.
Как уже отмечалось, получение цеолита NaA связано с введением коллоидной затравки в массу кристаллизуемого алюмокремнегеля с образованием центров кристаллизации (зародышей) цеолита NaA. Химический состав коллоидной затравки: 12,7Na2O · А12О3 · 12SiO2 ·nH2O.
Приготовленная коллоидная затравка должна обладать однородностью и в процессе хранения не должна расслаиваться, что достигается следующими технологическими приемами:
а) выполняется определенный порядок слива исходных растворов: в алюминат натрия сливается щелочь, а затем после перемешивания быстро сливается силикат натрия и тщательно перемешивается;
б) для предотвращения расслаивания затравки температура исходных растворов должна быть не выше 20 °С.
Схема синтеза цеолита типа A.
Подобная методика синтеза цеолита NaA из концентрированных растворов жидкого стекла и алюмината натрия обеспечивает получение цеолита высокого качества с высоким выходом.
Пример расчета требуемого количества исходных веществ для получения суспензии цеолита типа NaA
Состав реакционной смеси равен: 2,5Na2O · Al2O3 · 2,1SiО2 · 60Н2О
Исходные вещества:
раствор силиката натрия Na2SiO3:
Плотность – 1,2 кг/м3; М=2,85; N=2,15
Содержание Na2O – 66,7 г/л;
Содержание SiO2 – 183,8 г/л;
Содержание H2O – 949,5 г/л
раствор алюмината натрия NaAlO2
Плотность – 1,5 кг/м3;
Содержание Na2O – 304 г./л;
Содержание Al2O3 – 282,6 г/л;
Содержание H2O – 913,4 г/л
Способ 1
1) Рассчитываем количество молей Na2O (n Na2O), Al2O3 (n Al2O3) и Н2O (n Н2O) содержащееся в 1 литре раствора алюмината натрия:
n (Na2O) = Содержание Na2O/молек. масса (Na2O) = 304 г./(62 г./моль) = = 4,9 моля
n (Al2O3) = Содержание Al2O3/молек. масса (Al2O3) = 282,6 г/(102 г./моль) = = 2,7 моля
n (Н2O) = Содержание Н2O/молек. масса (Н2O) = 913,4 г/(18 г./моль) = = 50,7 моля
2) Рассчитываем количество молей Na2O (n Na2O), SiO2 (n SiO2) и Н2O (n Н2O) содержащееся в 1 литре раствора силиката натрия:
n (Na2O) = Содержание Na2O/молек. масса (Na2O) = 66,7 г/(62 г./моль) = = 1,07 моля
n (SiO2) = Содержание SiO2 /молек. масса (SiO2) = 183,8 г/(60 г./моль) = = 3,06 моля
n (Н2O) = Содержание Н2O/молек. масса (Н2O) = 949,5 г/(18 г./моль) = = 52,7 моля
3) Расчет ведем, исходя из одного литра алюмината натрия, поэтому состав реакционной смеси умножаем на n (Al2O3) =2,7. Тогда получится следующий состав реакционной смеси:
6,75Na2O · 2,7Al2O3 · 5,67SiО2 · 162Н2О
4) Исходя из полученного в пункте (3) состава нам необходимо, чтобы в реакционной смеси содержалось 6,75 молей Na2O. Так как с 1 литром алюмината натрия добавляем 4,9 молей Na2O, то необходимо добавить: 6,75 – 4,9 = 1,85 молей Na2O.
Недостающее количество Na2O вносим с силикатом натрия. Необходимый для этого объем рассчитываем по следующей пропорции:
в 1 литре Na2SiO3 – 1,07 Na2O
в Х литрах Na2SiO3 – 1,85 молей Na2O.
Х=1,85/1,07=1,72 литра Na2SiO3
5) Рассчитываем количество молей SiО2 в 1,72 литра Na2SiO3.
в 1 литре Na2SiO3 – 3,06 SiО2
в 1,72 литрах Na2SiO3 – Х молей SiО2.
Х=5,26 молей
6) Рассчитываем количество молей Н2O
Н2O =50,7 (с 1 л алюмината) +52,7·1,72 (с 1,72 л силиката) = 141,3 молей
Тогда состав реакционной смеси равен:
6,75Na2O · 2,7Al2O3 · 5,26SiО2 · 141,3Н2О
7) Исходя из нашего расчетного состава реакционной смеси в ней должно содержаться 5,67 молей SiО2, а мы с 1,72 литрами Na2SiO3 вводим 5,26 молей SiО2. Следовательно не хватает 0,41 молей SiО2.
8) Не хватает 0,41 молей SiО2 (25,42 г.) и 20,7 моль Н2O (372,6 г). добавляем белой сажи с содержанием SiО2 83 % и влажностью 13 %.
0,41 молей SiО2 это 25,42 г – 83 %
30,6 г – 100 %
30,6 г белой сажи содержит 13 % Н2O т.е. 34 г. Н2O.
Значит нужно добавить 372,6 – 4 = 368,6 г Н2O т.е. ~ 369 мл
Конечный состав силикаалюмогидрогеля равен:
2,5Na2O·Al2O3·2,1SiО2·60Н2О
цеолит синтез направленный кинетический
Список использованной литературы
1. Ахметов С.А. Технология и оборудование процессов переработки нефти и газа: Учебное пособие. – СПб.: Недра, 2006. – 868 с.
2. Караханов Э.А., Дедов А.Г. Каталитическое гидрирование гетероциклических соединений. – М.: Издательство Московского университета, 1986.
Вроцлавские химики под руководством профессора Мариана Рутковскского получили синтетический цеолит. Цеолиты – высокопористые минералы, обладающие ионообменными свойствами. Их широко применяют в химии, технике, промышленности, например, в абсорбционных холодильниках. Входят они и в состав современных стиральных порошков, не отравляющих окружающую среду, добавляют цеолиты и в лучшие сорта бумаги. Но залежи этих минералов есть не везде.
Новый метод производства синтетического цеолита основан на каолине – глинистом минерале, в изобилии имеющемся в Польше. Каолин сначала очищают отмучиванием, потом обжигают, превращая в метакаолинит, на который затем воздействуют щелочью.

На снимке, сделанном в растровом электронном микроскопе при увеличении в 3000 раз, показаны кристаллики искусственного цеолита.
В лаборатории приготовления катализаторов учреждения Российской академии наук института нефтехимии и катализа РАН создан ряд новых технологий получения микро - мезопористых кристаллических алюмосиликатных материалов, гранулы которых состоят из единых сростков кристаллов цеолитов типов LTА и FAU. Получаемые при этом адсорбенты по своим эксплуатационным характеристикам превосходят все известные аналоги. На основе гранулированного ультрастабильного микро-мезопористого цеолита типа FAU без связующих веществ разработан перспективный катализатор для процесса трансалкилирования бензола смесью диэтилбензолов в этилбензол.
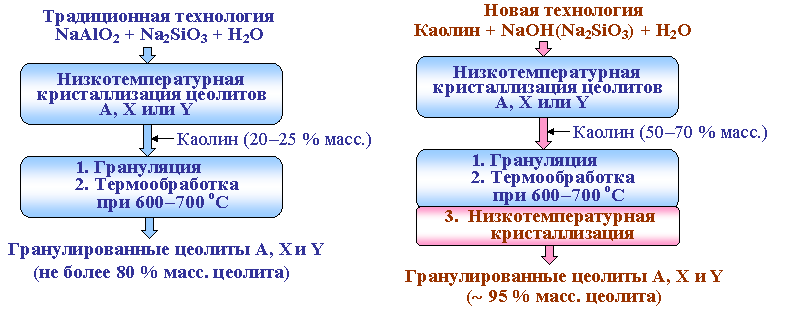
Блок схемы технологий приготовления гранулированных цеолитов
Исследовательская группа профессора Жийана Тиана (Zhijian Tian) из Далианского Института Химической Физики (Dalian Institute of Chemical Physics) Академии Наук Китая (Chinese Academy of Sciences) добилась исключительных результатов в синтезе цеолитов- алюмосиликатных членов семейства микропористых cоединений.
В недавних исследованиях специалисты из той же группы продемонстрировали успешное внедрение магния в структуру алюмофосфатных цеолитов, используя ионотермальный процесс, создав таким образом совершенно новый тип чистого кристаллического цеолита MAPO-11.
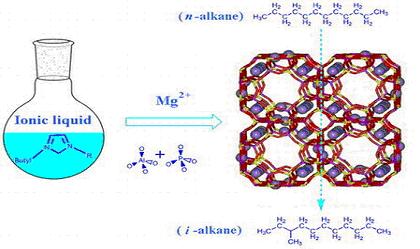
Схема синтеза цеолита MAPO-11
Результирующее вещество при поддержке платинового катализатора продемонстрировало отличную реактивность при гидроизомеризации гидрокарбонатов, что вселяет большие надежды на его коммерческую ценность.
Цеолиты можно получать из глины: сначала из нее удаляют тяжелые металлы; и другие примеси, нагревают до 100—200 градусов, после остывания промывают водой, высушивают и затем прокаливают при температуре 500 градусов.
В Японии уже не первый год делают цеолиты из рисовой мякины. В мире ежегодно накапливается около 400 миллионов тонн рисовой мякины, из них в Азии — девяносто процентов. Для получения цеолитов мякину, в которой содержится много кремнезема, сжигают, добавляют к золе глинозем и обрабатывают эту смесь так же, как глину. Но для этих процедур требуется немало энергии, а цеолит получается с примесями.
Одна японская фирма разработала более экономичную технологию. Мякину, не сжигая, смешивают с раствором нитрата алюминия и едкого натра, а затем обрабатывают в автоклаве. Продукт, получаемый при этом, обладает высокой степенью чистоты.
