
- •26.08.2011 Г. Протокол №1
- •Выписка из плана учебного процесса
- •Содержание
- •Введение
- •Сферы применения природных и синтетических цеолитов
- •1. Общие свойства и особенности структуры цеолитов
- •1.1 Химические составы природных цеолитов
- •1.2 Номенклатура цеолитов
- •1.3 Классификация цеолитов
- •1.4 Типы кристаллических решеток. Структуры цеолитов
- •Кристаллографические сингонии
- •Формы кристаллов
- •2 Краткие сведения о генезисе природных цеолитов.
- •3 Вода в минералах. Классификация. Вода в цеолитах
- •Измерения усредненных диффузией
- •4 Свойства цеолитов
- •4.1 Физические свойства цеолитов
- •4.2. Химические свойства цеолитов
- •5. Синтез цеолитов. Молекулярные сита
- •Синтезы порошкообразных цеолитов различных типов при кристаллизации алюмокремниевых гидрогелей
- •6. Ионный обмен. Ионный обмен на различных формах цеолитов
- •Цеолиты как ионообменники для защиты окружающей среды.
- •7. Адсорбция. Адсорбционные свойства цеолитов
- •Ионная адсорбция
- •Обманная адсорбция
- •Vpsa генераторы кислорода
- •8. Катализ. Использование цеолитов в качестве катализаторов
- •Типы катализаторов
- •Как работают катализаторы
- •Применение катализа в промышленности
- •9. Использование цеолитов в нефтяной и газовой промышленности Подготовка нефти и газа к транспорту
- •Основные способы отделения воды от нефти
- •Осушка газа молекулярными ситами
- •Экспериментальное исследование адсорбции нефтепродуктов в слое цеолитов б.С.Байзакова, к.К. Сырманова, ф.Е.Алтынбеков
7. Адсорбция. Адсорбционные свойства цеолитов
Адсорбция [лат. ad на, к + sorbere поглощать, всасывать] – поглощение вещества из раствора или газа поверхностным слоем жидкости или твердого тела; играет важную роль в биологических системах, широко применяется в химии и технике для разделения и очистки веществ.
Вещество,
которое адсорбирует другое вещество,
называют адсорбентом.
Название адсорбируемого вещества
зависит от его положения по отношению
к адсорбенту. Если вещество находится
в объеме и может адсорбироваться (его
химический потенциал равен
![]() ,
а
концентрация с),
то его называют адсорбтивом.
Это
же вещество в адсорбированном
состоянии (его химический потенциал
уже становится равным
,
а
концентрация с),
то его называют адсорбтивом.
Это
же вещество в адсорбированном
состоянии (его химический потенциал
уже становится равным
![]() ,
а
концентрация – сВ)
будет называться адсорбатом.
Иными
словами, для обозначения положения
адсорбируемого вещества используют
термины адсорбтив
(до
адсорбции)
и адсорбат
(после
адсорбции).
,
а
концентрация – сВ)
будет называться адсорбатом.
Иными
словами, для обозначения положения
адсорбируемого вещества используют
термины адсорбтив
(до
адсорбции)
и адсорбат
(после
адсорбции).
Молекулы (атомы, ионы, радикалы) адсорбата соприкасаются с поверхностью адсорбента и удерживаются на его поверхности. Поэтому
концентрация молекул на поверхности становится больше, чем в объеме соприкасающейся с ней жидкости или газа (см. рис. 4.1). Часть молекул с поверхности может перейти обратно в объем. Процесс, обратный адсорбции, называют десорбцией.
В зависимости от агрегатного состояния адсорбента и адсорбтива различают адсорбцию на границе твердого тела и газа (Т–Г), жидкости и газа (Ж–Г) и твердого тела и жидкости (Т–Ж).
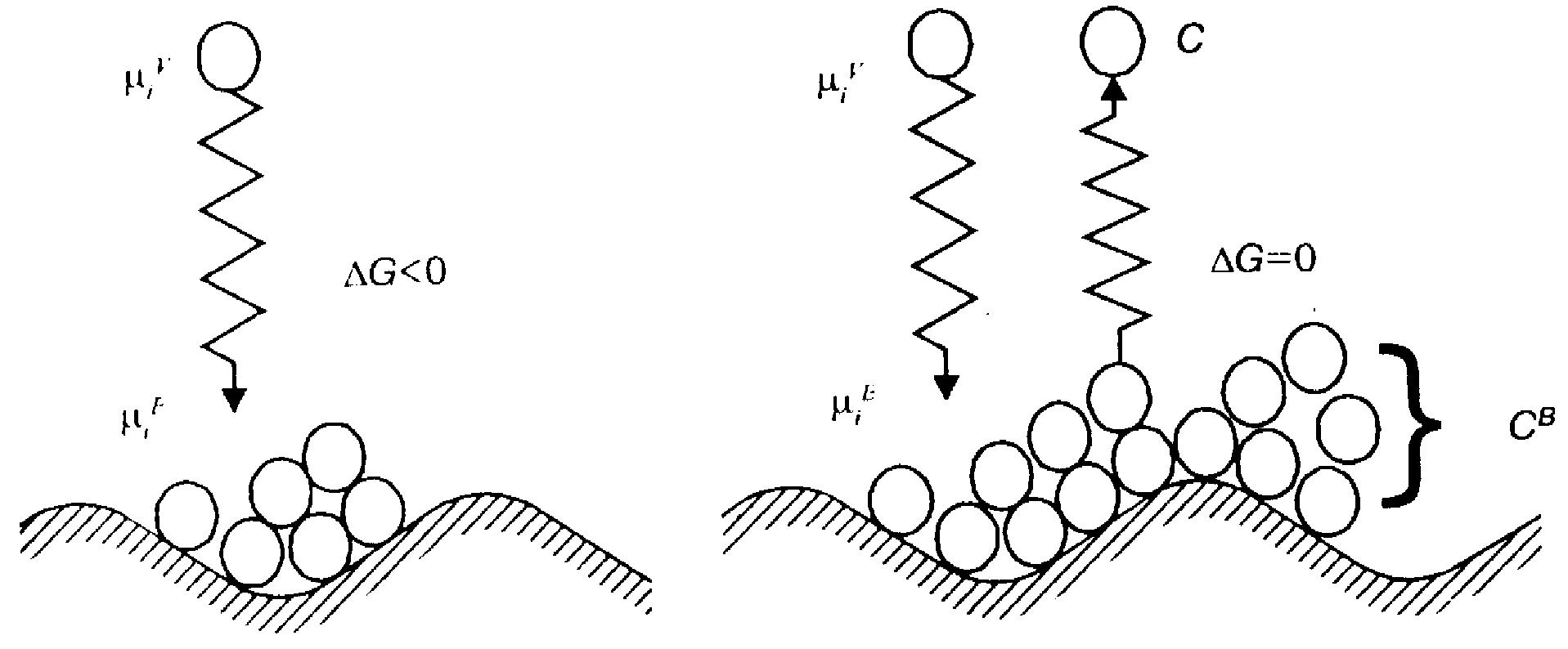
а б
Схема процесса адсорбции:
а
–
начальный момент (![]() ,
< 0);
,
< 0);
б
–
состояние равновесия (![]() ,
= 0);
,
= 0);
Ионная адсорбция
Адсорбция электролитов не укладывается в рамки учения о молекулярной адсорбции и требует специального рассмотрения, поскольку адсорбент может по различному адсорбировать ионы, на которые распадается молекула электролита в растворе. Так как наибольшее практическое значение имеют водные растворы электролитов, рассмотрим лишь адсорбцию электролитов из таких растворов.
На адсорбции ионов существенным образом сказывается природа адсорбента. Ионы, способные поляризоваться, адсорбируются обычно только на поверхностях, состоящих из полярных молекул или из ионов. Поэтому ионную адсорбцию часто называют также полярной адсорбцией. Микроучастки поверхности, несущие определенный заряд, адсорбируют противоположно заряженные ионы. При этом ионы электролита, несущие противоположный знак, непосредственно не адсорбируются, но под действием сил электростатического притяжения остаются вблизи адсорбированных ионов, образуя с ними на поверхности адсорбента так называемый двойной электрический слой. Строение этого слоя подробно рас смотрено в гл. VII, посвященной электрическим свойствам коллоидных частиц.
Радиус ионов сильно влияет на их способность адсорбироваться. Из ионов одинаковой валентности максимальную адсорбционную способность проявляют ионы наибольшего радиуса. Причина этого явления, с одной стороны, заключается в большой поляризуемости таких ионов и, следовательно, их способности притягиваться поверхностью, состоящей из ионов или полярных молекул, с другой стороны, в меньшей гидратации ионов (чем больше радиус иона, тем меньше при одном и том же заряде его гидратация). Гидратация вообще препятствует адсорбции ионов, так как наличие гидратной оболочки уменьшает электрическое взаимодействие.
Различие в гидратации одновалентных катионов иллюстрирует схема, приведенная на рисунке:
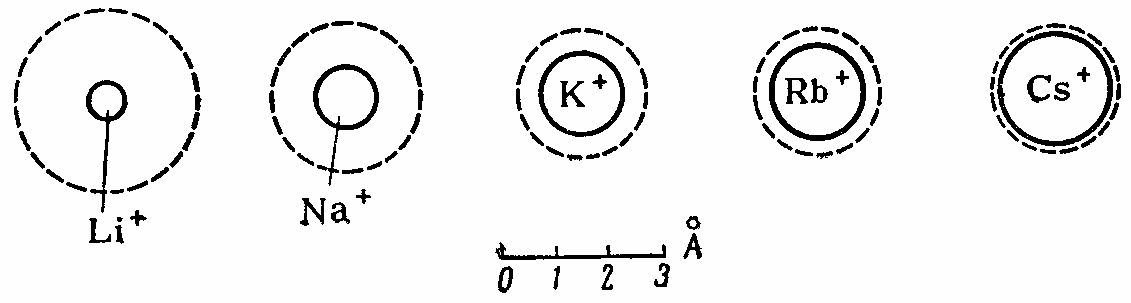
Соотношение между истинными радиусами одновалентных катионов и их радиусами в гидратированном состоянии.
Сплошная линия обозначает границу самого иона, а пунктирная – границу его гидратной оболочки. Из схемы видно, что ион лития гораздо более гидратирован, чем ион цезия. Ряды ионов, составленные в порядке уменьшения их способности связывать среду, называются лиотропными рядами, или рядами Гофмейстера.
Одновалентные катионы можно поставить в следующий ряд по возрастающей способности адсорбироваться:
Li+ <Na+ <K+ <Rb+ < Cs+
Для двухвалентных катионов это будет следующий ряд:
Mg2+ < Са2+ < Sr2+ <Ва2+
Одновалентные анионы по их возрастающей способности адсорбироваться располагаются в такой последовательности:
Сl– < Br– < NO3– < I– < NCS–
Адсорбционная способность ионов весьма сильно зависит также от их валентности. Чем больше валентность иона, тем сильнее он притягивается противоположно заряженными микроучастками поверхности.
Катионы различной валентности по их возрастающей адсорбционной способности можно расположить в следующий ряд:
К+<< Са2+ << А13+ << Th4+
Особый интерес для коллоидной химии представляет адсорбция ионов поверхностью кристалла, в состав которого входят ионы той же природы. При этом адсорбцию можно рассматривать как кристаллизацию, т. е. как достройку кристаллической решетки способным адсорбироваться ионом. Согласно Пакету и Фаянсу, кристаллы достраиваются лишь теми ионами или атомами, которые входят в их состав. Например, кристаллы AgI, внесенные в раствор KI, адсорбируют на поверхности иодид-ионы. Если же кристаллы AgI внести в раствор AgNO3, то происходит адсорбция ионов серебра. Понятно, что силы, под влиянием которых происходит такая достройка, являются химическими и одновременно электростатическими силами, и ионы, достраивающие кристалл, адсорбируются в этом случае особенно прочно. Ниже показана схема достройки кристалла иодида серебра в растворе иодида калия (первоначальная граница кристалла AgI обозначена на схеме пунктиром).

Достройка кристалла иодида серебра в растворе иодида калия
Существенно, что достраивать кристаллическую решетку способны не только ионы, входящие в состав решетки, но и изоморфные с ними. Важно также, что образовать прочную связь с поверхностью кристалла могут не только ионы, входящие в кристаллическую решетку, но и вообще атомные группы, близкие к атомным группам, находящимся на поверхности. Так, уголь прочно удерживает органические радикалы, а окиси и гидраты окисей алюминия и железа прочно связывают группы, содержащие кислород.
На поверхности адсорбента могут адсорбироваться как ионы, так и молекулы, из которых они образовались, причем между первыми и последними существует адсорбционное равновесие. Наличие молекулярной формы адсорбированного электролита на поверхности коллоидных частиц было показано в работах В. А. Каргина на примере ферри- и алюмо-золей.
