
- •Методические указания к практическим занятиям
- •Новороссийск
- •Классификация кислот
- •Названия кислот
- •Способы получения кислот
- •Производство серной кислоты контактным методом
- •Производство Азотной кислоты
- •Производство ортофосфорной кислоты
- •Производство соляной кислоты
- •1 Хлороводород; 2 вата.
- •Диссоциация кислот
- •Свойства кислот
- •Химические свойства
- •Нельзя вливать воду в концентрированную серную кислоту !!!
- •Кислые дожди (кислотные дожди, кислые осадки)
- •***Дополнительно***
- •Классификация кислородсодержащих кислот по их силе в водных растворах
- •Кислоты
- •Нельзя вливать воду в концентрированную серную кислоту !!!
- •Разложение нитратов при нагревании
- •Тривиальные названия химических соединений
- •Окраска пламени газовой горелки при внесении анализируемого вещества на предварительно прокаленной палочке или проволочке
- •Качественные реакции на катионы и анионы
- •Гидроксиды (основания)
- •Названия оснований
- •Классификация оснований
- •Получение оснований
- •Свойства оснований
- •Диссоциация оснований
- •Химические свойства
- •Дополнительно
- •Вопросы для подготовки к занятию
Производство Азотной кислоты
Получение. В лаборатории азотную кислоту получают действием концентрированной серной кислоты на кристаллический нитрат натрия или калия при небольшом нагревании:
NaNO3 + H2SO4 t NaHSO4 +HNO3
При более сильном нагревании образуется сульфат натрия, но в этих условиях азотная кислота разлагается.
В промышленности, азотную кислоту получают окислением аммиака кислородом воздуха в присутствии катализатора. Для ознакомления с этим методом можно воспользоваться прибором (рис. 3).
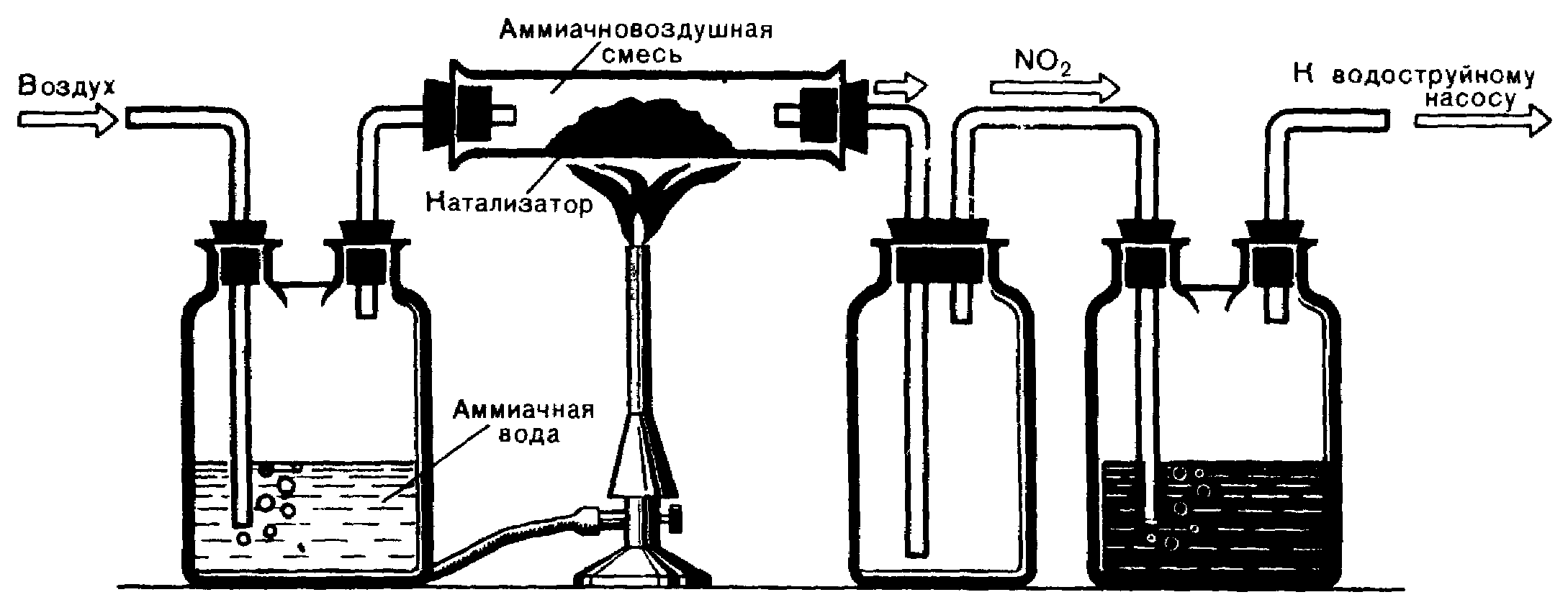
Рисунок 3 – Получение азотной кислоты окислением
аммиака кислородом воздуха.
При пропускании струи воздуха, к которому добавлен кислород, через 10 – 12 %-ный аммиачный раствор образуется смесь аммиака с воздухом. В трубке под действием катализатора (смесь порошкообразного оксида хрома (III) или оксида марганца (IV) с асбестом) происходит окисление аммиака, и образовавшийся оксид азота (IV) поглощается в колбе водой, в которую добавлен индикатор.
Процесс получения азотной кислоты в промышленности протекает в несколько стадий (рис. 4): 1) подготовка аммиачно-воздушной смеси; 2) окисление аммиака до оксида азота (II), 3) окисление оксида азота (II) до оксида азота (IV); 4) поглощение оксида азота (IV) водой и получение азотной кислоты.
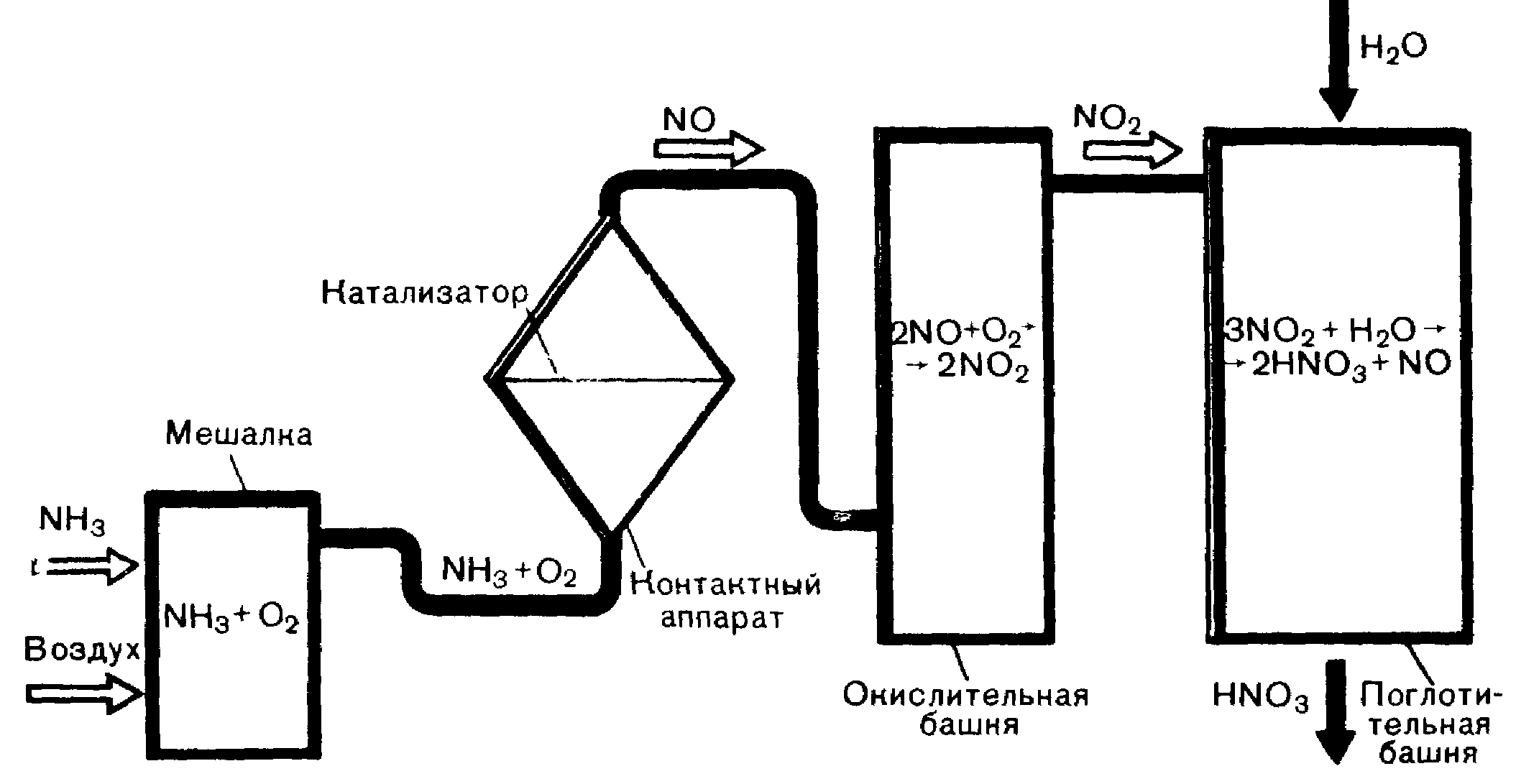
Рисунок 4 – Схема получения азотной кислоты в промышленности
Аммиачно-воздушную смесь получают непосредственным перемешиванием аммиака с воздухом, предварительно очищенного от примесей. Эта смесь поступает в контактный аппарат (рис. 5), где под влиянием катализатора (платинородиевые сетки) происходит окисление аммиака:
4NH3 + 5O2 = 4NO + 6H2O + Q
Так как эта реакция экзотермическая, то необходимая температура поддерживается за счет выделяемой теплоты. Подогревание требуется только перед пуском аппарата.
Аммиачно-воздушная смесь









Нитрозные газы
Рисунок 5 – Контактный аппарат.
Окисление оксида азота (II) до оксида азота (IV) происходит при обычной температуре:
2NO + O2 2NO2
Поэтому выходящую из контактного аппарата газовую смесь, содержащую оксид азота (IV), охлаждают, пропуская ее в паровой котел-утилизатор, где получают водяной пар.
Газовую смесь, содержащую оксид азота (IV), направляют в поглотительную башню, которая для увеличения поверхности соприкосновения газа с водой заполнена фарфоровыми кольцами. Вода в башню поступает сверху, а газовая смесь, содержащая оксид азота (IV) – снизу (принцип противотока).
Реакция протекает так:
3NO2 + H2O 2HNO3 + NO
При избытке кислорода реакция протекает без выделения оксида азота (II):
4NO2 +2H2O 4HNO3 + Q
Реакция оксида азота (IV) с водой экзотермическая и обратимая. Это объясняется тем, что азотная кислота при нагревании разлагается. Поэтому на обычных установках удается получить раствор невысокой концентрации, содержащий только 0,50 – 0,60 массовых долей, или 50 – 60 %, азотной кислоты. Чтобы сместить равновесие вправо, увеличивают давление. На некоторых заводах при давлении около 5 МПа получают концентрированный раствор, содержащий 0,98 массовых долей, или 98 %, азотной кислоты.
