
- •Методические указания к практическим занятиям
- •Новороссийск
- •Классификация кислот
- •Названия кислот
- •Способы получения кислот
- •Производство серной кислоты контактным методом
- •Производство Азотной кислоты
- •Производство ортофосфорной кислоты
- •Производство соляной кислоты
- •1 Хлороводород; 2 вата.
- •Диссоциация кислот
- •Свойства кислот
- •Химические свойства
- •Нельзя вливать воду в концентрированную серную кислоту !!!
- •Кислые дожди (кислотные дожди, кислые осадки)
- •***Дополнительно***
- •Классификация кислородсодержащих кислот по их силе в водных растворах
- •Кислоты
- •Нельзя вливать воду в концентрированную серную кислоту !!!
- •Разложение нитратов при нагревании
- •Тривиальные названия химических соединений
- •Окраска пламени газовой горелки при внесении анализируемого вещества на предварительно прокаленной палочке или проволочке
- •Качественные реакции на катионы и анионы
- •Гидроксиды (основания)
- •Названия оснований
- •Классификация оснований
- •Получение оснований
- •Свойства оснований
- •Диссоциация оснований
- •Химические свойства
- •Дополнительно
- •Вопросы для подготовки к занятию
Дополнительно
Основание это соединение, при растворении которого увеличивается концентрация отрицательных ионов растворителя.
Концентрация отрицательных ионов растворителя может увеличиваться также за счет растворения некоторых соединений содержащих соответствующие радикалы. Из этих соединений лучше всего диссоциируют щелочи. В водных растворах щелочами являются гидроксиды KОН, Ba(OH)2, в жидком аммиаке к щелочам относятся дигидронитриды KNH2, Ba(NH2)2 .
Электронная теория. Согласно электронной теории, разработанной Льюисом, основание это соединение, поставляющее электронные пары для образования химической связи, донор электронных пар; кислота вещество, принимающее электронные пары, акцептор электронных пар, кислотно-основное взаимодействие. согласно электронной теории, заключается в образовании донорно-акцепторной связи. В результате взаимодействия кислоты с основанием образуются солеподобные вещества, называемые аддуктами, Часто (но не всегда) их удается выделить как индивидуальные соединения.
Ниже приведено несколько примеров реакций, которые, согласно электронной теории, представляют кислотно-основное взаимодействие:
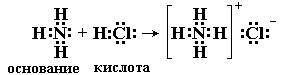
![]()
![]()
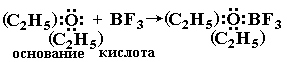
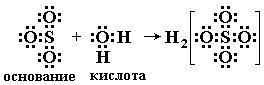
![]()
Таким образом, электронная теория Льюиса рассматривает нейтрализацию в водных растворах, взаимодействие аминов с галогенидами бора, комплексообразование, реакции ангидридов с водой как сходные процессы. Вещества, являющиеся донорами электронных пар, называют основаниями Льюиса, а акцепторы электронных пар кислотами Льюиса.
К основаниям Льюиса относятся галогенид-ионы, вещества, содержащие аминный азот (аммиак, алифатические и ароматические амины, пиридин и т. п.), кислородсодержащие соединения общей формулы R2CO, где R - органический радикал или атом галогена.
кислотами Льюиса являются галогениды бора, алюминия, кремния, олова, фосфора, мышьяка, сурьмы и, многих других элементов, ионы-комплексообразователи Ag+, Co3+, Cr3+ , Pt2+, и др.
Многие аддукты находят практическое применение. Например, широко используемый в качестве катализатора в органических синтезах BF3 часто вводят в реакцию в виде «эфирата» (C2H5)2O:BF3. С твердым солеподобным эфиратом удобнее работать, чем с газообразным BF3.
Вопросы для подготовки к занятию
Что образуется при сливании водных растворов солей сульфида натрия и хлорида алюминия [(нитрата железа (III) и карбоната натрия; сульфата хрома (III) и сульфида натрия]? Напишите уравнение реакции в молекулярном и ионном виде.
Растворы каких веществ надо слить для получения осадка Ag2CrO4 (BaSO4, CuS, PbSO4, CaCO3, AgCl) . Напишите уравнение реакции в молекулярном и ионном виде.
Сливают растворы гидрокарбоната натрия и гидроксида натрия, сульфата натрия и гидроксида калия, нитрата свинца (II) и сульфата натрия, гидроксохлорида цинка и соляной кислоты, хлорида меди (II) и карбоната натрия, сульфата калия ихлорида алюминия. В каких случаях и почему произойдет реакция? Ответ подтвердите уравнением реакций в молекулярном и ионном виде.
К растворам каждого из веществ NaCl, NiSO4, Be(OH)2, HNO2, AlCl3, h3po4, k2so4, naHS прилили избыток раствора NaOH. В каких случаях и почему произойдет реакция? Ответ подтвердите уравнением реакций в молекулярном и ионном виде.
Напишите уравнения реакций воды с металлом, неметаллом, оксидом, солью. Укажите тип каждой реакции.
Напишите уравнение реакции получения хлора из HCl. Составьте ионно-электронный баланс укажите окислитель и восстановитель.
Почему хлорная вода имеет кислую среду? Ответ подтвердите уравнениями реакции, назовите продукты реакции, составьте электронно-ионный баланс, укажите окислитель и восстановитель.
Напишите уравнения реакций, в которых сера проявляет свойства окислителя, восстановителя, окислительно-восстановительную двойственность. Составьте ионно-электронный баланс.
Напишите уравнения реакций, доказывающих окислительно-восстановительную двойственность сульфита натрия. Составьте ионно-электронный баланс, укажите окислитель и восстановитель.
Напишите уравнения реакций, взаимодействия цинка с разбавленной и концентрированной серной кислотой. Составьте ионно-электронный баланс, укажите окислитель и восстановитель.
Напишите уравнение реакции концентрированной серной кислоты с углеродом (медью). Составьте ионно-электронный баланс, укажите окислитель и восстановитель.
Почему азотная кислота проявляет свойства окислителя? Напишите уравнения реакций, взаимодействия железа с разбавленной азотной кислотой, а цинка с концентрированной азотной кислотой. Составьте ионно-электронный баланс
Какие соли образует ортофосфорная кислота при взаимодействии с гидроксидом натрия? Напишите молекулярные и ионные уравнения, назовите полученные соли. Какова кислотность среды в растворе каждой соли?
Через суспензию карбоната кальция в воде пропускают ток диоксида углерода, раствор становится прозрачным. Какими способами можно вновь осадить исходное вещество? Приведите уравнения протекающих реакций в молекулярном и ионном виде.
литература
Современный словарь иностранных слов: /Изд-во «Рус. яз.» М.: Рус. яз., 1993 740 с.
Толковый словарь по химии и химической технологии. Основные термины / С. М. Баринов, Б. Е. Восторгов и др. Под редакцией Ю.А. Лебедева – М.: Рус. яз., 1987 528 с.
Коровин Н. В. Общая химия – М.: Высш. шк., 2003. – 557 с.
Ахметов Н. С. Общая и неорганическая химия: Учебник для вузов. М.; Высш. школа, 1981. 679 с., ил.
Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия М.: Химия, 1981, 632с.
Фролов В. В. Химия: Учеб. пособие для машиностроит. спец. вузов. – 3-е изд., перераб. и доп. – М.: Высш. шк., 1986. - 543 с., ил.
новошинская Н. С., новошинский И. И. Общая химия: методическое пособие для школьников, абитуриентов и студентов – Краснодар: Советская Кубань, 1997 – 208 с.
Павлов Н. Н. Неорганическая химия: Учеб. для технол. спец. вузов. М.: Высш. шк., 1986. 336 с., ил.
