
- •1 Оптическое излучение. Диапазон оптических волн.
- •2 Энергетические параметры оптического излучения
- •3 Световые параметры оптического излучения
- •4 Гипотеза планка квантовая теория света
- •5 Фотон энергия фотона
- •6 Масса фотона
- •7 Импульс фотона
- •8 Теория Бора о строении атома водорода. (постулаты Бора)
- •9 Гипотеза де Бройля. (волны де Бройля)
- •10 Особенности описания поведения микрочастиц (Волновой пакет).
- •11 Соотношения неопределенностей Гейзенберга
- •12 Волновая функция.
- •13 Уравнение Шредингера, его особенности
- •14 Амплитудная волновая функция. Амплитудное уравнение Шредингера.
- •15 Главное квантовое число
- •16 Орбитальное квантовое число
- •17 Магнитное квантовое число
- •18 Спиновое квантовое число
- •19 Принцип Паули
- •20 Квантовые переходы
- •22 Спонтанные квантовые переходы
- •23 Вынужденные квантовые переходы
- •24 Коэффициент Эйнштейна для вынужденных квантовых переходов
- •25 Оптические спектры
- •26 Ширина спектральной линии
- •27 Причины, приводящие к уширению спектральных линий
- •28 Спектр испускания и спектр поглощения
14 Амплитудная волновая функция. Амплитудное уравнение Шредингера.
Потенциальная энергия, входящая в уравнение Шредингера, является в общем случае функцией координат и времени. Однако во многих практически важных задачах потенциальная энергия является функцией только координат и не зависит от времени. Для таких задач волновую функцию можно представить в виде:
, (18)
где Е – полная энергия микрочастицы.
Функция
 ,
зависящая только от координат, называется
амплитудой
волновой функции.
Ее можно найти из уравнения
,
зависящая только от координат, называется
амплитудой
волновой функции.
Ее можно найти из уравнения
 , (19)
, (19)
которое называется амплитудным уравнением Шредингера.
Силовое поле, в котором потенциальная энергия микрочастицы не зависит от времени, называется стационарным. Состояния микрочастиц в стационарном поле называются стационарными состояниями. Т.е. амплитудное уравнение Шредингера описывает стационарные уравнения микрочастиц.
Каждое состояние микрочастицы описывается одной волновой функцией. Если уравнение Шредингера допускает решение в виде нескольких волновых функций, то это означает, что микрочастица может находиться в нескольких различных состояниях.
15 Главное квантовое число
Главное
(радиальное) квантовое
число — целое
число,
обозначающее номер энергетического
уровня.
Характеризует энергию электронов,
занимающих данный энергетический
уровень.
Является первым в ряду квантовых чисел,
который включает в себя
главное, орбитальное и магнитное квантовые
числа, а также спин.
Эти четыре квантовых числа определяют
уникальное состояние электрона в атоме (его волновую
функцию).
Главное квантовое число обозначается
как ![]() .
При увеличении главного квантового
числа возрастают радиус орбиты и энергия
электрона.Главное квантовое число равно
номеру периода элемента.
.
При увеличении главного квантового
числа возрастают радиус орбиты и энергия
электрона.Главное квантовое число равно
номеру периода элемента.
Наибольшее
число электронов на энергетическом
уровне с учётом спина электрона
определяется по формуле ![]()
16 Орбитальное квантовое число
Орбитальный момент количества движения L электрона может принимать лишь следующий ряд дискретных значений
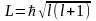 , (24)
, (24)
где  - орбитальное квантовое число, которое
может принимать любое значение из
следующего ряда
- орбитальное квантовое число, которое
может принимать любое значение из
следующего ряда
 .
.
17 Магнитное квантовое число
Вектор
орбитального момента количества движения
может ориентироваться относительно
вектора напряженности внешнего магнитного
поля
 лишь так, что его проекция на направление
вектора
может быть только кратной величине
,
т.е.
лишь так, что его проекция на направление
вектора
может быть только кратной величине
,
т.е.
 . (25)
. (25)
Число
 называется магнитным квантовым числом.
Оно может принимать все целочисленные
значения от
называется магнитным квантовым числом.
Оно может принимать все целочисленные
значения от
 до
,
включая 0:
до
,
включая 0:

всего
 значений.
значений.

Пусть
 ,
тогда
,
тогда
 ,
т.е. имеет три значения, тогда вектор
орбитального момента количества движения
ориентирован так, как показано на рис.5.
,
т.е. имеет три значения, тогда вектор
орбитального момента количества движения
ориентирован так, как показано на рис.5.
18 Спиновое квантовое число
Подобно массе и заряду, спин является первичным, неотъемленным свойством электрона (и других частиц), не имеющий аналогов в макромире.
На основании экспериментальных результатов доказано, что спин электрона по абсолютной величине равен:
 , (26)
, (26)

а его проекция на направление внешнегомагнитного поля (рис.6) может иметь лишь два значения
 (27)
(27)
или  ,
где
,
где
 называется спиновым квантовым числом,
которое у электрона может принимать
лишь два значения:
называется спиновым квантовым числом,
которое у электрона может принимать
лишь два значения:
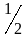 и -
.
и -
.
Итак,
с
учетом наличия у электрона спина его
состояние в водородоподобном атоме
задается четырьмя квантовыми числами:
главным
 ,
орбитальным
,
магнитным
и спиновым
.
Энергия же электрона, зависит лишь от
значения
.
,
орбитальным
,
магнитным
и спиновым
.
Энергия же электрона, зависит лишь от
значения
.
Интернет
Для объяснения тонкой структуры спектральных линий, а также ряда других трудностей в атомной физике американские физики Д. Уленбек (1900—1974) и С. Гаудсмит (1902—1979) предположили, что электрон обладает собственным неуничто
Спин электрона (и всех других микрочастиц) — квантовая величина, у нее нет классического аналога; это внутреннее неотъемлемое свойство электрона, подобное его заряду и массе.
Если электрону приписывается собственный механический момент импульса (спин) Ls, то ему соответствует собственный магнитный момент рms. Согласно общим выводам квантовой механики, спин квантуется по закону
![]()
где s — спиновое квантовое число.
По аналогии с орбитальным моментом импульса, проекция Lsz спина квантуется так, что вектор Ls может принимать 2s+1 ориентации. Так как в опытах Штерна и Герлаха наблюдались только две ориентации, то 2s+1=2, откуда s= ½ жимым механическим моментом импульса, не связанным с движением электрона в пространстве, спином (см. §131).
