
- •Работа 1. Общие свойства коллоидных систем
- •Коагуляция коллоидов.
- •Изменение скорости коагуляции.
- •Механизм коагулирующего действия электролитов.
- •Задание 1. Получение гидрофобных золей а) получение золя гидроокиси железа гидролизом.
- •Данные по определению приближенного значения
- •Пороги коагуляции золя различными электролитами
- •Работа 2. Поверхностное натяжение растворов пав
- •Измерение поверхностного натяжения методом счета капель
- •Работа 3. Адсорбция поверхностно-активных веществ из водных растворов
- •Работа 4. Седиментационный анализ суспензий.
- •Работа № 5. Получение пен и исследование их устойчивости
- •Работа 6. Структурно-механические свойства дисперсных систем
Работа 3. Адсорбция поверхностно-активных веществ из водных растворов
Цель работы: определение основных характеристик поверхностного слоя на границе раствор — воздух и определение геометрических характеристик адсорбционного слоя.
Зависимость между изменением свободной поверхностной энергии на поверхности раствора и концентрацией вещества в поверхностном слое, т. е адсорбцией на границе раздела фаз, выражена уравнением Гиббса:
![]()
где Г — избыток вещества в моль на 1 см2 поверхности раздела;
а — активность растворенного вещества в растворе;
R— газовая постоянная, равная 8,31 • 107. эрг/моль-град (8,31 • 103 дж/кмоль-град)
Т — абсолютная температура.
Для разбавленных растворов можно принять, что величина a равна концентрации C, а следовательно:
![]() (3.1)
(3.1)
Это фундаментальное уравнение, являясь приложением второго начала термодинамики к поверхностям раздела фаз, дает количественное выражение для распределения растворенного вещества между объемом и поверхностным слоем в результате самопроизвольных процессов, приводящих к уменьшению свободной поверхностной энергии.
По величине поверхностной активности вещества делятся на:
1)
поверхностно-активные вещества (ПАВ),
которые понижают поверхностное
натяжение (![]() <
0), их адсорбция (Г) положительна;
<
0), их адсорбция (Г) положительна;
2) поверхностно-инактивные, которые повышают , оно возрастает при повышении концентрации, их адсорбция отрицательна ( > 0).
Величина производной, взятая с отрицательным знаком, называется поверхностной активностью и обозначается буквой g
![]()
Поверхностная активность является мерой способности растворенного вещества понижать поверхностное натяжение и переходить из объема в поверхностный слой, т. е. адсорбироваться. Из уравнения Гиббса видно, что адсорбция Г прямо пропорциональна поверхностной активности g при данной температуре и концентрации веществ в растворе.
Уравнение Гиббса позволяет построить кривую зависимости Г от с на основании измерений поверхностного натяжения растворов различной концентрации. Для этого по данным опыта строят кривую – С и находят для отдельных значений С производные, проводя касательные и измеряя тангенсы углов наклона. По этим данным вычисляют значения Г. Следует отметить, что крутизна наклона характеризует поверхностную активность.
Другой путь, более распространенный, хотя и менее точный, состоит в вычислении конечных разностей величин поверхностного натяжения 1 и 2, измеренных при двух различных концентрациях С1 и С2. Эти разности 2 - 1=∆ и С2 – Сl = ∆С подставляют в уравнение Гиббса:
![]() (3.2)
(3.2)
(в качестве С в
этом случае подставляют среднее
арифметическое
![]() ).
).
Определение разностей и ход зависимости вычисленных значений Г от С показывает рис. 3.1.
Уравнение Гиббса Г = f(,C) не дает однозначного выражения для функции Г = f(с), т. е. для изотермы адсорбции, так как термодинамическое описание системы, включающей поверхность раздела, содержит не менее 3 переменных (в данном случае , С, Г) по условию равновесия, выражаемому уравнением Гиббса. Для исключения одной из независимых переменных (например, ) необходимо наложить дополнительное условие, которое может быть получено при помощи молекулярной теории. Таким условием является, например, то или иное представление о строении поверхностного слоя. В первом приближении можно считать, что на границе раствор — воздух и во многих случаях, на границе, раствор — твердое тело поверхностный слой является мономолекулярным, так как поле молекулярных сил твердого тела в основном экранируется первым слоем молекул. Молекулы ПАВ имеют резко выраженное асимметрическое строение и содержат как полярные (гидрофильные), так и неполярные (гидрофобные) группы. Вследствие такой асимметричности строения молекулы, находясь в поверхностном слое, ориентируются таким образом, что их гидрофильная группа обращена к воде, а гидрофобная - к воздуху или вообще к менее полярной среде: гидрофильные группы – NH2, ОН, SH, СООH и др.; гидрофобные - углеводородные цепи или циклы. По мере того, как молекулы ПАВ все более и более тесно располагаются на поверхности, уменьшается поверхностное натяжение на этой поверхности. С дальнейшим ростом концентрации молекулы принимают вертикальную ориентацию, занимая минимальную площадь в поверхностном слое, приобретающем свойства двухмерной ориентированной структуры анизотропной жидкости или твердого тела.
Дальнейшее
увеличение числа молекул в поверхностном
слое невозможно, следовательно, с
ростом концентрации вещества в
растворе наступает предел адсорбции.
Предельное число молей вещества,
а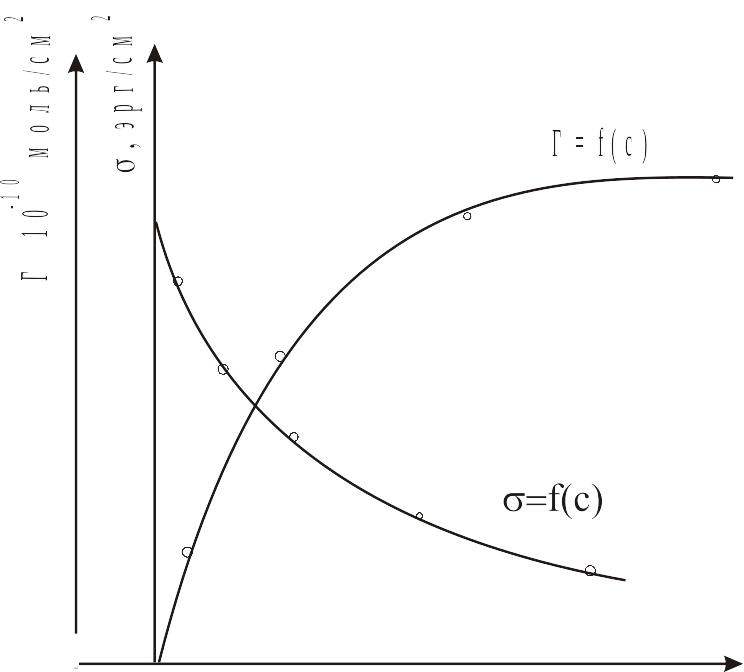 дсорбированных
на 1 см2
поверхности раздела, обозначают Г.
Исходя из представления о мономолекулярности
слоя, Ленгмюр вывел следующее выражение
для изотермы адсорбции:
дсорбированных
на 1 см2
поверхности раздела, обозначают Г.
Исходя из представления о мономолекулярности
слоя, Ленгмюр вывел следующее выражение
для изотермы адсорбции:
![]() (3.3)
(3.3)
В этом уравнении величины Г и Г обозначают не избыточное, а полное количество ПАВ в 1 см2 поверхностного слоя. Однако для разбавленных растворов этим различием можно пренебречь. Уравнение содержит две константы Г и k. Константа k является константой равновесия; в рамках молекулярно-кинетической теории она представляет собой отношение констант скоростей процессов адсорбции и десорбции, термодинамически она характеризует работу адсорбции, равную RT Ink. Константа зависит от природы растворенного вещества и характеризует его поверхностную активность.
Уравнение Лэнгмюра хорошо согласуется с данными опыта и правильно отражает ход кривой Г=f(с), а именно: при малых концентрациях (kC<<1) уравнение дает прямую пропорциональность между адсорбцией Г и концентрацией C; при больших концентрациях (kC>>1) уравнение приводит к предельному значению адсорбции Г = Г. Уравнение (3.3) позволяет вычислить константы, в частности величину Г являющуюся важнейшей характеристикой, позволяющей вычислить размеры адсорбируемых молекул.
Для нахождения констант следует решить систему уравнений с двумя неизвестными, написанную для двух растворов различной концентрации (С1 и С2):
![]() ;
;
![]()
Разделив одно уравнение на другое, получим:
![]()
Решая подобные системы для различных пар (например, для пяти растворов различной концентрации можно составить 10 различных пар), находят значения k, берут среднее и, подставляя его во все исходные уравнения, получают значения Г, из которых вычисляют среднее арифметическое.
Другой способ вычисления констант предполагает использование графического метода. Для этого преобразуют уравнение (3.3) так, чтобы получить уравнение прямой, например, делят С на обе части уравнения. После сокращения получают
![]()
т.е. уравнение типа y=a+bx.
В координатах (С/Г, С) уравнение отвечает прямой, не проходящей через начало координат. Величину, Г определяют по углу наклона прямой, а именно:
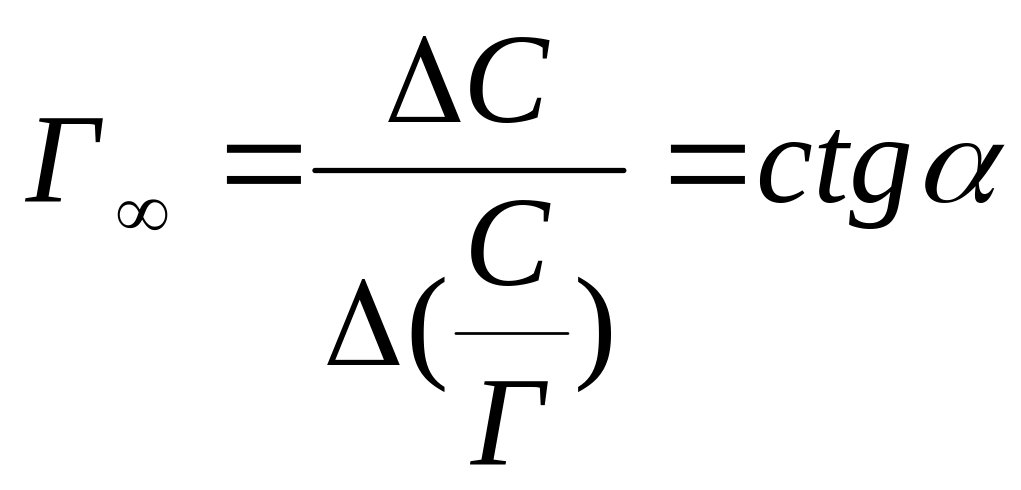
Построив график
![]() ,
находят разности величин ∆С и ∆(С/Г),
,
находят разности величин ∆С и ∆(С/Г),
отвечающие отрезкам
на графике (рис. 3.2), и вычисляют Г.
По отрезку
![]() отсекаемому
на оси ординат, можно, определив Г,
найти вторую константу k.
отсекаемому
на оси ординат, можно, определив Г,
найти вторую константу k.
П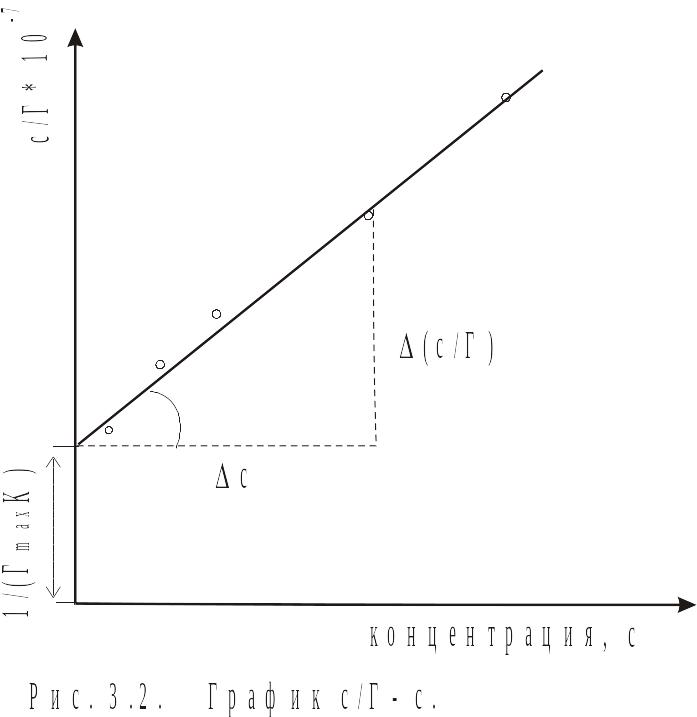 ользуясь
изложенными представлениями о плотнейшей
упаковке молекул в монослое при
предельной адсорбции, можно вычислить
площадь, занимаемую одной молекулой,
т.е. поперечное сечение молекулы. Для
этого надо разделить величину площади
на число молекул; на площади 1 см2,
согласно определению величины Г,
адсорбируются Г молей или ГN
молекул (где N — число Авогадро).
Следовательно, площадь занимаемая одной
молекулой:
ользуясь
изложенными представлениями о плотнейшей
упаковке молекул в монослое при
предельной адсорбции, можно вычислить
площадь, занимаемую одной молекулой,
т.е. поперечное сечение молекулы. Для
этого надо разделить величину площади
на число молекул; на площади 1 см2,
согласно определению величины Г,
адсорбируются Г молей или ГN
молекул (где N — число Авогадро).
Следовательно, площадь занимаемая одной
молекулой:
![]()
Можно также вычислить толщину поверхностного слоя , иначе говоря, осевую длину ориентированной молекулы. Массу вещества, адсорбированного на 1 см2, с одной стороны, можно определить, как число молей Г, умноженное на молекулярный вес:
d = ГM
где d – плотность вещества ПАВ
Таким образом:
![]()
Практическая часть
Задание 1. Вычисление изотермы адсорбции
По полученным в предыдущей работе (определение поверхностного натяжения растворов ПАВ методом сталагмометра) данным вычисляют значения Г, располагая данные и вычисления по следующей форме:
Таблица 3.1
Результаты измерений поверхностного натяжения и вычисления изотермы адсорбции
С |
|
∆С |
∆ |
∆/∆С |
Сср |
Г*10-10 |
Сср/Г*10-7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Результаты вычислений наносят на кривую Г– Сср и вычисляют величину предельной адсорбции Г графическим методом из кривой С/Г–Сср или расчетным методом. Вычисляют площадь, занимаемую молекулой в поверхностном слое и толщину слоя .
СОДЕРЖАНИЕ И ОФОРМЛЕНИЕ ОТЧЕТА ПО РАБОТЕ
Отчет по работе содержит название, цели, краткое описание работы и выводы о структуре адсорбционного слоя. Экспериментальные данные оформляются графически и заносятся в табл. 3.1.
Контрольные вопросы по работе 3.
1. Укажите природу констант в уравнении Ленгмюра и методы их определения.
2. Дайте определение предельной адсорбции в теории мономолекулярной адсорбции. В чем заключаются графические методы определения величины предельной адсорбции.
