
- •Работа 1. Общие свойства коллоидных систем
- •Коагуляция коллоидов.
- •Изменение скорости коагуляции.
- •Механизм коагулирующего действия электролитов.
- •Задание 1. Получение гидрофобных золей а) получение золя гидроокиси железа гидролизом.
- •Данные по определению приближенного значения
- •Пороги коагуляции золя различными электролитами
- •Работа 2. Поверхностное натяжение растворов пав
- •Измерение поверхностного натяжения методом счета капель
- •Работа 3. Адсорбция поверхностно-активных веществ из водных растворов
- •Работа 4. Седиментационный анализ суспензий.
- •Работа № 5. Получение пен и исследование их устойчивости
- •Работа 6. Структурно-механические свойства дисперсных систем
Министерство образования и науки РФ
Федеральное агентство по образованию
Саратовский государственный
технический университет
Физико-химическая механика гетерогенных структур
Методические указания
к выполнению лабораторных работ и контрольных заданий по дисциплине «Физико-химическая механика гетерогенных структур» для студентов направления «Строительство»
Электронное издание локального распространения
Одобрено
редакционно-издательским
советом Саратовского
государственного
технического университета
Саратов – 2006
Все права на размножение и распространение в любой форме остаются за разработчиком.
Нелегальное копирование и использование данного продукта запрещено.
Составитель:, Шошин Евгений Александрович.
Под редакцией Е.А. Шошина
Рецензент И.В. Хомяков
410054, Саратов, ул. Политехническая, 77. Научно-техническая библиотека СГТУ тел. 52-63-81, 52-56-01
http://lib.sstu.ru
Регистрационный
номер 060090 Э
© Саратовский государственный
технический университет, 2006
ВВЕДЕНИЕ
Методические указания предназначены в помощь студентам специальности 290600 (строительные материалы и изделия) всех форм обучения для изучения вопросов, связанных с коллоидным состоянием вещества. В ходе лабораторных работ студенты знакомятся со свойствами золей, механизмами образования коллоидных частиц, изучают условия устойчивости коллоидных систем и методы их разрушения, методы оценки диаметра частиц дисперсной фазы и структурно-механических свойств связано-дисперсных систем. В описании каждой работы имеются краткие сведения по теории изучаемого вопроса, которые следует использовать параллельно с основной литературой для более глубокого изучения соответствующего раздела курса.
В заключительной части настоящего издания приведены методические указания к выполнению контрольной работы, а также список вопросов, выносимых на самостоятельное изучение.
Работа 1. Общие свойства коллоидных систем
Цель работы: получение золя и изучение процесса коагуляции лиофобных золей в присутствии электролитов.
Коллоидными растворами называют микрогетерогенные дисперсные системы с частицами размером от 1 до 100 мкм. Их характеризует не только наличие поверхности раздела между дисперсной фазой (каждой частицей) и дисперсионной средой (растворителем), но и малая устойчивость: коллоидные растворы не образуются самопроизвольно. Коллоидные системы делятся на золи (коллоидные растворы) и гели (коллоидные осадки).
Строение коллоидных частиц.
В основу современных представлений о строении коллоидных частиц легли работы советских ученых А.В. Думанского, Н.П. Пескова, С.М. Липатова, А.Н. Фрумкина, а также зарубежных исследователей Паули, Фаянса, Кройта и др. Строение коллоидных частиц удобнее рассматривать, если проследить процессы образования частиц.
Образование коллоидной частицы AgI происходит в результате реакции:
AgNO3 + KI↔ AgI +KNO3
Молекулы AgI объединяются в практически нерастворимые частицы, в которых ионы Ag+ и I- образуют кристаллическую решетку. Исследования при помощи электронного микроскопа показали, что новообразованные частицы вначале имеют аморфное строение, затем постепенно в них происходит кристаллизация. Если AgNO3 и KI взяты в эквивалентных количествах, то частицы-кристаллы растут, достигая значительной величины, превосходящей размеры коллоидных частиц, и быстро выпадают в осадок. Если же одно из исходных веществ взято в небольшом избытке, то оно служит стабилизатором, сообщающим устойчивость коллоидным частицам AgI. Так, при избытке AgNO3 в растворе будет находиться большое количество ионов Ag+ и NO3- . Однако построение кристаллической решетки AgI согласно правилу Панета-Фаянса может идти только за счет ионов, входящих в ее состав; в данном случае за счет ионов Ag+.
Ионы Ag+ будут продолжать достраивать кристаллическую решетку ядра, прочно входя в его структуру и сообщая ему электрический заряд, определяющий так называемый электротермодинамический потенциал (рис.1). В связи с этим ионы, достроившие кристаллическую решетку ядра, называются потенциалопределяющими ионами. Величина электротермодинамического потенциала, или E-потенциала, у многих коллоидных частиц достигает 1 В. Частицы с таким относительно высоким зарядом будут притягивать оставшиеся в растворе противоположно заряженные (называемые, поэтому противоинами) ионы NO3-. Начинается процесс адсорбции противоинов, в результате которого установится динамическое равновесие между адсорбированными и свободными ионами. Основная часть всех противоинов, адсорбированная на ядре коллоидной частицы, образует вместе с потенциалопределяющими ионами адсорбционный слой. Ядро и адсорбционный слой вместе составляют гранулу (рис.1.1 II, б).
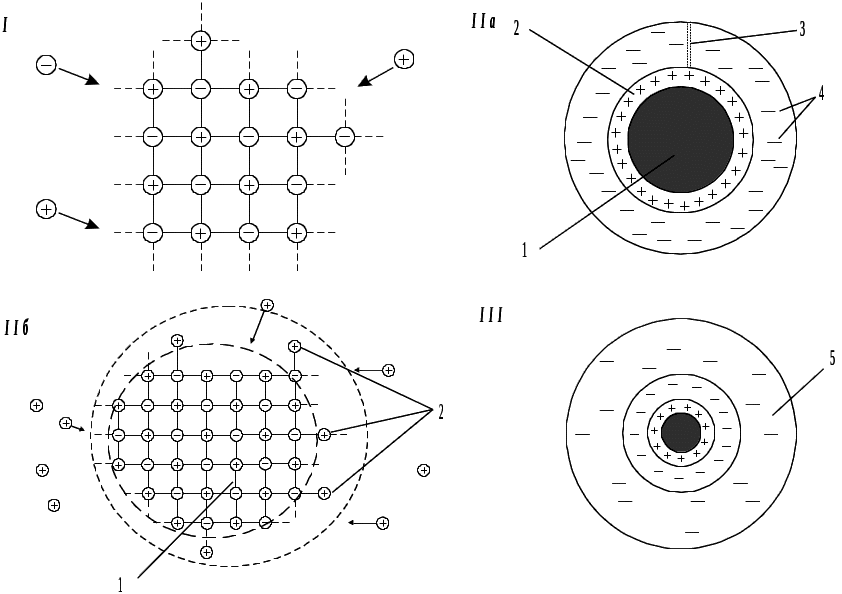
Рис. 1.1. Образование мицеллы AgI в избытке AgNO3:
I – образование ядра по типу кристаллической решетки; II – образование адсорбционного слоя; а – присоединение к ядру потенциалопределяющих ионов, достраивающих кристаллическую решетку: 1 – электронейтральное ядро; 2 – зона достройки ядра потенциалопределяющими ионами; б – адсорбция противоионов: 3 – адсорбционный слой; 4 – противоионы адсорбционного слоя; III – завершение построения коллоидной мицеллы; 5 – диффузный слой, состоящий из противоионов, не вошедших в адсорбционный слой гранулы.
Гранула имеет электрический потенциал того же знака, что и E-потенциал, но величина его меньше и зависит от количества противоинов в адсорбционном слое. Так если 90% их адсорбировано, то потенциал гранулы составит 10% от E-потенциала. Потенциал гранулы называется электрокинетическим или дзета-потенциалом. Кинетическим его называют потому, что он может быть обнаружен и измерен при движении частиц в электрическом поле. Его можно определить так же, как потенциал на границе между адсорбционным (неподвижным относительно частицы) и диффузным (подвижным) слоями.
Остаток противоионов удерживается электростатическими силами притяжения вблизи гранулы, образуя диффузный слой. Гранула вместе с диффузным слоем образует мицеллу (рис.1.1, III). Толщина диффузного слоя различна, так как зависит от ионной силы раствора: чем ионная сила выше, тем толщина слоя меньше. Концентрация противоионов в диффузном слое убывает по направлению к периферии; соответственно к этому убывает и потенциал частицы, падая на границе диффузного слоя до нуля. Таким образом, мицелла всегда электронейтральна.
Устойчивость коллоидных растворов обусловлена присутствием стабилизатора, т.е. электролита, и зависит от величины заряда гранулы. Чем выше этот потенциал, тем сильнее оказываются силы взаимного отталкивания частиц, препятствующие их объединению при столкновениях, наблюдающихся в результате броуновского движения. Исходя из строения коллоидных мицелл AgI в избытке AgNO3, легко представить строение других мицелл. Строение мицелл AgI в избытке KI можно изобразить схемой:
{( AgI)m•nI-• (n-x)K+}x-•xK+
ядро адсорбционный диффузный слой.
Потенциалопределяющими ионами являются I-, а противоионами- K+. Если все противоионы К+ из диффузного слоя переместятся в адсорбционный, то потенциал снизится до нуля и гранула станет электронейтральной (или изоэлектрической):
{(AgI)m•nl-•nK+}.
Строение мицеллы Fe(OH)3.
Гидроокись железа образуется при гидролизе хлорного железа:
FeCl3+3H2O=Fe(OH)3+3HCl
Продукты реакции взаимодействуют:
Fe(OH)3+HCl=FeOCl+2H2O
Образующая хлорокись железа является стабилизатором:
FeOCl= FeO++Cl-
Потенциалопределяющими ионом будет FeO+, так как ион Cl- не входит в состав ядра коллоидных частиц, отсюда их строение должно быть
{[Fe(OH)3]m•nFeO+• (n-x) Cl-}x•nCl-
