
- •Оглавление
- •Предисловие
- •Глава і основы механики печных газов
- •§ 1. Элементы теории подобия
- •§ 2. Общие сведения о свойствах и движении жидкостей и газов
- •§ 3. Статика газов
- •§ 4. Динамика газов
- •§ 5. Движение газов в рабочем пространстве металлургических печей
- •Глава іі основы теплопередачи
- •§ 1. Характеристика процессов теплообмена
- •§ 2. Конвективный теплообмен
- •§ 3. Теплопроводность
- •§ 4. Теплообмен излучением
- •Глава ііі нагрев металла
- •§ 1. Окисление и обезуглероживание стали
- •§ 2. Основы рациональной технологии нагрева стали
- •§ 3. Расчет нагрева металла
- •Глава IV топливо и его сжигание
- •§ 1. Характеристика топлива
- •§ 2. Основы теории горения топлива
- •§ 3. Устройства для сжигания топлива
- •Глава V материалы и строительные элементы печей
- •§ 1. Огнеупорные материалы
- •§ 2. Теплоизоляционные материалы
- •§ 3. Строительные материалы и металлы, применяемые для печей и их элементов
- •§ 4. Строительные элементы печей
- •§ 5. Сооружение печей
- •Глава VI утилизация тепла в метал- лургических печах
- •§ 1. Характеристика методов утилизации тепла в металлургических печах
- •§ 2. Утилизация тепла отходящих дымовых газов с целью предварительного подогрева газа и воздуха
- •§ 3. Утилизация тепла отходящих дымовых газов в теплосиловых устройствах
- •§ 4. Охлаждение печей
- •Глава VII очистка дымовых газов
- •§ 1. Характеристика газоочистных устройств
- •§ 2. Очистка газов доменного производства
- •§ 3. Очистка газов в сталеплавильном производстве
- •§ 4. Очистка газов в ферросплавном производстве
- •ГлаваViii топливные печи и конвертеры,
- •§ 1. Классификация и общая характеристика тепловой работы печей
- •§ 2. Доменные печи
- •§ 3. Сталеплавильные агрегаты
- •§ 4. Нагревательные печи прокатных цехов
- •§ 5. Термические печи прокатных цехов
- •Глава IX электрические печи, применяемые
- •§ 1. Характеристика процесса электрического нагрева
- •§ 2. Дуговые и плазменные печи
- •§ 3. Индукционные печи
- •§ 4. Печи сопротивления
- •§ 5. Электронно-лучевые печи
- •Глава X пуск, эксплуатация и ремонт печей
- •§ 1. Пуск и разогрев печей
- •§ 2. Эксплуатация печей и уход за ними
- •§ 3. Ремонт печей
- •§ 4. Техника безопасности при эксплуатации печей
- •Рекомендательный библиографический список
- •Условные обозначения
- •Предметный указатель
§ 2. Основы теории горения топлива
Характеристика процесса горения
Горением называется процесс взаимодействия топлива с окислителем, сопровождающийся выделением тепла, а иногда и света. Роль окислителя в большинстве случаев выполняет кислород воздуха. Всякое горение предполагает прежде всего тесный контакт между молекулами топлива и окислителя. Чтобы происходило горение, необходимо обеспечить этот контакт, т. е. необходимо смешать топливо с воздухом. Следовательно, процесс горения складывается из двух стадий: смешение топлива с воздухом и воспламенение и горение топлива.
В процессе горения образуется пламя, в котором протекает реакция горения составляющих топлива и выделяется тепло. В технике при сжигании газообразного, жидкого и твердого пылевидного топлив применяют факельный метод сжигания. Факел — это частный случай пламени, когда топливо и воздух поступают в рабочее пространство печи в виде струй, которые постепенно перемешиваются друг с другом. Поэтому форма и длина факела обычно определенные.
При факельном, наиболее распространенном в металлургии и машиностроении сжигании топлива аэродинамическую основу процесса составляют струйные течения.
На практике при создании устройств для сжигания топлива (горелок, форсунок) применяют различные конструктивные приемы (направляют струи под углом друг к другу, создают закручивание струй и др.) с тем, чтобы организовать смешение так, как это необходимо для конкретного случая сжигания топлива.
Различают гомогенное и гетерогенное горения. При гомогенном горении тепло- и массообмен происходят между телами, находящимися в одинаковом агрегатном состоянии. Гомогенное горение протекает в объеме топлива и свойственно газообразному топливу.
При гетерогенном горении тепло- и массообмен происходят между телами, находящимися в разных агрегатных состояниях (в состоянии обмена находятся, газ и поверхность частиц топлива). Такое горение свойственно жидкому и твердому топливам.
Гомогенное горение может протекать в кинетической и диффузионной областях.
При кинетическом горении полное перемешивание топлива с воздухом осуществляют предварительно и в зону горения подают заранее подготовленную топливо-воздушную смесь. В этом случае основную роль играют химические процессы, связанным с протеканием реакций окисления топлива. При диффузионном гомогенном горении процессы смешения и горения не разделены и совершаются практически одновременно. В этом случае процесс горения определяется перемешиванием, так как время смешения больше времени, необходимого для протекания химической реакции.
При гетерогенном горении твердого топлива также различают кинетическую и диффузионную области реагирования. Кинетическая область возникает в том случае,когда скорость диффузии в порах топлива значительно превосходит скорость химической реакции; диффузионная область возникает при обратном соотношении скоростей диффузии и горения.
Процесс горения любого топлива разделяется на две стадии: воспламенение и непосредственное горение.
Процесс воспламенения характеризует собой предварительный период, когда в результате медленного окисления в системе происходит накопление тепла с соответствующим постепенным повышением температуры. При достижении определенной температуры, называемой температурой воспламенения, реакции окисления резко ускоряются и процесс переходит непосредственно в горение.
Температура воспламенения зависит от природы топлива и соответствует практически той наинизшей температуре, при которой начинается интенсивное горение.
Ниже приведены температуры воспламенения в воздухе различных топлив, К:

Чтобы установить пределы воспламенения промышленных газов, являющихся смесью различных горючих компонентов, пользуются правилом аддитивности:
![]() (74)
(74)
где z — искомый нижний или верхний предел воспламенения; z1, z2, x3 — соответствующие пределы воспламенения для горючих компонентов топлива; p1, p2, p3 — процентное содержание отдельных горючих компонентов в смеси (в реальном топливе).
Воспламенение вне концентрационных пределов отсутствует, потому что выделение тепла вне пределов воспламенения невелико и не может компенсировать возникающие тепловые потери.
Горение газообразного топлива
Горение газов осуществляется в объеме и относится к гомогенному горению; оно может происходить в кинетической и диффузионных областях.
Кинетическое горение
После того как произошло воспламенение, наступает процесс распространения пламени, связанный с постоянной передачей тепла от сгоревших к новым порциям топлива. Подобная передача тепла определяется законами теплопроводности и диффузии и зависит от характера пламени. Если пламя распространяется в неподвижной смеси или в смеси, движущейся ламинарно, то основной формой передачи тепла является молекулярная теплопроводность.
Подобный чисто теплопроводный процесс получил название нормального горения.
П ри
турбулентном движении газоокислительной
смеси большую роль приобретает
турбулентная диффузия. При некоторых
условиях распространение пламени
происходит с огромной скоростью и имеет
характер взрывной волны. Подобное
распространение пламени получило
название детонационного горения или
просто детонации.
ри
турбулентном движении газоокислительной
смеси большую роль приобретает
турбулентная диффузия. При некоторых
условиях распространение пламени
происходит с огромной скоростью и имеет
характер взрывной волны. Подобное
распространение пламени получило
название детонационного горения или
просто детонации.
Нормальное горение. После воспламенения горючей смеси возникает определенный фронт горения. Распространение пламени предполагает перемещение этого горения в направлении несгоревших порций газа. Позади фронта горения находятся продукты сгорания, впереди — невоспламенившаяся горючая смесь.
Возникшая при этом разность температур между продуктами сгорания и горючей смесью приводит к передаче тепла теплопроводностью, которая, опережая фронт горения, способствует подогреву новых порций смеси до температуры воспламенения и вызывает перемещение фронта. В большинстве случаев при горении газов фронт пламенч является очень тонким —около 410–2 —610–2 см, поэтому с некоторым приближением его можно рассматривать как поверхность.
При нормальном горении фронт пламени в покоящейся горючей смеси перемещается с определенной скоростью un = n/, где n — расстояние, на которое перемещается фронт пламени за время .
Скорость нормального горения определяется исключительно процессом теплопроводности и потому является физико-химической константой горючей смеси.
По современным
представлениям горение газовой смеси
может быть изображено графически (рис.
43). Самовоспламенение происходит в
точке Tв,
но до
![]() идет химическая реакция, свойственная
индукционному периоду. Быстрая
реакция происходит в коротком интервале
температур от
в до Тг,
который
соответствует химической толщине фронта
пламени р.
Тепловая
толщина фронта бп
представляет собой зону тепловой
подготовки прогрева горючей смеси
до
,
после которой развивается интенсивная
химическая реакция.
идет химическая реакция, свойственная
индукционному периоду. Быстрая
реакция происходит в коротком интервале
температур от
в до Тг,
который
соответствует химической толщине фронта
пламени р.
Тепловая
толщина фронта бп
представляет собой зону тепловой
подготовки прогрева горючей смеси
до
,
после которой развивается интенсивная
химическая реакция.
Для всех горючих газов существует оптимальное соотношение газа и воздуха, при котором скорость нормального горения достигает максимальной величины.
Увеличение температуры подогрева газа или газовой: смеси приводит к существенному увеличению скорости горения.
Горение однородной смеси в турбулентном потоке. Горение при турбулентном режиме — гораздо более распространенный случай в металлургической практике по сравнению с горением в спокойной или ламинарно движущейся среде.
В настоящее время турбулентное горение рассматривается как процесс, протекающий в отдельных перемешивающихся объемах (объемное горение).
На скорость турбулентного горения и на состояние фронта горения большое влияние оказывает общий уровень турбулентности потока. Измерения скорости турбулентного перемещения пламени показали, что отношение скорости турбулентного распространения пламени к нормальной скорости uт/uн быстро возрастает с увеличением числа Rе.
Это увеличение происходит в результате изменения uт, так как uн — const.
Диффузионное горение
В настоящее время широко распространен диффузионный метод сжигания газообразного топлива, при котором смешение и горение происходит в одном объеме. Поэтому процессы смешения при диффузионном горении играют первостепенную роль.
Процессы смешения между струями топлива и воздуха могут протекать при ламинарном и турбулентном течениях этих струй. В первом случае смешение определяется молекулярной диффузией, во втором — турбулентной диффузией.
На рис. 44 представлена упрощенная схема распределения концентраций в ламинарном пламени. Как видно, кислород полностью отсутствует внутри объема, ограниченного фронтом пламени, так же как топливо отсутствует за пределами этого объема.
Расчеты и опыты показали, что высота пламени пропорциональна скорости подачи газа и обратно пропорциональна коэффициенту диффузии.
Если рассматривать факел, образующийся при вытекании горючего газа в неограниченную спокойную среду, то при определенной (критической) скорости ламинарный факел начнет переходить в турбулентный.
Критическое значение критерия Rекр, при достижении которого начинается переход ламинарного пламени в турбулентное, зависит от вида топлива, динамических характеристик потока и влияния на них процесса горения.
Горение жидкого топлива
В условиях промышленных печей жидкое топливо (обычно мазут) сжигают в распыленном состоянии. Поэтому в основном комплексный процесс сжигания жидкого топлива складывается из процессов: 1) распыливания; 2) воспламенения, которому предшествует и способствует процесс смешения, подогрева и испарения топлива и 3) горения капель жидкого топлива.
Основой процесса распыливания топлива является дробление жидкости распылителем, происходящее в том случае, если давление движущегося распылителя превышает действие поверхностного натяжения.
Распыленное жидкое топливо, попав в среду с высокой температурой, начинает испаряться. Около поверхности капли (рис. 45) образуется паро-воздушная смесь, которая воспламеняется первой. Температуру, при которой происходит воспламенение паро-воздушыой смеси, называют температурой вспышки топлива.
Температура кипения жидких топлив всегда ниже температуры воспламенения, поэтому горение жидкого топлива в основном происходит в паровой фазе. Процесс горения паро-воздушной смеси и процесс испарения тесно связаны между собой. При горении жидкого топлива происходит процесс теплообмена между газовой средой и поверхностью жидкости, т.е. между средами, находящимися в разных агрегатных состояниях, что придает всему процессу гетерогенный характер.
Горение твердого топлива
Г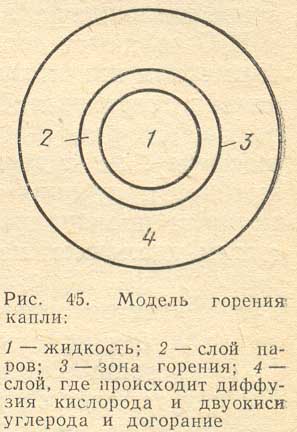 орение
твердого топлива относят к гетерогенным
процессам, хотя в нем и встречаются
элементы гомогенного горения (горение
летучих).
орение
твердого топлива относят к гетерогенным
процессам, хотя в нем и встречаются
элементы гомогенного горения (горение
летучих).
Процесс горения твердого топлива может быть разделен на следующие стадии: подогрев и подсушка топлива; процесс пирогенного разложения топлива с выделением летучих и образованием коксового остатка; горение летучих, горение коксового остатка (углерода).
П ри
подогреве топлива до 473 К и выше протекает
процесс выделения летучих, т.е. горючей
смеси различных газообразных
составляющих: Н2,
СО, СО2,
СН4,
СnНm,
Н2О
и др. Количество летучих для разных
углей различно и для некоторых из
них весьма велико по отношению к
массе всего топлива (табл. 8). Температура
начала выделения летучих зависит от
возраста угля. Чем старше уголь, чем
выше в нем содержание углерода, тем при
более высокой температуре начинается
процесс выделения летучих. Летучие в
процессе горения твердого топлива
играют важную роль.
ри
подогреве топлива до 473 К и выше протекает
процесс выделения летучих, т.е. горючей
смеси различных газообразных
составляющих: Н2,
СО, СО2,
СН4,
СnНm,
Н2О
и др. Количество летучих для разных
углей различно и для некоторых из
них весьма велико по отношению к
массе всего топлива (табл. 8). Температура
начала выделения летучих зависит от
возраста угля. Чем старше уголь, чем
выше в нем содержание углерода, тем при
более высокой температуре начинается
процесс выделения летучих. Летучие в
процессе горения твердого топлива
играют важную роль.
При горении кускового топлива летучие выделяются при сравнительно умеренных температурах, смешиваются с воздухом и воспламеняются первыми. Таким образом, горением летучих начинается процесс горения топлива. Тепло, выделяемое при горении летучих, способствует повышению температуры и дальнейшему развитию процесса горения. Горение углерода начинается после завершения выхода летучих, так как вначале кислород расходуется на горение летучих. Процесс горения углерода продолжителен и он определяет общее время протекания процесса.
Горение полное и неполное
В металлургической практике в большинстве случаев применяется полное горение, продукты которого не содержат каких-либо горючих компонентов. Все виды топлива содержат углерод и водород, в состав продуктов полного сгорания входят углекислый газ, водяные пары и азот. СО2 и Н2О являются достаточно сильными окислителями, поэтому металл при нагреве в продуктах полного сгорания значительно окисляется. Для того чтобы избежать окисления металла, его надо нагревать в газовой среде (защитной атмосфере), не содержащей газов-окислителей. Одним из методов получения таких атмосфер является метод, при котором производится неполное сжигание газа с последующим удалением из продуктов неполного сжигания газоз-окислителей. Неполное горение применяют также тогда, когда стремятся снизить окисление или обезуглероживание металла без использования специальных атмосфер.
В настоящее время наиболее распространенным газообразным топливом является природный газ, состоящий в основном из метана.
При полном горении метана при стехиометрическом соотношении СН4+2О2 = СО2+2Н2О продукты сгорания, кроме азота, поступившего с воздухом, будут содержать СО2 и Н2О. Если увеличить количество кислорода выше стехиометрического, т.е. на молекулу СН4 подать более двух молекул О2, то в продуктах сгорания будет содержаться еще и кислород. Но если количество кислорода ниже стехио-метрического, т.е. в реакции СН4+mО2СО2+Н2О+Н2+ +СО m<2, то происходит неполное горение топлива. При этом в продуктах сгорания наряду с N2, СО2 и Н2O содержатся восстановительные газы Н2 и СО, которые способны окисляться (гореть) с выделением тепла. Это и является причиной потерь тепла в результате химического недожога. Поскольку в продуктах неполного сгорания концентрация газов-окислителей СO2 и Н2О значительно ниже, чем при полном горении, постольку окисление металла при нагреве в подобной среде будет меньше. При определенном значении т состав продуктов неполного сгорания может быть определен по константе равновесия реакции водяного газа Кр=рСОрН2О/(рСО2рН2), где рі, — парциальное давление соответствующего компонента.
Значения константы равновесия реакции водяного газа следующие:
![]()
Расчеты горения топлива
При горении топлива в качестве окислителя используют кислород воздуха. В результате образуются продукты сгорания и развивается определенная температура горения. Поэтому расчеты горения топлива выполняются с целью определения:
а) количества необходимого для горения воздуха;
б) количества и состава продуктов сгорания;
в) температуры горения.
Расход воздуха
Расходы воздуха можно определять как в объемных, так и в массовых единицах.
Для уяснения методики определения расхода воздуха рассмотрим полное горение метана (СН4) по реакции СН4 + 2О2 = СО2+2Н2О.
Сначала определим расход воздуха в объемных единицах. Как следует из приведенной реакции, для сжигания 1 моля СН4 требуется 2 моля О2. Поскольку 1 кмоль любого газа занимает при нормальных условиях одинаковый объем (22,4 м3), то для сжигания 22,4 м3 СН4 потребуется 222,4=44,8 м3 О2. Таким образом, для сжигания 1 м3 СН4 требуется 2 м3 О2, но в сухом воздухе кислород по объему составляет 21%, остальные 79% приходятся на долю азота. Следовательно, количество азота в воздухе в 3,762 раза больше количества кислорода. Поэтому расход воздуха на сжигание 1 м3 метана составит 2+23,762=9,524 м3.
Аналогичный расчет
можно провести и в массовых единицах.
Подобные расчеты чаще делают для твердого
или жидкого топлива. Возьмем, например,
горение углерода С + О2
= СО2.
Из этой реакции видно, что на 1 кмоль С
расходуется 1 кмоль О2,
но 1 кгмоль
С имеет массу, равную 12 кг, а кгмоль
О2
32 кг; следовательно, для сжигания 1 кг С
потребуется
![]() кг
кислорода. В воздухе кислород по массе
составляет 23,2%, а азот 76,8%. Поэтому вместе
с кислородом войдет азота
кг
кислорода. В воздухе кислород по массе
составляет 23,2%, а азот 76,8%. Поэтому вместе
с кислородом войдет азота
![]() кг.
кг.
Следовательно, для сжигания 1 кг углерода потребуется воздуха 2,67+8,83=11,50 кг. Это количество можно перевести в объемное, поделив общую массу воздуха на его плотность (1,293 кг/м3), т.е. 11,50/1,293=8,89 м3.
Как при горении метана, так и при горении углерода полученные по реакциям количества кислорода и воздуха представляют собой те наименьшие количества, которые необходимы для полного окисления единицы горючего вещества. Такое наименьшее необходимое количество воздуха (кислорода) называется теоретическим количеством. На практике, однако, сжигание топлива осуществляется при расходах воздуха, несколько превышающих теоретическое количество. Величина, показывающая отношение действительного расхода воздуха (Vд) к теоретическому количеству (Vт), называется коэффициентом избытка воздуха п =Vд/Vт и играет на практике очень важную роль.
Более универсальной
величиной является коэффициент расхода
кислорода (п0),
который
показывает отношение действительного
расхода кислорода (![]() )
к теоретически необходимому (
)
к теоретически необходимому (![]() ),
т.е.
),
т.е.
![]() .
.
Коэффициент избытка воздуха пригоден только для полного сгорания топлива в воздухе.
При неполном же сгорании, когда подаваемое количество кислорода меньше теоретического, применим только коэффициент расхода кислорода, который становится меньше единицы. При применении обогащенного дутья, в котором количество кислорода превышает 21%, характерным также является коэффициент расхода кислорода. В этом случае метод определения расхода дутья аналогичен выше изложенному с той лишь разницей, что изменяется соотношение между азотом и кислородом.
Всякое промышленное топливо представляет собой механическую или химическую смесь отдельных горючих элементов, поэтому общий расход воздуха (кислорода) определяется суммированием аналогичного расхода для отдельных элементов.
Состав и количество продуктов сгорания
Состав и количество продуктов сгорания определяют по методу, применяемому для определения расхода воздуха. Рассмотрим снова пример полного горения метана при коэффициенте избытка, равном единице. В результате горения образуются СО2 и Н2О. Кроме того, в продуктах сгорания будет присутствовать N2, внесенный с воздухом.. Определим последовательно количество каждой составляющей продуктов сгорания. При сжигании 1 м3 метана образуется СО2 1м3 и Н2О 2 м3. Кроме того, с воздухом вносится 23,762 = 7,524 м3 N2. Таким образом, полное количество продуктов сгорания составит 1 м3 + 2 м3 + 7,524 м3 = 10,524 м3.
Состав продуктов сгорания следующий:
![]() ;
;
![]() ;
;
![]() ;
;
Если бы СН4 сжигали с коэффициентом избытка воздуха, превышающим единицу, то общее количество продуктов сгорания возросло бы в связи с увеличением количества азота и наличием в продуктах сгорания избыточного кислорода.
При сжигании топлива в обогащенном кислородом воздухе наблюдается обратная картина.
При расчетах горения необходимо составлять материальный баланс процесса, путем определения исходных веществ и продуктов сгорания.
Температура горения
Под температурой горения понимают ту температуру, которую приобретают продукты сгорания в результате сообщения им тепла, выделенного при сжигании. Различают теоретическую и калориметрическую температуру горения.
Продукты сгорания топлива нагреваются до высоких температур, при которых возможна диссоциация СО2 и Н2О, достигающая иногда 10%. В результате диссоциации происходит изменение объема и уменьшается выделяемое количество тепла, так как в процессе диссоциации поглощается тепло. Теоретическая температура горения определяется с учетом диссоциации в продуктах сгорания, т.е.
![]() ,
,
где
![]() — теплота
сгорания топлива, Дж/м3,
или Дж/кг;
— теплота
сгорания топлива, Дж/м3,
или Дж/кг;
qдисс — тепло, пошедшее на процесс диссоциации, Дж;
Vпр — объем продуктов сгорания, образующихся при сгорании единицы топлива, м3;
с — удельная теплоемкость продуктов сгорания, кДж/(м3К).
Калориметрическая
температура определяется из условия,
что все выделившееся при горении тепло
расходуется только на повышение
температуры продуктов сгорания. Иными
словами, калориметрическая температура
горения определяется для адиабатных
условий, когда отсутствует теплообмен
с внешней средой. Следовательно,
![]() .
.
При наличии подогретого воздуха (или топлива) калориметрическую температуру можно определить из выражения
![]() ,
,
где Qф — физическое тепло подогрева воздуха и топлива.
На практике обычно определяют калориметрическую температуру горения, которая является одной из характеристик топлива.
Расчет калориметрической температуры выполняют из условий полного сгорания топлива следующим образом. Продукты сгорания любого топлива представляют собой смесь различных газообразных составляющих СО2, Н2О, N2, О2, SО2. Каждой из этих составляющих при той или иной температуре присуща вполне определенная величина теплоемкости. Это дает возможность определить теплоемкость продуктов сгорания в целом для соответствующей температуры.
Энтальпия продуктов сгорания, как смеси газов, определяют аналогично определению теплоемкости продуктов сгорания.
Количество тепла, которое выделяется при горении единицы топлива, равно произведению энтальпии на объем продуктов сгорания, образовавшихся от сгорания единицы топлива Q = IV.
Однако возможна и обратная постановка задачи. Дело в том, что для продуктов сгорания определенного состава каждой величине теплоемкости 1 м3 продуктов сгорания соответствует вполне определенная температура. Другой теплоемкости будет соответствовать и другая температура. Подобный метод определения температуры по величине теплоемкости (или энтальпии) продуктов сгорания широко применяется в расчетах.
