
- •1. Растворы. Общая характеристика растворов.
- •2. Способы выражения состава растворов.
- •3. Понятие о химическом эквиваленте и факторе эквивалентности.
- •4. Объемный или титрометрический анализ, его сущность и методы.
- •5. Кислотно–основное титрование применение в медицине. Кислотно – основанные индикаторы.
- •6. Окислительно–восстановительные реакции. Оксидиметрия. Пермангонатометрия и иодометрия. Применение данного метода в медицине.
- •7. Основные понятия термодинамики: система, процесс, параметры, функции состояния.
- •8. Первое начало термодинамики. Энтальпия.
- •9. Закон Гесса и следствия из него.
7. Основные понятия термодинамики: система, процесс, параметры, функции состояния.
Процесс- это переход системы из одного состояния в другое, сопровожд.необратимым или обратимым изменением хотя бы одного параметра,хар.данную систему.
Системаой называют тело или группу взаимод.тел, фактически или мысленно выделяемых из окруж.среды.
Открытая система обменивается с окр.срредой энергией и веществом.
Закрытой называт систему, в которой отсутствием обмнеа энергией и веществом с окр.средой, но она может обмениваться с ней энергией.
Изолированнаая система хар. отсутствием обмнеа энергией и в-вом с окр.средой.
Экстенсивные параметры- параметры, значения которых пропорциональны числу частиц в системе(масса,объем,кол-во в-ва)
Интенсивные параметры- параметры, значения которых не зависит от кол-ва частиц в системе( температура, давление)
Параметры, описывающие сост.ситемы, назыв.функциями. Термодинами́ческая фу́нкция состоя́ния — в термодинамике некая функция, зависящая от нескольких независимых параметров, которые однозначно определяют состояние термодинамической системы. Значение термодинамической функции состояния зависит только от состояния термодинамической системы и не зависит от того, как система пришла в это состояние. Частным случаем функций состояний являются термодинамические потенциалы.
8. Первое начало термодинамики. Энтальпия.
1 з.термодинамики.: энергия не исезает и не появл.вновь. она только переходит из одного состояния в другое в строго эквивалентных кол-вах.
![]()
Сообщенная системе теплота расходуется на приращение внутренней энергии и на совершение работы против внешних сил:
![]()
Энтальпия — это энергосодержание системы, включающее внутреннюю энергию и работу. Тогда
![]()
Кол-во теплоты ,которое выделяется или поглащается при проведении хим.р-ций в изобарно-изотермических условиях, характер. изменением этальпии системы и назыв. энтальпией р-ции.
Энтальпия очень зависит от агригатного состояния в-в.Энтальпия простых в-в = 0.
Энтальпия образования – теплота, которая образ. При образовании из простых в-в в сложные.
9. Закон Гесса и следствия из него.
Тепловой эффект хим.р-ции зависит только от природы и состояния исходных в-в и конечных продуктов р-ции и не зависит от пути реализации процесса,т.е. от пути перехода от начального сост.. к конечному.
![]()
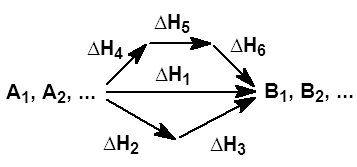
Следствие из з.Гесса: энтальпия р-ции образования равна разности алгебр.суммы энтальпий обр.всех продуктов р-ции и алгебр. суммы энтальпий обр.всех исходных в-в.
![]()
Энтальпия р-ции сгорания равна разности алгебр.суммы теплот сгорнаия исх.в-в и алгебр.суммы теплот сгорания конечных продуктов р-ции:
![]()
Энтальпия прямой р-ции численно равна энталььпии обратной р-ции, но противоположна по знаку.
