
- •Введение
- •Глобины
- •Миоглобин
- •Гемоглобин
- •Четвертичная структура гемоглобина
- •Присоединение кислорода к гемоглобину и сопровождающие его изменения третичной структуры
- •Функциональная роль четвертичной структуры гемоглобина
- •Участие гемоглобина в транспорте со2 и ионов водорода
- •Список литературы
- •1.Степанов в.М. Молекулярная биология. Структура и функции белков. Москва, Высшая школа 2002 г.
Участие гемоглобина в транспорте со2 и ионов водорода
Кооперативные эффекты четвертичной структуры определяют способность гемоглобина выполнять помимо переноса кислорода ряд других транспортных функций, важных для физиологии кровообращения.
Гемоглобин переносит ионы водорода и СО2 направляющиеся в тканях, к легким. Перенос ионов водорода обусловлен так называемым эффектом Бора. Как уже говорилось, при насыщении гемоглобина кислородом рвутся, а при его отщеплении — восстанавливаются ионные связи между отдельными функциональными группами. Разрыв или, наоборот, образование ионных связей сказывается на способности функциональных групп связывать протон. . Это особенно характерно для сравнительно слабых оснований, рКа которых близок к физиологическому значению рН. В таком случае уже небольшие изменения рКа существенно влияют на способность группы присоединять и, значит, переносить протон. Такими группами являются а-аминогруппа и имидазольная группа гистидина. Так, в оксигемоглобине имидазольная группа С-концевого His-143 в-цепей свободна и имеет, по-видимому, нормальный рК а для гистидина, близкий 6. После отщепления кислорода в тканях эта имидазольная группа восстанавливает ионную связь с карбоксилатанионом остатка Asp-94 той же цепи, т.е. оказывается в поле отрицательного заряда. Понятно, что протон с большим трудом может покинуть имидазолий-катион, если положительный заряд последнего компенсирован сближенной с ним отрицательно заряженной группой.
Таким образом, способность имидазольного кольца С-концевого гистидина к связыванию протона регулируется положением этого кольца в пространственной структуре, его участием или неучастием в ансамбле с карбоксильной группой. Как следствие, дезоксигемоглобин, а котором основность имидазольной группы His- 143 возрастает, присоединяет протон и переносит его от тканей к легким, где при насыщении гемоглобина кислородом и переходе его четвертичной структуры в релаксированную R-форму ион водорода отщепляется.
Перенос СO2 гемоглобином обусловлен его способностью присоединяться к а-аминогруппам белка с образованием так называемой карбаминовой кислоты — полуамида угольной кислоты:
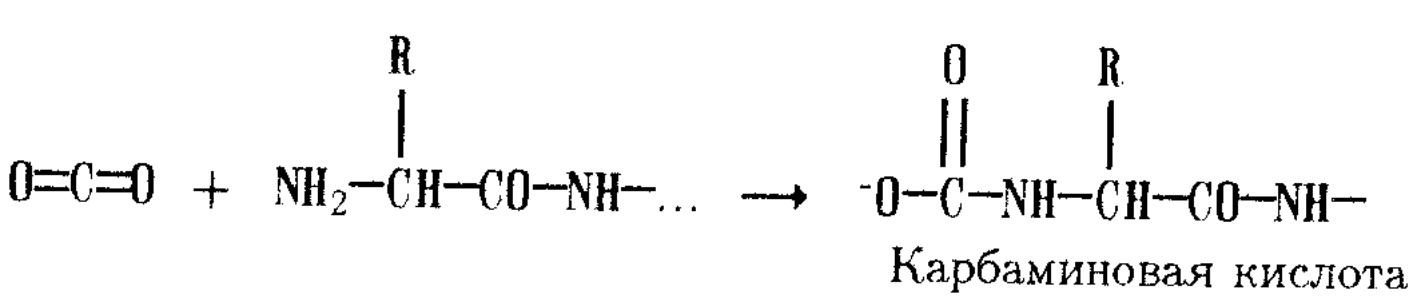
Эта реакция протекает в тканях с аминогруппами дезоксигемоглобина. Появившиеся отрицательно заряженные остатки карбаминовой кислоты вступают в ионные взаимодействия с катионными группами белка, дополнительно стабилизируя дезоксиформу. В легких при насыщении гемоглобина кислородом протекает обратная реакция, которая ведет к выделению СО2
Список литературы
1.Степанов в.М. Молекулярная биология. Структура и функции белков. Москва, Высшая школа 2002 г.
