
- •Введение
- •Глобины
- •Миоглобин
- •Гемоглобин
- •Четвертичная структура гемоглобина
- •Присоединение кислорода к гемоглобину и сопровождающие его изменения третичной структуры
- •Функциональная роль четвертичной структуры гемоглобина
- •Участие гемоглобина в транспорте со2 и ионов водорода
- •Список литературы
- •1.Степанов в.М. Молекулярная биология. Структура и функции белков. Москва, Высшая школа 2002 г.
Присоединение кислорода к гемоглобину и сопровождающие его изменения третичной структуры
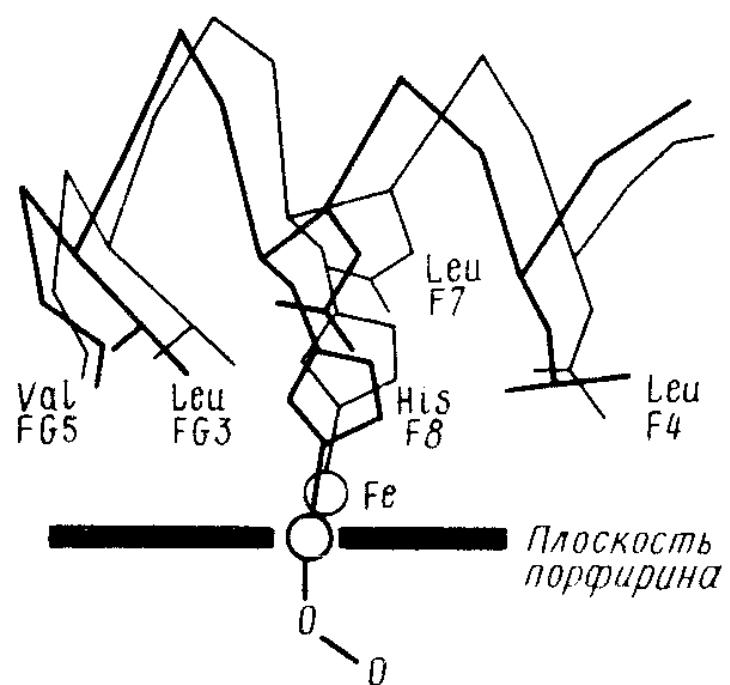
Рис. 8.6. Изменения конформации вблизи гема, сопровождающие присоединение кислорода к атому железа и переход субъединицы гемоглобина из дезокси- в оксиформу
Атом железа втягивается в плоскость порфиринового кольца, что вызывает смещение связанного с ним остатка гистидина F8, за которым следует движение всей спирали F и поворотатомом железа гема и имидазольной группой дистального гистидина, которая, видимо, образует с одним из атомов кислорода водородную связь.
Присоединение кислорода изменяет электронное состояние атома железа, который до этого находился как бы «над» плоскостью гема, а теперь смещается на 0,4 —0,8 А, приближаясь к кислороду и втягиваясь в плоскость порфиринового кольца . Это движение приводит к соответственному смещению имидазола проксимального гистидина, образующего с железом связь, близкую к ковалентной. Смещение имидазола вызывает далее смещение всего остатка гистидина His и всей a-спирали F, в которой этот остаток расположен. Понятно, что вменение структуры, начатое небольшим перемещением атома железа, схватывает немало атомов белка.
Важным последствием такого структурного перехода является то, что боковая в -оксибензильная группа остатка тирозина Туг НС2, располагавшаяся в дезоксигемоглобине между спиралями F и Н, из-за их сближения вынуждена покинуть это место в структуре и выйти на поверхность молекулы. Заметим, что остаток Туг НС2 предшествует С-концевомуArg HC3.
Резкое изменение позиции соседнего тирозина влечет за собой и изменение в расположении этого остатка аргинина, а значит, сразу двух заряженных групп: a-карбоксилат-иона и гуанидиниевой группировки, которыми он обладает. До присоединения кислорода заряженные функциональные группы С-концевого остатка Arg HC3 одной из a-цепей (а1-цепи) участвовали в образовании двух солевых связей. Карбоксилат-ион взаимодействовал с протонированной а-аминогруппой N-концевоцо остатка другой a-цепи (а2), обслуживая а1— а2-контакт. Катионная гуанидогруппа образовывала соль с карбоксилатионом Asp- 126 в той же цепи a1. После присоединения кислорода С-концевой аргинин утрачивает обе эти связи и приобретает способность практически свободно вращаться. То же происходит и с C-концевым аргинином цепи а2, так что в оксигемогло- бине контакт между одноименными субъединицами a1— a2, и без того слабый, становится мало существенным.
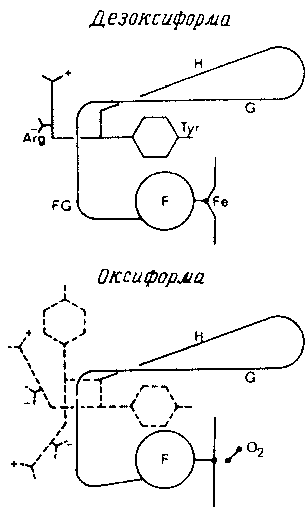
Рис. Передача эффекта смещения спирали F на С-концевой аргинин
Боковая цепь тирозина Туг НС2 из-за сближения спиралей F, и G оказывается «вытолкнутой» из пространства между ними, что приводит в движение С-концевой остаток аргинина (показано пунктиром). Это влечет за собой разрыв солевых мостиков, в которых участвуют концевые остатки аминокислот
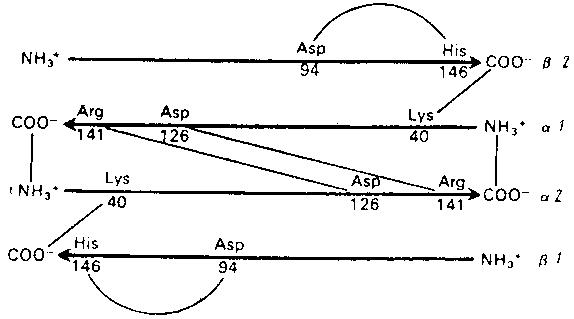
Рис. Схема электростатических взаимодействий (показаны тонкими линиями) в молекуле гемоглобина
Субъединицы условно изображены стрелками, направленными к С-концевом.
При присоединении кислорода (оксигенировании) эти связи утрачиваются Аналогично, в результате присоединения молекулы кислорода к C-концу в-субъединицы (Рв2) происходит конформационная перестройка, начинающаяся со сближения дистального гистидина с железом гема. Fе итогом оказывается разрыв солевых связей С-концевого остатка Нis-146. Одна из них между карбоксилатионом С-концевого гистидина и протонированной аминогруппой лизина Lys-40 цепи другая — между имидазолий-катионом His- 146 и карбоксилатом Asp-94 же цепи в2. Это влечет за собой ослабление контакта a1—в2 .
